|
|
Электрокинетический потенциалВернемся к вопросу о заряде коллоидных частиц, от которого в существенной мере зависит их агрегативная устойчивость. Возникновение этого заряда частиц связано с избирательной адсорбцией ионов из раствора. В ряде случаев частицы могут приобретать заряд за счет собственной ионизации. Так, например, кислые красители отщепляют в воде ионы водорода, а остающиеся на поверхности анионы составляют отрицательную обкладку у двойного слоя. Ионы, несущие противоположный заряд, притягиваются к заряженной поверхности. При этом образуется двойной электрический слой. Между твердой заряженной поверхностью и жидкостью возникает разность потенциалов – скачок потенциала. Величина общего скачка потенциала определяется плотностью заряда на твердой частице и представляет собой разность между этим зарядом и точкой, находящейся в дисперсионной среде. Противоионы размещаются как в плотной части двойного слоя, так и в диффузной области. Падение потенциала в диффузном слое будет меньше общего скачка потенциала, поскольку часть заряда частицы скомпенсирована противоионами, находящимися в плотной части двойного электрического слоя. Очевидно, что это падение потенциала в диффузной части будет тем меньше, чем меньше противоионов этот слой включает. Однако коллоидные частицы находятся в постоянном движении. Это создает условия, порождающие возникновение электрохимического потенциала. При направленном движении жидкости относительно твердого тела (или, наоборот, твердого тела относительно жидкости) на поверхности твердого тела сохраняется неподвижный слой жидкости. Таким образом, скольжение жидкой фазы относительно твердой происходит не непосредственно на границе твердая фаза – жидкость, а в самой жидкости на расстоянии Δ от твердой фазы. Эта величина Δ имеет молекулярные размеры, т.е. сравнимые с таковыми молекул. Часть противоионов остается в этом неподвижном слое жидкости, часть – в движущейся. Разность потенциалов между неподвижной частью системы и подвижной получила название электрокинетический потенциал или дзета-потенциал, поскольку он обозначается греческой буквой «дзета». Он отличается от падения потенциала в диффузном слое. Это объясняется тем, что граница скольжения часто не совпадает с границей между слоем Гельмгольца и слоем Гуи, а отстоит на некотором расстоянии от этой границы и сдвинута в сторону жидкости. Таким образом, величина электрокинетического потенциала зависит не только от характера падения потенциала в двойном и диффузном слоях, но и от характера движения жидкости вблизи твердой поверхности, что в свою очередь определяется свойствами жидкости. Отметим, что величина и плотность заряда твердой поверхности больше суммарного заряда твердой поверхности и связанной с ней неподвижно жидкости, поскольку последняя включает некоторую часть противоионов. Чем больше концентрация противоионов в связанной жидкости, тем меньше суммарный заряд движущейся частицы и тем меньше электрокинетический потенциал. Именно величина электрокинетического потенциала определяет силу отталкивания между коллоидными частицами и тем самым агрегативную устойчивость системы. На величину электрокинетического потенциала по современным представлениям оказывают влияние многие свойства коллоидных систем: 1) концентрация ионов в растворе: чем больше концентрация ионов, тем большее количество противоионов накапливается в твердом слое и тем меньше их будет в диффузной области; 2) заряд противоионов: чем больше заряд противоионов, тем сильнее они притягиваются к заряженной поверхности твердого тела, тем тоньше диффузный слой и соответственно меньше величина дзета-потенциала; 3) полярность противоионов: чем больше поляризуемость противоионов, тем больше дополнительные силы притяжения и тем тоньше становится слой Гельмгольца; 4) лиофильность: оболочка из молекул растворителя снижает силу взаимодействия между поверхностью твердого тела и противоионами. чем прочнее сольватная оболочка, тем толще диффузный слой и тем больше электрокинетический потенциал. Обратимость коагуляции. Пептизация Лиофобные системы значительно различаются по свойствам в зависимости от степени их лиофилизации. Особенно ярко проявляется это различие при изучении их обратимости – способности коагулированных систем к пептизации. Пептизацией или дезагрегацией называется процесс, обратный коагуляции, а именно – переход коагулята в золь. Пептизация тем более вероятна, чем более лиофилизирован исходный золь и чем меньше времени прошло с момента коагуляции, ибо с течением времени при ближнем взаимодействии постепенно происходит срастание частиц с уменьшением дисперсности и поверхностной энергии. В этом случае коагуляция принимает необратимый характер, и пептизация исключается. Практически пептизацию проводят в зависимости от причин, вызывающих коагуляцию. В случае концентрационной коагуляции, наступающей при С > Скр, следует, очевидно, отмыть коагулянт от электролита (используя декантацию, фильтрацию или диализ). В случае адсорбционной коагуляции, связанной с уменьшением электрического потенциала, следует повысить поверхностный заряд и потенциал частицы путем добавления электролита, содержащего потенциалобразующие ионы. Студни и гели Большинство лиофильных и некоторые лиофобные золи в определенных условиях превращаются в желатиноподобные массы, получившие название студней и гелей. Процесс желатинообразования – один из видов коагуляции, который не приводит к образованию осадка, а связывает растворитель и переходит в полужидкое – полутвердое состояние. По своим свойствам студни делятся на хрупкие и эластичные. Название гели обычно применяют для обозначения хрупких студней. Если из них выделить растворитель, то они сохраняют свою первоначальную форму и объем и могут поглотить ту или иную жидкость, подобно пористым телам. Эластичные студни (клей, желатин, каучук и др.) при выделении жидкой фазы уменьшаются в объеме и могут поглощать не любую жидкость, а только жидкость определенного химического состава: желатин – воду, каучук – некоторые органические растворители, т.е. процесс является специфичным. Поглощение сопровождается увеличением объема и называется набуханием. Студни способны к набуханию при соприкосновении не только с жидкой фазой, но и соответствующим паром. 4. Свойства растворов Набухание и растворение ВМС При растворении ВМС, в отличие от НМС, обычно вначале происходит набухание, т.е. проникновение небольших и подвижных молекул растворителя в полимер. Молекулы растворителя ослабляют связи между молекулами ВМС ("раздвигают" молекулы ВМС). При растворении можно выделить четыре стадии существования системы (рис. 4.1).
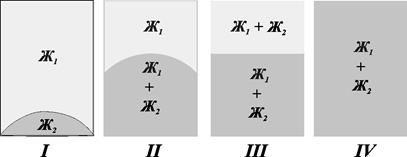
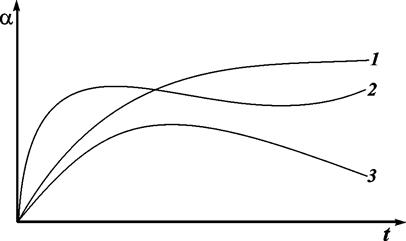
Рис.4.1. Изображение различных стадий набухания и растворения ВМС В исходном состоянии система состоит из двух индивидуальных веществ – растворителя и полимера (I). Далее происходит набухание полимера и образование студнеобразного раствора низкомолекулярного растворителя в полимере ж1/ж2, погруженного в чистый растворитель ж1 (II). В дальнейшем вследствие увеличения расстояния между макромолекулами и ослабления связей между ними происходит отрыв макромолекул и переход их в раствор. Образуются два раствора: жидкий – полимера в растворителе – ж1/ж2 и студнеобразный – растворителя в полимере –ж2/ж1 (III). В этом случае говорят об ограниченном набухании. В пределе наблюдается равномерное распределение молекул ВМС по всему объему низкомолекулярного растворения с образованием истинного раствора (IV). Способность к набуханию в различных растворителях измеряется степенью набухания a. Величина a – это отношение массы, поглощенной низкомолекулярной жидкости к массе исходного полимера: a = m-mo/mo, где mo и m – масса полимера до и после набухания. Часто о набухании судят не по привесу, а по увеличению объема образца. На рис. 4.2 изображены типичные кинетические кривые для процессов ограниченного (1,2) и неограниченного (3) набухания.
Рис. 4.2. Типичные кинетические кривые набухания Кривая 2 соответствует случаю частичного растворения полимера. Нередко такое ограниченное набухание при нагревании переходит в неограниченное (желатин в воде до 30 оС набухает ограниченно и неограниченно при t > 30 оС). Степень и скорость набухания зависят от сродства полимера к данному растворителю и от формы и строения его макромолекул. Неполярные полимеры, имеющие гибкие молекулы, неограниченно растворяются в неполярных жидкостях (каучук – в углеводородах). Появление поперечных связей приводит к ограниченному набуханию (резина, вулканизированный каучук – в тех же углеводородах). Сильно полярные полимеры с жесткими цепями (целлюлоза) с неполярными жидкостями вообще не взаимодействуют, а в полярных только ограниченно набухают. Соединения, макромолекулы которых имеют глобулярную структуру, растворяются без набухания. Если набухающий полимер поместить в сосуд, то этот полимер может оказывать на стенки значительное давление, называемое давлением набухания. Величина давления набухания оказывается максимальной на начальных стадиях процесса и может достигать десятков мегапаскалей. 4.2. Термодинамические свойства растворов Свойства растворов ВМС тесно связаны со строением, размерами и гибкостью макромолекул в растворе, а также энергией их взаимодействия с растворителем. Последний фактор особенно важен, поскольку сродство полимера к растворителю определяет форму молекулярных клубков. Как любые высокодисперсные системы, частицы которых подвержены тепловому давлению, растворы ВМС проявляют осмотическое давление. Осмотическое давление разбавленных идеальных растворов НМС описывается уравнением Вант-Гоффа:
где с – мольно-объемная концентрация; m – концентрация растворенного вещества, выраженная в единицах массы. Оно является количественным, т.е. определяется только концентрацией частиц в растворе. Осмотическое давление ВМС вследствие их больших молекулярных масс невелико. Однако даже в сравнительно разбавленных растворах ВМС измеренное осмотическое давление (рис. 4.3., кривая 1) оказывается большим, чем вычисленное по уравнению Вант-Гоффа (кривая 2).
Рис. 4.3. Зависимость осмотического давления от концентрации раствора ВМС (1) и НМС (2) Степень отклонения больше в растворителях, которые обеспечивают более высокую гибкость полимера. Объясняется это тем, что для длинных гибких макромолекул характерна так называемая сегментарная форма молекулярно-кинетического движения. Отдельные части (сегменты) макромолекулы, расположенные достаточно далеко друг друга, оказываются независимыми в своем тепловом движении. Поэтому молекула ведет себя в растворе, как несколько молекул меньшего размера или несколько отдельных кинетических элементов. Чем более гибка и асимметрична молекула в растворе, тем более осмотическое давление отличается от вычисленного. Поэтому для описания зависимости осмотического давления от концентрации полимеров было предложено уравнение:
где b – коэффициент, учитывающий форму (гибкость) макромолекул в растворе и энергию взаимодействия полимера с растворителем. Чем больше число сегментов (т.е. больше гибкость), тем выше поправочный коэффициент b. Для веществ с формой, близкой к сферической (гемоглобин в воде) b = 0. Растворы ВМС, как истинные растворы, подчиняющиеся правилу фаз, обнаруживают понижение давления насыщенного пара растворителя над раствором по сравнению с чистым растворителем. Для них характерны отрицательные отклонения от закона Рауля. Изучая термодинамические характеристики растворов полимеров, можно судить об их строении и свойствах. Вязкость растворов ВМС Большое количество исследований размеров и формы ВМС было выполнено методом измерения вязкости растворов. Для характеристики связи между вязкостью системы h и вязкостью дисперсионной среды hо используют величины: относительной вязкости удельной вязкости приведенной вязкости т.е. удельной вязкости, отнесенной к единице концентрации. Приведенная вязкость, экстраполированная к бесконечному разведению, т.е. рассчитанная для условий, исключающих взаимодействие частиц дисперсной фазы между собой, носит название характеристической вязкости дисперсной системы:
Только очень разбавленные растворы ВМС ведут себя как идеально вязкие жидкости – их вязкость подчиняется законам Ньютона и Пуазейля, т.е. не зависит от скорости течения. В более концентрированных растворах полимеров наблюдается ряд аномалий – непостоянство вязкости при изменении скорости течения, непропорциональное возрастание ее с повышением концентрации. Аномалии связаны с несимметричной формой частиц дисперсной фазы. В растворах ВМС асимметричная форма макромолекул усугубляется их повышенной гибкостью и связанной с ней сегментарной формой теплового движения. При высокой степени сольватируемости значительная часть объема растворителя оказывается включенной в сольватные оболочки макромолекул. Поэтому молекулы растворителя теряют подвижность, что также приводит к повышению вязкости. Изучение вязкости разбавленных растворов, тем не менее, может дать косвенную информацию о молярной массе полимеров. Согласно уравнению Эйнштейна, описывающему зависимость вязкости от концентрации, оказалось, что для растворов ВМС коэффициент k этого уравнения зависит от степени полимеризации ВМС. Вязкость растворов ВМС одного полимергомологического ряда с различной относительной молярной массой в одном и том же растворителе различна, т.е. удельная вязкость увеличивается с ростом М. По Э. Штаудингеру, эта зависимость имеет вид: hуд = kMс, (4.3) где с - молярно-массовая концентрация раствора, выраженная в молях мономера цепи на 1 л раствора; k – константа, характерная для длинного гомологического ряда, зависящая от взаимодействия молекул ВМС с растворителем. Более детальное изучение показало, что это уравнение справедливо лишь в узком интервале молярных масс и для сравнительно коротких или более длинных, но достаточно жестких макромолекул. При увеличении длины макромолекулы, ее гибкости и асимметрии эта зависимость hуд от М нарушается. Для учета этих факторов была предложена обобщенная форма уравнения Штаудингера [h] = kMa (4.4) где [h] – характеристическая вязкость раствора, a – величина, учитывающая свертывание макромолекул (гибкости цепи) и имеющая значение от 0,5 для растворов с низкой степенью сольватации, когда форма макромолекул близка к сферической, до ~ 1 для жестких макромолекул, имеющих палочкообразную форму. 4.4. Растворы полимерных электролитов. Среди ВМС важное место занимают белки. Белки являются полимерными электролитами, так как их молекулы содержат ионогенные группы. Поэтому растворы белков имеют целый ряд особенностей по сравнению с растворами других полимеров. В общем виде формула аминокислот, образующих белки, может быть записана как NH2-R-COOH. В водном растворе макромолекула представляет амфотерный ион +NH3-R–COO-. Если числа диссоциированных амино- и карбоксильных групп одинаковы, то молекулы белка в целом электронейтральны. Такое состояние белка называют изоэлектрическим состоянием, а соответствующее ему значение рН раствора – изоэлектрической точкой (ИЭТ). Чаще всего белки – более сильные кислоты, чем основания, и для них ИЭТ лежит при рН<7. При различных рН форма макромолекул различна. В ИЭТ макромолекулы свернуты в клубок вследствие взаимного притяжения разноименных зарядов. В кислой и щелочной средах в макромолекуле преобладают заряды одного знака и молекулы существуют в виде гибких цепочек. Поэтому практически все свойства растворов белков проходят через экстремальные значения в изоэлектрическом состоянии: осмотическое давление и вязкость минимальны в ИЭТ и сильно возрастают в кислой и щелочной средах, минимальна также способность вещества к набуханию, оптическая плотность раствора в ИЭТ максимальна. Изучение всех этих свойств используется для определения изоэлектрической точки белков. 5. Характеристика некоторых |
|
 , (4.1)
, (4.1)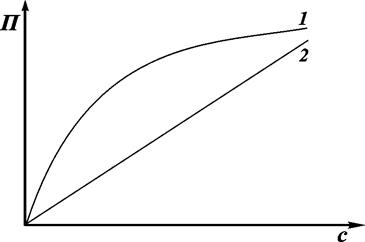
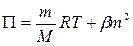 , (4.2)
, (4.2)


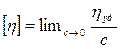 .
.