|
|
Разрушение и обращение эмульсийДля разрушения эмульсий (разбавленных, нестабилизированных эмульгаторами) достаточно внести небольшое количество электролитов для снижения электрокинетического потенциала. Для разрушения стабилизированных эмульсий в них вводят деэмульгатор. В качестве деэмульгатора выступают ПАВ, которые вытесняют с поверхности раздела эмульгатор. Деэмульгатор не имеет четко выраженных полярных и неполярных групп, и поэтому эмульсию не стабилизирует. При встряхивании воды с подсолнечным маслом и гидрофильным стабилизатором – хлоридом натрия – образуется жидко-текучая эмульсия М/В белого цвета. Если использовать гидрофобный стабилизатор – хлорид кальция, то образуется вязкая эмульсия В/М светло-желтого цвета. Если в эмульсию М/В, стабилизированную NaCl, ввести такое количество СaCl2, чтобы значение мольного отношения СaCl2/NaCl превысило 5/1, произойдет обращение эмульсии. Эмульсия М/В превратится в В/М. При более низких соотношениях возможно образование неустойчивой, множественной эмульсии. В небольшом шарике масла при этом размещаются шарики воды. А в свою очередь в каждом из этих шариков воды могут размещаться шарики масла. Пены Пены – это дисперсные системы, в которых дисперсной фазой является газ, а дисперсионной средой – жидкость (жидкая пена) или твердое тело (твердая пена). Объем дисперсной фазы Vг часто значительно превышает объем жидкой фазы Vж. Отношение Vг/Vж может достигать значения 500-1000. В таких пенах газовые пузырьки сильно деформированы и по форме приближаются к криволинейным многогранникам. В пенах, в которых отношение Vг/Vж = 1÷10, газовые пузырьки имеют шарообразную форму. Для стабилизации пен в жидкость вводят ВМС (белки, тамид), которые, адсорбируясь на поверхности раздела газ-жидкость, образуют механически прочные студни. Стабилизируют пены также с помощью ПАВ, молекулы которых имеют полярные и неполярные группы (например, стеарат, пальтат натрия, некоторые красители). Они также образуют на поверхности раздела фаз механически прочные структуры. Стабилизаторы пен получили название пенообразователей. Для стабилизации пен используются также так называемые слабые пенообразователи, которые не образуют на поверхности механически прочных структур, а только понижают поверхностное натяжение и тем самым снижают термодинамическую неустойчивость пен. Пены имеют большое практическое значение (пенная флотация, противопожарные пены, действие моющих средств). Широкое применение получили тведые пены, в которых дисперсионная среда пребывает в твердом состоянии. К твердым пенам относятся пеностекло, пенобетон, пенопласт. В некоторых случаях необходимо, наоборот, исключить образование пены. Тогда применяют специальные вещества - пеногасители. Пеногасители или вступают в реакцию со стабилизаторами и разрушают их, или вытесняют стабилизаторы с поверхности раздела, резко уменьшая устойчивость пен. Суспензии Суспензии представляют собой системы т/ж. Размеры частиц в суспензиях 0,1мкм<r<10мкм. Частицы с меньшей степенью дисперсности обычно быстро оседают. Так же, как и коллоидные растворы, суспензии могут быть получены конденсационным или агрегационным методом. Суспензии рассеивают и поглощают свет, но в отличие от коллоидных растворов они мутны и в проходящем свете. Электрокинетические свойства суспензии подобны коллоидным растворам. Величина дзета-потенциала частиц суспензий приблизительно такая же, как у золей. Введение электролита вызывает коагуляцию частичек суспензии. Суспензии, подобно коллоидным растворам, удается в ряде случаев стабилизировать введением ПАВ или ВМС. Подобно коллоидам, суспензии образуют пространственные структуры. Примеры суспензий в природе: образование осадочных пород, намыв дельт в результате выноса твердых частичек реками и их коагуляции, суспензии глины в керамике и т.д. Аэрозоли Аэрозоли представляют собой дисперсные системы, в которых дисперсная фаза – жидкость или твердое тело, а дисперсионная среда – газ, обычно воздух. В первом случае это туманы, во втором – дым, пыль. Дисперсность аэрозолей значительно меньше дисперсности коллоидных частиц. Однако наряду с частицами, величина которых равна нескольким миллиметрам, могут быть частицы и малых размеров. Размеры частиц табачного дыма составляют 0,1‑1,0 мкм, топливного дыма – 0,1‑100 мкм, тумана (Н2О) – 0,5 мкм. Скорость оседания частиц аэрозоля, определяемая седиментационной формулой, весьма велика в связи с малой вязкостью дисперсионной среды. Аэрозоли, как правило, – агрегативно неустойчивые системы, так как взаимодействие между поверхностями твердых или жидких частиц и газообразной средой практически отсутствует. Частицы аэрозолей могут приобретать электрический заряд, адсорбируя ионы газовой фазы. Однако величина заряда, как правило невелика, чтобы противодействовать их агрегации. В отличие от лиозолей частицы в аэрозолях не имеют диффузного слоя. Аэрозоли рассеивают свет и подчиняются в первом приближении уравнению Рэллея. Аэрозоли органических веществ – угля, сахара, муки, бумаги – взрывоопасны. Вследствие того, что они имеют развитую поверхность, их взаимодействие с кислородом воздуха происходит с большой скоростью, что при значительном тепловом эффекте и приводит к взрыву. 6. Характеристика некоторых Для изучения свойств ВМС и, в частности, биологических макромолекул применяются практически все известные к настоящему времени физико-химические методы. Здесь мы коснемся лишь некоторых спектральных подходов, без которых сегодня не обходится ни одна научно-исследовательская лаборатория. Абсорбционная спектроскопия Молекулы поглощают свет. Длины волн, при которых происходит поглощение, и степень поглощения зависят от структуры и от окружения молекулы, поэтому адсорбционная спектроскопия является полезным инструментом для характеристики макромолекул различного размера. Световая волна состоит из взаимно перпендикулярных электрического и магнитного полей, амплитуды которых по мере распространения в пространстве изменяются по синусоиде. Энергия равна
где h – постоянная Планка; с – скорость света; l – длина волны; n – частота. Когда волна сталкивается с молекулой, она может либо рассеиваться (т.е. изменяется направление ее распространения), либо поглощается. Если произошло поглощение электромагнитной энергии света, о молекуле говорят, что она возбуждена или перешла в возбужденное состояние. Молекула или часть молекулы, которая может быть возбуждена посредством поглощения света в видимой и ближней ультрафиолетовой (УФ) -области, называется хромофором. Поглощение энергии происходит с наибольшей вероятностью только в том случае, если количество поглощенной энергии соответствует разности энергий квантованных состояний. Это можно выразить, констатируя, что свет с длиной волны l поглощается только тогда, когда
где Е1– энергетический уровень молекулы до поглощения; E2 – энергетический уровень, достигаемый в результате поглощения. Изменение энергетического состояния при испускании или поглощении кванта называется переходом. Зависимость вероятности поглощения от длины волны называется спектром поглощения. Если бы все переходы происходили только между самыми низкими колебательными уровнями основного состояния и первого возбужденного состояния, тогда спектр состоял бы из узких, дискретных линий. Однако, поскольку возможны переходы из основного состояния на любой колебательный и вращательный уровни первого возбужденного состояния, а линии имеют конечную ширину, то спектр проявляется в виде относительно плавной кривой. (Далеко не все переходы происходят с высокой вероятностью: в реальных системах действуют определенные ограничения, или правила отбора квантовой механики. Эти правила мы здесь обсуждать не будем.) Для большинства молекул длины волн, соответствующие переходам между основным состоянием и любым колебательным уровнем первого возбужденного состояния, лежат в ультрафиолетовой и видимой области спектра. Возможны также низкие по энергии переходы между колебательными уровнями в пределах одного электронного уровня. Эти переходы происходят в результате поглощения в инфракрасной области. На рис. 6.1 показана часть электромагнитного спектра, представляющая интерес для биологических исследований, и обозначены переходы, которые возникают при поглощении излучения в различных диапазонах частот. Вероятность перехода при одной длине волны характеризуется молярным коэффициентом поглощения при этой длине волны – см. (14.5) – (14.7) В практике биологических исследований для характеристики спектральных свойств объекта наиболее широко используется параметр, называемый оптической плотностью и обозначаемый как D или А. Этот параметр равен
Рис. 6.1. Часть электромагнитного спектра, представляющая В этом случае закон Ламберта – Бера можно записать следующим образом:
где А – оптическая плотность, k – молярный коэффициент поглощения, с – концентрация, d – длина оптического пути (толщина слоя раствора). Оптической плотностью удобно пользоваться, поскольку она отличается прямо пропорциональной зависимостью от концентрации раствора. В некоторых случаях, если с велико, k становится функцией с, и тогда можно сказать, что закон Ламберта-Бера нарушается. Это может быть результатом рассеяния света или структурных изменений (например, димеризации, агрегации или химических изменений) при высоких концентрациях. 6.2. Факторы, влияющие на абсорбционные Спектр поглощения хромофора определяется в первую очередь химической структурой молекулы. Однако Imaxи k претерпевают заметные изменения и под влиянием окружения. Влияние окружения состоит в следующем. Эффект рН. рН раствора определяет ионную форму ионизируемых хромофоров (рис. 6.2).
Рис. 6.2. Спектр поглощения тирозина Эффект полярности. В случае полярных хромофоров часто справедливо (особенно если молекула содержит O, N или S), что lmaxнаблюдается при более коротких длинах волн в полярных растворителях, содержащих гидроксил (Н2О, спирты), чем в неполярных. Эффект ориентации. Величины lmax и k существенно зависят от геометрических особенностей молекулы. Известна гипохромия нуклеиновых кислот, т.е. понижение коэффициента поглощения при условии, что нуклеотид входит в состав одноцепочечного полинуклеотида, в котором нуклеиновые основания сближены и расположены друг над другом.
Рис. 6.3. Спектр поглощения двухцепочечной (1) и одноцепочечной (2) ДНК фага Т7, после гидролиза до свободных нуклеотидов (3) В результате исследований большого числа биологически важных соединений собран ряд эмпирических фактов, которые могут быть названы рабочими правилами абсорбционной спектроскопии биологически важных объектов. Эмпирические правила интерпретации спектров поглощения биологических макромолекул. 1. Если аминокислоты (триптофан, тирозин, феналаламин и гистидин) перемещаются в менее полярное окружение, lмах и k возрастают. Следовательно: а) если спектр аминокислоты, находящейся в составе белка, зарегистрирован в полярном растворителе, и при этом наблюдаются большие lмах и k, чем эти же величины для свободной аминокислоты в том же растворителе, то эта аминокислота находится во внутренней области белка, спрятана и окружена неполярными аминокислотами; б) если спектр белка чувствителен к изменению полярности растворителя, аминокислота, для которой наблюдаются изменения lмах и k, должна располагаться на поверхности белка. 2. В случае аминокислот lмах и k всегда возрастают, когда титруемая группа (например, ОН тирозина и SH цистеина) заряжена. Следовательно: а) если не наблюдается изменений в спектре одной из этих аминокислот, а рН таково, что должна бы происходить ионизация свободной кислоты, то она должна быть спрятана в неполярной области молекулы белка; б) если значение рК ионизируемой группы аминокислоты, определенное по изменению спектра при изменении рН, такое же, как для свободной аминокислоты в растворе, то эта аминокислота находится на поверхности белка; в) если значение рК, определенное по изменению спектра при изменении рН, существенно другое, то эта аминокислота, вероятно, находится в очень полярном окружении (например, тирозин, окруженный карбоксильными группами). 3. Величина k пуринов и пиримидинов понижается по мере того, как плоскости их колец становятся параллельными и кольца сближаются друг с другом (по мере увеличения стэкинга) (рис. 6.3). Величина k понижается в следующем ряду: свободное основание > основание в составе одноцепочечного полинуклеотида, не имеющего стэкинга > основание в составе одноцепочечного полинуклеотида со стэкингом > основание в составе двухцепочечного полинуклеотида. Инфракрасная спектроскопия В результате поглощения света в ИК-области (103-105нм) происходят переходы между колебательными уровнями основного состояния молекулы. Колебательные уровни и, следовательно, ИК-спектры возникают за счет характеристических движений (растягивание связей, изменение величин углов между связями и более сложных типов движения) различных функциональных групп (метильной, карбонильной, амидной и т.д.). Вид колебаний каждой группы очень чувствителен к изменению химической структуры, конформации и окружения. Информация, содержащаяся в инфракрасных спектрах. Необходимо сказать, что в ИК-спектроскопии традиционно используются волновые числа 1/l или частоты u, а не длины волн. В терминах частот каждая полоса в ИК-спектре может быть охарактеризована частотой, максимумом поглощения uмах, шириной полосы на половине высоты Du1/2, оптической плотностью при uмах(Амах) и формой полосы. В случае простых соединений ИК-спектры отличаются от спектров в видимом и УФ-свете тем, что они обычно состоят из довольно узких линий. Однако в случае макромолекул число типов связей велико, много различных конформаций, так что каждая полоса смещается в той или иной степени в зависимости от положения соответствующей группы в молекуле, и, следовательно, полосы перекрываются и в спектре содержатся несколько относительно широких полос. Примеры использования ИК-спектроскопии. ИК-спектроскопия широко применяется для: 1) определения относительного содержания a-спирали, b‑структуры и беспорядочного клубка в белках по интенсивности различных амидных полос; 2) идентификации обменивающихся атомов водорода, поскольку частоты многих полос изменяются при замещении дейтерия на водород. Наблюдая за полосами для различных функциональных групп, можно определить, в каких группах возможен обмен; 3) идентификации таутомерных форм по появлению новых полос; 4) изучения взаимодействия между небольшими молекулами – такими, как рибофлавин и аденин, – и связывания белка с лигандами, что сопровождается изменением частоты и интенсивности полос; 5) титрования карбоксильных групп белка, так как наблюдать за ионизацией карбоксильных групп можно по спектральным изменениям в дейтерированной воде. |
|
 , (6.1)
, (6.1)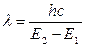 ,
, , где I0 – интенсивность падающего, а I – поглощенного света.
, где I0 – интенсивность падающего, а I – поглощенного света.
 , (6.2)
, (6.2)
