|
|
Схема энергетических уровней атома водорода.На правах рукописи Физика Конспект лекций (Часть 7. Атомная физика. Лазеры)
Для студентов направления 230400 «Информационные системы и технологии»
Электронный образовательный ресурс
Составитель: к.ф.-м.н., доцент В.В. Коноваленко
Рассмотрен и рекомендован для использования в учебном процессе на 2013/2014 – 2015/2016 уч. г. на заседании кафедры ЕНД. Протокол № 1 от 04. 09. 2013 г.
Шахты 2013 Атомная физика Водородоподобный атом. Напомним, что система, состоящая из неподвижного ядра и движущегося вокруг него электрона, называется водородоподобным атомом или водородоподобным ионом.
Подставив в это уравнение оператор Лапласа в сферических координатах, получим:
Решения (35.2), удовлетворяющие стандартным условиям, получаются при любых положительных Е и при дискретных отрицательных значениях:
Положительные значения энергии соответствуют электрону, пролетающему вблизи ядра и удаляющемуся на бесконечность. Такой электрон не связан с ядром, не образует атом (или ион) и интереса не представляет. Электрону, связанному с ядром, соответствуют отрицательные значения энергии (35.3). Необходимо подчеркнуть, что эти значения соответствуют значениям, полученным в теории Бора, но в квантовой механике они являются следствием уравнения Шрёдингера, и дополнительных предположений в виде постулатов не требуется. Собственные функции уравнения Шрёдингера содержат три целочисленных параметра: n, l, m:
n – называется главным квантовым числом и совпадает с номером уровня энергии в (35.3). l и m – азимутальное и магнитное квантовые числа, определяющие модуль и проекцию момента импульса на некоторое направление. Решения, удовлетворяющие стандартным условиям, получаются лишь для значений l, не превышающих
При заданном l магнитное квантовое число m может принимать Энергия электрона электрона в атоме водорода зависит только от n главного квантового числа (см. (35.3)), поэтому каждому уровню энергии соответствует несколько собственных функций, отличающихся значениями l и m. Таким образом, атом водорода может иметь одну и ту же энергию, находясь в состояниях, описываемых различными волновыми функциями. Энергетические состояния в таком случае называются вырожденными, а число различных состояний, соответствующих данной энергии – кратностью вырождения соответствующего энергетического уровня. Кратность вырождения энергетических уровней водорода легко рассчитать. Каждому из n значений числа l соответствует 2l + 1 значение m. Таким образом, кратность вырождения можно рассчитать по формуле:
Напомним, что азимутальное квантовое число определяет значение момента импульса, и состояния электрона в атоме водорода с различными значениями азимутального квантового числа l отличаются величиной момента импульса. Электрон, находящийся в состоянии с l = 0 – называют s-электроном (s состояние); l = 1 – называют p-электроном (p состояние) l = 2– называют d-электроном (d состояние) l = 3 – называют f-электроном (f состояние) и т.д. При обозначении состояния в котором находится электрон, принято значение главного квантового числа n указывать перед условным обозначением квантового числа l. Поэтому электрон с n = 3 при l = 1 обозначают символами 3p. Поскольку l < n возможны следующие состояния: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f и т.д. Как и в теории Бора, в квантовой механике предполагается, что испускание и поглощение света происходит при переходе электрона с одного уровня на другой. Однако фотон обладает собственным моментом импульса равным приблизительно
Очевидно, что это правило есть просто следствие закона сохранения момента импульса. Схема энергетических уровней атома водорода.
Действие правила отбора (35.6) приводит к тому, что не все переходы между энергетическими уровнями действительно могут реализоваться. Например переход из состояния 2s в 1s не может произойти, поскольку противоречит правилу отбора. В связи с этим схему энергетических уровней электрона в атоме водорода можно представлять так, как это показано на рисунке 35.1 Состояние 1s является основным состоянием атома водорода, в котором атом водорода обладает минимальной энергией. Фотон при поглощении его атомом исчезает полностью, передавая атому свою энергию, поскольку является неделимым. Поглощающий атом обычно находится в основном состоянии, поэтому спектр поглощения водородного атома должен состоять из линий, соответствующим переходам 1s-np, что полностью соответствует результатам экспериментов. Электрон в атоме водорода Собственные функции уравнения Шрёдингера для атома водорода распадаются на два множителя, один из которых зависит только от r, а другой от углов J и j.
Множитель Элемент объема dV сферической системе координат можно представить в виде
где dW = Вероятность dP
Взяв интеграл от (35.7) по телесному углу 4p, найдем вероятность
Поскольку Y
Из (35.9) вытекает, что Длинными вертикальными черточками показаны радиусы соответствующих боровских орбит. Рисунок 35.1
Спектры щелочных металлов Эти спектры похожи на спектр испускания атома водорода, но только качественно. Наблюдается несколько серий линий и наиболее интенсивные из них получили названия на основе наблюдаемых экспериментально особенностей: резкая (sharp) – линии этой серии выглядели очень четкими и узкими. главная (principal) – линии этой серии наблюдались и в спектрах поглощения и спектрах испускания, что указывало, что они соответствуют переходу атомав в основное состояние; размытая (diffuse) – линии этой серии выглядели размытыми, нечеткими; основная (fundamental) – линии этой серии напоминали серии линий атома водорода. Установлено, что рассмотренные серии линий связаны с переходами внешнего (валентного) или оптического электрона. Система энергетических уровней, соответствующих испусканию указанных линий для атома натрия имеет вид, приблизительно показанный на рисунке 35.3.
Эти выводы соответствуют результатам квантовомеханических расчетов – решению уравнения Шредингера для электрона, движущегося в центрально-симметричномнекулоновском поле. Поле ядра в атомах щелочных металлов частично экранируется электронами внутренних электронных оболочек атомов. При этом поле сохраняет сферическую симметрию, но от от расстояния до ядра изменяется по закону, отличному от закона Кулона. В таком поле энергия электрона оказывается зависящей от квантового числа: Установлено, что момент импульса атомного остатка щелочных атомов после удаления оптического электрона равен нулю. Следовательно, азимутальное квантовое число L результирующего момента импульса атома совпадает с азимутальным квантовым числом валентного электрона. При возбуждении атома (т.е. при переводе некоторым воздействием из состояния с минимальной энергией в состояние с большей энергией) и при испускании им света изменяется состояние только валентного электрона, поэтому схема уровней атома тождественна схеме уравнения валентного электрона. Термы, отвечающие столбцам уровней, на схеме энергетических уровней можно обозначить символами nS, nP, nD и nF. Тогда частоты спектральных линий, равные разности термов конечного и начального состояний можно представить в следующем виде: резкая главная диффузная основная Ридберг установил, термы щелочных металлов можно представить в виде:
где Эта поправка одинакова для всех термов данного ряда (с данным азимутальным квантовым числом) и обозначается буквой соответствующей ряду. Соответственно для резкой серии можно записать:
Следуя этому правилу частоты линий серий атома натрия можно представить в виде: резкая главная диффузная основная
Ширина спектральных линий До сих пор, говоря о спектральных линиях и энергетических уровнях, мы имели в виду строго определенные конкретные величины. В действительности это не совсем так. Из возбужденного состояния атом может спонтанно перейти в более низкое энергетическое состояние. Время t, за которое число атомов в данном возбужденном состоянии уменьшается в e раз, называется временем жизни возбужденного состояния. По порядку величины эта величина время жизни возбужденного состояния составляет Возможность спонтанных переходов указывает на то, что возбужденные состояния нельзя считать строго стационарными. В силу того, что время и энергия являются канонически сопряженными величинами, соотношение неопределенностей определяет конечную ширину Г энергетических уровней:
Только основное состояние не допускает спонтанных переходов и его энергия имеет строго определенное значение. В соответствии с конечным Г, интервал частот излучаемых фотонов Для видимого света с Тепловое движение атомов приводит к доплеровскому расширению спектральных линий. При этом для излучения с длиной волны
|
|
 Поле, в котором движется электрон, является центрально симметричным. Поэтому при решении уравнения Шрёдингенра в данном случае используют сферическую систему координат:
Поле, в котором движется электрон, является центрально симметричным. Поэтому при решении уравнения Шрёдингенра в данном случае используют сферическую систему координат:  Уравнение Шрёдингенра для электрона в центральном поле ядра с зарядом
Уравнение Шрёдингенра для электрона в центральном поле ядра с зарядом  имеет вид:
имеет вид: (35.1)
(35.1) (35.2)
(35.2) (35.3)
(35.3)
 . Следовательно, при заданном n, азимутальное квантовое число l может иметь значения
. Следовательно, при заданном n, азимутальное квантовое число l может иметь значения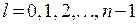 (35.4)
(35.4) различных значений:
различных значений: (35.5)
(35.5)
 Поэтому при испускании или поглощении фотона момент импульса атома должен обязательно измениться на
Поэтому при испускании или поглощении фотона момент импульса атома должен обязательно измениться на  (35.6)
(35.6)
 (35.7)
(35.7) вещественный,
вещественный,  - мнимый. Функция
- мнимый. Функция  -функции вида
-функции вида  зависят только от r.
зависят только от r.
 есть элемент телесного угла.
есть элемент телесного угла. нахождения электрона в элементе dV
нахождения электрона в элементе dV  (35.8)
(35.8) нахождения электрона в тонком шаровом слое радиуса r и толщины dr:.
нахождения электрона в тонком шаровом слое радиуса r и толщины dr:. (35.9)
(35.9) предполагаются нормированными, интеграл в (35.9) равен единице, и
предполагаются нормированными, интеграл в (35.9) равен единице, и (35.10)
(35.10) есть плотность вероятности нахождения электрона на расстоянии r от ядра,
есть плотность вероятности нахождения электрона на расстоянии r от ядра,

 В отличие от атома водорода, энергия состояния оказывается зависящей не только от значения квантового числа n, но и от номера ряда термов. Ряды термов, как и в атоме водорода соответствуют различным значениям азимутального квантового числа l.
В отличие от атома водорода, энергия состояния оказывается зависящей не только от значения квантового числа n, но и от номера ряда термов. Ряды термов, как и в атоме водорода соответствуют различным значениям азимутального квантового числа l. Об этом принято говорить, что снимается вырождение по азимутальному квантовому числа
Об этом принято говорить, что снимается вырождение по азимутальному квантовому числа  . Однако, в основном энергия зависит все же от главного квантового числа n.
. Однако, в основном энергия зависит все же от главного квантового числа n.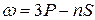 ,
, ,
, ,
, .
. (35.11)
(35.11) - ридберговская поправка (имеется ввиду поправка в сравнении с термами атома водорода).
- ридберговская поправка (имеется ввиду поправка в сравнении с термами атома водорода).











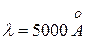 соответствующее
соответствующее  Это так называемая естественная ширина спектральной линии.
Это так называемая естественная ширина спектральной линии. при температуре Т = 1000 К получается значение
при температуре Т = 1000 К получается значение  , которое во много раз превосходит естественную ширину спектральных линий.
, которое во много раз превосходит естественную ширину спектральных линий.