|
|
Электролитическая диссоциация. Слабые и сильные электролитыН.В. СЛУЧЕНКОВА, Т.Е. ИВАНОВА АНАЛИТИЧЕСКАЯ ХИМИЯ Учебно-методическое пособие 2-е издание Смоленск УДК 543 (076.5) ББК 24.4 С49 Рецензенты: Анисимова Т.В., кандидат химических наук, заведующая кафедрой химии ФГОУ ВПО «Смоленский государственный университет», Литвинов Б.В., кандидат сельскохозяйственных наук, доцент кафедры технологии переработки сельскохозяйственной продукции ФГОУ ВПО «Смоленская ГСХА»
Печатается по решению методического совета ФГОУ ВПО «Смоленская ГСХА» (протокол № 5 от 26 декабря 2008 г.)
УДК 543 (076.5) ББК 24.4
© Слученкова Н.В., Иванова Т.Е., 2009 © Федеральное государственное образовательное учреждение высшего профессионального образования «Смоленская государственная сельскохозяйственная академия», 2009 ВВЕДЕНИЕ Аналитическая химия, как наука о принципах и методах определения химического состава вещества и его структуры, включает качественный и количественный анализ. Задачей качественного анализа является обнаружение отдельных компонентов (элементов, ионов, соединений) анализируемого образца и идентификация соединений. Задачей количественного анализа является определение количеств (концентрации или массы) компонентов. Многочисленные и разнообразные методы аналитической химии подразделяют на химические, физические и физико-химические. Химические методы основаны на применении химических реакций, которые называют аналитическими. Физические методы основаны на измерении физических показателей (например, плотности раствора, электропроводности и т.п.). В основе физико-химических методов лежит изучение физических свойств в ходе химической реакции. Выбор метода анализа определяется целью и объектом исследования. Там, где требуется экспрессность, высокая чувствительность (предел обнаружения 10-3 – 10-10%) применяются физические и физико-химические методы. Однако и химические методы, которые часто называют «классическими», имея в виду их «возраст» и отработанность методик, не потеряли своего значения в наши дни. Их применяют при определении больших и средних содержаний определяемого компонента (массовая доля несколько процентов) и когда длительность анализа не имеет существенного значения. Данное учебно-методическое пособие рассматривает теоретические основы химических методов анализа и рассчитано на развитие у студентов активности и самостоятельности при использовании знаний аналитической химии в дальнейшей профессиональной деятельности. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В ГОМОГЕННЫХ СИСТЕМАХ Электролитическая диссоциация. Слабые и сильные электролиты
Реакции в водных растворах, чаще всего применяемые в анализе, представляют собой реакции ионов. Поэтому важно знать, в какой мере различные электролиты распадаются на ионы, т.е. диссоциируют. Отношение числа молей, распавшихся на ионы, к общему числу молей растворенного электролита называется степенью электролитической диссоциации(α):
Степень диссоциации (α) имеет огромное значение для анализа, т.к. она характеризует химическую активность электролита. В зависимости от степени диссоциации все электролиты делятся на три группы: сильные, слабые и средней силы. Склонность слабых электролитов к диссоциации характеризует константа диссоциации. Электролитическая диссоциация, как всякий обратимый процесс, приводит к химическому равновесию между недиссоциированными молекулами и ионами и должна подчиняться закону действующих масс АВ ↔ А+ + В
Отношение произведения равновесных концентраций ионов к равновесной концентрации молекул есть величина постоянная, которую называют константой диссоциации электролита:
Константа диссоциации характеризует силу кислот и оснований и является справочной величиной (Приложение I). Для сильных электролитов в отличие от слабых не используют констант диссоциации. Для оценки способности ионов к химическим взаимодействиям в растворах сильных электролитов используют термин «активность» (а). Это эффективная или условная концентрация иона, соответственно которой он действует при химических реакциях. Влияние электростатических сил на способность иона к химическим взаимодействиям характеризует коэффициент активности. Для слабых электролитов или очень разбавленных растворов сильных электролитов активность ионов равна их концентрации. Для сильных электролитов обычно активность ионов заметно отличается от их концентрации, поэтому при точных расчетах в уравнение закона действующих масс должны входить активности ионов, а не их концентрации. В аналитической практике обычно имеют дело со смесью ионов, концентрации которых заранее не известны, в таких случаях применять коэффициент активности нельзя. Если не требуется особая точность, вместо активностей ионов используют их действительные концентрации, диссоциацию сильных электролитов при этом считают полной.
1.2 Диссоциация воды. Водородный показатель рН. Вычисление концентрации ионов водорода [Н+] и рН в растворах кислот и оснований Реакции, применяемые в аналитической химии, чаще всего протекают в водных растворах. Вода представляет собой слабый электролит, диссоциирующий по уравнению:
Н2О + Н2О ↔ Н3О+ + ОН-
или упрощенно: Н2О ↔ Н+ + ОН-
Поэтому анализируемый раствор всегда наряду с ионами растворенного вещества содержит ионы Н+ и ОН-, с чем необходимо считаться при выполнении анализа. Степень диссоциации воды очень мала. Так, при 250С в 1л воды на ионы распадается 10-7 моль Н2О (это значение было вычислено по электропроводности чистой воды). Следовательно, учитывая схему диссоциации, [H+] = [OH-] = 10-7 моль/л.
По закону действующих масс для диссоциации воды можно записать
Поскольку степень диссоциации воды крайне мала, концентрацию ее недиссоциированных молекул [H2O] можно считать величиной постоянной. Следовательно, произведение [H+]∙[OH-] есть величина также постоянная, которую называют ионным произведением воды:
[H+]∙[OH-] = K
Так как при t = 250C в чистой воде [H+] = [OH-] = 10-7 моль/л, значит,
K
Следовательно, как бы не изменялись концентрации ионов Н+ и ОН-, их произведение во всяком водном растворе сохраняет приблизительно постоянное значение, равное 10-14 при 250С. Среду того или иного раствора принято характеризовать концентрацией ионов водорода Н+. Различают нейтральные, кислые и щелочные растворы. Для щелочных растворов концентрацию ионов водорода Н+ находят по формуле:
На практике среду раствора удобнее характеризовать не концентрацией ионов Н+, а водородным показателем рН:
рН = - lg [H+] (5)
Наряду с водородным показателем нередко применяют и гидроксильный показатель: рОН = - lg [OH-] (6)
Прологарифмировав уравнение ионного произведения воды, получим:
рН + рОН = 14 (7)
На практике часто приходится вычислять рН растворов кислот и оснований, для этого предварительно нужно найти концентрацию ионов в их водных растворах. Вычисление концентрации ионов Н+ в растворах сильных кислот.Сильная одноосновная кислота диссоциирует практически полностью по схеме:
НАn ↔ Н+ + Аn- [H+] = Ск, (8)
где Ск – молярная концентрация кислоты (моль/л). Сильная многоосновная кислота – диссоциация осуществляется по схеме: НnАn ↔ nН+ + Аnn-
[H+] = n∙Cк, (9)
где Ск – молярная концентрация кислоты (моль/л). Вычисление концентрации ионов Н+ в растворах слабых кислот.Слабая одноосновная кислота диссоциирует частично по схеме:
НАn ↔ Н+ + Аn-
Поэтому при расчете концентрации ионов учитывают константу диссоциации:
где Ск – молярная концентрация кислоты (моль/л); Кк – константа диссоциации. Слабая многоосновная кислотадиссоциирует в несколько ступеней, каждая из которых имеет свою константу диссоциации. Учитывают, как правило, только первую ступень диссоциации.
I ступень: Н2Аn ↔ Н+ + НАn-
где Ск – молярная концентрация кислоты (моль/л); Кк – константа диссоциации по первой ступени. Вычисление концентрации гидроксид-ионов в растворах сильных оснований (щелочей).Сильное однокислотное основание диссоциирует по схеме:
МеОН ↔Ме+ + ОН-
[OH-] = C щ, (12)
где Сщ – молярная концентрация щелочи (моль/л). Сильное многокислотное основание: Ме(ОН)n ↔ Меn+ + nOH- [OH-] = n∙Cщ, (13)
где Сщ - молярная концентрация щелочи (моль/л). Вычисление концентрации гидроксид-ионов в растворах слабых оснований.Для слабых оснований, также как и для слабых кислот, учитывают константу диссоциации. Для слабого многокислотного основания учитывается только первая ступень диссоциации:
где Со - концентрация основания (моль/л); Ко – константа диссоциации основания по первой ступени. Вычисление рН в растворах кислот.Водородный показатель находят по формуле: рН = - lg [H+]
Вычисление рН в растворах оснований.Рассчитывают показатель рОН, затем находят рН:
рOН = - lg [OH-],
рН = 14 – рОН
Буферные системы При выполнении анализа иногда необходимо поддерживать в исследуемом растворе определённую концентрацию ионов Н+, которая не должна изменяться при хранении, разбавлении раствора, добавлении к нему небольших количеств сильной кислоты или щелочи. Для этих целей в аналитической практике применяют буферные растворы или буферные системы, представляющие собой смеси электролитов, содержащие одноименные ионы. Различают два типа буферных систем: - смесь слабой кислоты и её соли, например, ацетатный буферный раствор; - смесь слабого основания и его соли, например, аммонийный буферный раствор. Механизм действия ацетатного буферного раствора: Состав: СН3СООН + СН3СООNa Уксусная кислота – слабый электролит, диссоциирует по схеме:
СН3СООН ↔ СН3СОО- + Н+
Причем, равновесие диссоциации смещено в сторону недиссоциированных молекул. Ацетат натрия – сильный электролит, диссоциирует по схеме:
СН3СООNа ↔ СН3СОО- + Na+
Причем, равновесие диссоциации смещено в сторону ионов. При добавлении к ацетатному буферному раствору небольшого количества щелочи (NaOH), появляющиеся ионы ОН- связываются с имеющимися в растворе ионами Н+ с образованием слабого электролита Н2О: ОН- + Н+ ↔ Н2О
Вместо связанных ионов Н+, уксусная кислота, диссоциируя, дает новые. В результате рН раствора изменяется незначительно. При добавлении небольшого количества кислоты (НСI), появляющиеся в растворе ионы Н+ связываются с присутствующими в растворе ацетат-ионами с образованием слабого электролита СН3СООН:
Н+ + СН3СОО- ↔ СН3СООН
В результате рН раствора также почти не изменяется. Механизм действия аммиачного буферного раствора: Состав: NH4OH + NH4CI Гидроксид аммония – слабый электролит, диссоциирующий по схеме:
NH4OH ↔ NH4+ + OH-
Причем, равновесие диссоциации смещено в сторону молекул. Хлорид аммония – сильный электролит, диссоциирующий по схеме:
NH4CI ↔ NH4+ + CI-
Равновесие диссоциации смещено в сторону ионов.
Добавление NaOH: ОН- + NH4+ ↔ NH4OH – слабый электролит В результате Добавление НСI: рН раствора Н+ + ОН- ↔ Н2О – слабый электролит почти не изменяется
Расчет значений рН буферных систем.Буферные смеси, состоящие из слабой кислоты и её соли:
рН = - lg [H+],
где Кк – константа диссоциации кислоты; Ск и Сс – концентрации соответственно кислоты и соли (моль/л). Буферные смеси, состоящие из слабого основания и его соли:
рОН = - lg [OH-],
рН = 14 – рОН,
где Ко – константа диссоциации основания; Со и Сс – концентрации соответственно основания и соли (моль/л).
Гидролиз солей Под гидролизом соли понимают взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Так как при этом ионы соли взаимодействуют с ионами Н+ или ОН- воды, гидролиз солей сопровождается изменением рН раствора. Гидролиз солей многоосновных кислот или многокислотных оснований идет по ступеням. В зависимости от типа соли различают гидролиз по аниону, катиону, по катиону и аниону. Количественно гидролиз характеризуется степенью гидролиза h и константой гидролиза:
Между степенью гидролиза и константой гидролиза существует взаимосвязь:
Гидролизу по аниону подвергаются соли, образованные слабой кислотой и сильным основанием. Например, сульфид натрия Na2S (NaOH – сильное основание, Н2S – слабая кислота).
I.S2- + H2O ↔ HS- + OH- pH > 7 2Na+ + S2- + H2O ↔ 2Na+ + HS- + OH- Na2S + H2O ↔ NaHS + NaOH
II. HS- + Н2О ↔ Н2S + OH- pH > 7 Na+ + HS- + H2O ↔ Na+ + Н2S + OH- NaHS + H2O ↔ Н2S + NaOH
Гидролизу по катиону подвергаются соли, образованные сильной кислотой и слабым основанием. Например, хлорид меди СuCI2 (Cu(OH)2 – слабое основание, HCI – сильная кислота). I. Сu2+ + H2O ↔ CuOH+ + H+ pH < 7 Сu2+ + 2CI- + H2O ↔ CuOH+ + 2CI- + H+ СuCI2 + H2O ↔ CuOHCI + HCI
II. CuOH+ + H2O ↔ Cu(OH)2 + H+ pH < 7 CuOH+ + CI- + H2O ↔ Cu(OH)2 + CI- + H+ CuOHCI + H2O ↔ Cu(OH)2 + HCI
Гидролизу по катиону и аниону подвергаются соли, образованные слабым основанием и слабой кислотой. Например, цианид аммония NH4CN (NH4OH – слабое основание, HCN – слабая кислота) NH4+ + CN- + H2O ↔ NH4OH + HCN pH > 7, т.к. Кк-ты< Косн. NH4CN + H2O ↔ NH4OH + HCN
В аналитической практике гидролиз часто мешает выполнению аналитических реакций, поэтому его приходится подавлять. Так, введение в раствор продуктов гидролиза подавляет гидролиз, связывание же одного из продуктов гидролиза в результате какой-либо реакции, наоборот, усилит гидролиз. Гидролиз также используют в аналитической практике для обнаружения или отделения ионов.
▲ Обучающие задачи Задача №1 Определить рН раствора, концентрация ионов водорода в котором равна 0,0000386 моль/л.
[H+] = 0,0000386 моль/лВыразим концентрацию ионов водорода в виде
степени, состоящей из такого числа отрицательных единиц, сколько нулей предшествует первой значащей цифре, включая нуль целых, т.е в нашем примере [H+] = 3,86·10-5 моль/л. Зная, что логарифм произведения равен сумме логарифмов запишем: рН = - lg [H+] = - (lg 3,86∙10-5) = - (lg 3,86 + lg 10-5) = = - (0,5866 + (-5)) = - (- 4,4134) = 4,41 Значение lg 3,86 определяем по таблице логарифмов (см. Приложение IX, Х). Ответ: рН = 4,41. Задача №2 Определить концентрацию ионов [H+], если рН = 6,32.
рН = 6,32 [H+] = 10 – рН
[H+] - ? Значение 10 0,68 находим по таблице антилогарифмов (см. Приложение X, ХI). Ответ:[H+] = 4,786·10 – 7моль/л.
Задача №3 Вычислить ионную силу 0,05М раствора Na2SO4.
µ - ? Na2SO4 ↔ 2Na+ + SO42- μ = = Ответ:μ = 0,15.
Задача №4 Чему равна ионная сила раствора, содержащего в 1л 0,01 моль КСI и 0,1 моль Ва(NO3)2?
С(КСI) = 0,01 моль/л μ =
µ - ? μ = = = Ответ: μ = 0,31. Задача №5 Вычислить концентрацию ионов Н+ в 0,1М растворе Н2S (без учета второй ступени диссоциации кислоты).
С(Н2S) = 0,1М Н2S ↔ H+ + HS- (слабая кислота)
[H+] - ? Кк = [H+] = Ответ:[H+] = 2,98∙10-3 моль/л.
Задача №6 Вычислить концентрацию ионов Н+ и степень диссоциации уксусной кислоты, если известно, что в 1л её раствора содержится 2,5608г уксусной кислоты.(
m (CH3COOH) = 2,5608г СН3СООН – слабая кислота V = 1л = 1000мл [H+] =
[H+] - ? См α - ? [H+] = = М(СН3СООН) = 60г/моль
Ответ:[H+] = 8,94∙10-4 моль/л, α = 2,08%. Задача №7 Вычислить концентрацию ионов Н+ в 0,05М растворе соляной кислоты.
[H+] - ? [H+] = Cк = 0,05 = 5 · 10-2 моль/л Ответ:[H+] = 5 ∙ 10-2 моль/л. Задача №8 Вычислить рН 0,01М раствора Н2SO4.
рН - ? [H+] = 2∙Ск=2 ∙0,01=2∙10-2 рН = - lg [H+] = - lg 2∙10-2 = - (lg 2 + lg 10-2) = = - (0,3010 – 2) = 1,699 ≈ 1,7 Ответ:рН = 1,7.
Задача №9 Вычислить рН 0,1М раствора КОН.
рН - ? [OH-] = Cщ = 0,1 = 10-1 моль/л рОН = - lg [OH-] = - lg 10-1 = 1 pH = 14 – pOH = 14 – 1 = 13 Можно при решении этой задачи пойти другим путем: рН = - lg [H+] [H+] = [H+] = рН = - lg [H+] = - lg 10-13 = 13 Ответ:рН = 13.
Задача №10 Вычислить концентрацию гидроксид-ионов и рОН в 0,01М растворе гидроксида аммония.
[OH-] - ? [OH-] = рОН - ? Ко = [OH-] = рОН = -lg [OH-] = -lg 4,23 ·10-2 = -(lg 4,23 + lg 10-2) = = - (0,6263 – 2) = 1,37 Ответ:[OH-] = 4,23∙10-2 моль/л, рОН = 1,37. Задача №11 Вычислить рН раствора, содержащего 0,01М СН3СООН и 0,05М СН3СООNa.
С(СН3СООН)=0,01моль/л Данный раствор представляет собой
кислоту и её соль. рН - ? [H+] = рН = - lg [H+] Kк = [H+] = 1,86∙10-5 ∙ рН = - lg [H+] = - lg 3,72∙10-6 = - (lg 3,72 + + lg 10-6) = - (0,5705 – 6) = 5,43 Ответ:рН = 5,43.
Задача №12 Вычислить рН раствора, содержащего в 1л 0,056 моль NH4OH и 0,1 моль NH4CI.
С(NH4OH)=0,056 моль/л Данный раствор представляет собой С(NH4CI)=0,1 моль/л буферную смесь, содержащую слабое
рН - ? [OH-] = рОН = - lg [OH-], pH = 14 – pOH Ko = [OH-] = 1,79∙10-5 ∙ рН = 14 – рОН = 14 – 5 = 9 Ответ:рН = 9.
Задача №13 Вычислить константу гидролиза сульфита натрия по I ступени. Решение: Na2SO3 – соль образована сильным основанием и слабой кислотой, следовательно, гидролизуется по аниону.
Кг =
I. SO32- + H2O ↔ HSO3- + OH-
Кг =
Кг =
Ответ:Кг = 1,7∙10-7.
Задача №14 Вычислить константу гидролиза нитрита аммония.
Решение: NH4NO2 – соль образована слабым основанием и слабой кислотой, следовательно, гидролизуется по катиону и аниону.
Кг =
NH4+ + NO2- + H2O ↔ NH4OH + HNO2
Ответ:Кг = 1,4∙10-6. ▼ Задачи для самостоятельного решения 1. Вычислить ионную силу: а) 0,03М раствора ВаСI2; б) 0,01М раствора НСI; в) 0,02М раствора К2SO4. Ответ: а) 0,09; б) 0,01; в) 0,06. 2. Чему равна ионная сила раствора, содержащего в 1л: а) 0,1 моль НСI и 0,2 моль СаСI2; б) 0,02 моль NaCI и 0,1 моль Ca(NO3)2. Ответ: а) 0,7; б) 0,32. 3. Вычислить концентрацию ионов Н+ в 0,01М растворе угольной кислоты (без учета второй ступени диссоциации кислоты). Ответ: 6,57∙10-5 моль/л. 4. Вычислить концентрацию ионов Н+ в 0,025М растворе Н2S (без учета второй ступени диссоциации). Ответ: 4,7∙10-5 моль/л. 5. Вычислить концентрацию ионов Н+ и степень диссоциации уксусной кислоты, если известно, что в 300 мл её раствора содержится 0,8508г СН3СООН. Ответ: [H+] = 9,35 10-4 моль/л; α = 1,99%. 6. Вычислить концентрацию гидроксид-ионов в растворах: а) 0,05М NaOH; б) 0,025М NH4OH. Ответ: а) 5∙10-2 моль/л; б) 6,69∙10-4 моль/л. 7. Вычислить концентрацию ионов Н+ в растворах: а) 0,05М Н2SO4; б) 0,03М Ba(OH)2. Ответ: а) 10-1 моль/л; б) 1,77 10-13 моль/л. 8. Вычислить рН: а) 0,005М раствора НСI; б) 0,015М раствора КОН; в) 0,01М раствора СН3СООН; г) 0,001М раствора NH4OH. Ответ: а) 2,3; б) 12,18; в) 3,37; г) 10,13. 9. Вычислить рН раствора, содержащего в 1л: а) 0,06 моль уксусной кислоты и 0,02 моль ацетата натрия; б) 0,045 моль гидроксида аммония и 0,15 моль хлорида аммония; в) 0,01 моль бензойной кислоты и 0,02 моль бензоата натрия; г) 0,025 моль муравьиной кислоты и 0,015моль формиата натрия. Ответ: а) 4,25; б) 8,73; в) 4,49; г) 3,53. 10. Вычислить рН буферных смесей, содержащих: а) 0,01М СН3СООН и 0,01М СН3СООNa; б) 0,5М СН3СООН и 0,01М СН3СООNa; в) 0,1М НСООН и 0,05М НСООNa; г) 0,01М NH4OH и 0,05М NH4CI; д) 0,05М NH4OH и 0,025М NH4CI. Ответ: а) 4,73; б) 3,03; в) 3,45; г) 8,55; д) 9,55 11. Вычислить константу гидролиза следующих солей: а) хлорида аммония; б) ацетата аммония; в) ацетата калия; г) карбоната калия по I ступени; д) нитрита натрия. Ответ: а) 5,6∙10-10; б) 3∙10-5; в) 5,4∙10-10; г) 1,8∙10-4; д) 2,5∙10-11.
? Контрольные вопросы 1. Буферные растворы. Буферное действие растворов. Механизм действия ацетатного и аммонийного буферных растворов. 2. Приведите примеры слабых кислот (не менее 2-х) и слабых оснований (не менее 2-х). Напишите для них уравнения диссоциации, выражения констант диссоциации. Приведите формулу зависимости между константой диссоциации и степенью диссоциации. 3. Гидролиз. Определите тип гидролиза следующих солей ZnSO4, Na2CO3, NH4CN. Напишите уравнения гидролиза данных солей в ионном и молекулярном виде. 4. Значение гидролиза в аналитической практике. Как сказывается на гидролизе сульфида аммония добавление к раствору гидроксида аммония (напишите уравнение гидролиза и объясните). |
|
 (1)
(1) (2)
(2) или [H+]∙[OH-] = K∙[H2O]
или [H+]∙[OH-] = K∙[H2O] (3)
(3) (4)
(4) , (10)
, (10) , (14)
, (14)
 , (15)
, (15) , (16)
, (16) , (17)
, (17) (18)
(18) (19)
(19)




 Дано: Решение:
Дано: Решение: рН - ? произведения целого числа единиц на десять в
рН - ? произведения целого числа единиц на десять в Дано: Решение:
Дано: Решение: [H+] = 10 – 6,32 = 10 – 7 · 10 0,68 = 4,786·10 – 7моль/л
[H+] = 10 – 6,32 = 10 – 7 · 10 0,68 = 4,786·10 – 7моль/л Дано: Решение:
Дано: Решение: С(Na2SO4) = 0,05М μ =
С(Na2SO4) = 0,05М μ = 
 (2[Na+] ∙ 12 + [SO42-] · 22) =
(2[Na+] ∙ 12 + [SO42-] · 22) = Дано: Решение:
Дано: Решение:
 С(Ва(NO3)2) = 0,1 моль/л КСI ↔ K+ + CI- Ва(NO3)2↔ Ba2+ + 2NO3-
С(Ва(NO3)2) = 0,1 моль/л КСI ↔ K+ + CI- Ва(NO3)2↔ Ba2+ + 2NO3- Дано: Решение:
Дано: Решение: [H+] =
[H+] = 
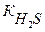 = 8,9∙10-5 моль/л (См. Приложение I)
= 8,9∙10-5 моль/л (См. Приложение I)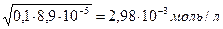
 ).
). Дано: Решение:
Дано: Решение:
 См
См 

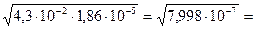
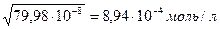
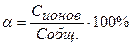

 Дано: Решение:
Дано: Решение: С(НСI) = 0,05М НСI ↔ Н+ + СI- (сильная кислота)
С(НСI) = 0,05М НСI ↔ Н+ + СI- (сильная кислота) Дано: Решение:
Дано: Решение: С(Н2SO4) = 0,01М Н2SO4 ↔ 2Н+ + SO42- (сильная двухосновная кислота)
С(Н2SO4) = 0,01М Н2SO4 ↔ 2Н+ + SO42- (сильная двухосновная кислота) Дано: Решение:
Дано: Решение: С(КОН) = 0,1М КОН ↔ К+ + ОН- (сильное основание)
С(КОН) = 0,1М КОН ↔ К+ + ОН- (сильное основание) ; [OH-] = Cщ = 0,1 = 10-1 моль/л
; [OH-] = Cщ = 0,1 = 10-1 моль/л
 Дано: Решение:
Дано: Решение: С(NH4OH) = 0,01М NH4OH ↔ NH4+ + OH- (слабое основание)
С(NH4OH) = 0,01М NH4OH ↔ NH4+ + OH- (слабое основание)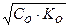
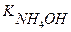 = 1,79 ∙ 10-5 (См. Приложение I)
= 1,79 ∙ 10-5 (См. Приложение I)
 Дано: Решение:
Дано: Решение: С(СН3СООNa) = 0,05моль/л буферную смесь, т.к. содержит слабую
С(СН3СООNa) = 0,05моль/л буферную смесь, т.к. содержит слабую
 = 1,86∙10-5 (См. Приложение I)
= 1,86∙10-5 (См. Приложение I) = 3,72∙10-6 моль/л
= 3,72∙10-6 моль/л Дано: Решение:
Дано: Решение: основание и его соль.
основание и его соль.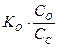
 = 1,0024∙10-5 ≈ 10-5 моль/л рОН = - lg [OH-] = - lg 10-5 = 5
= 1,0024∙10-5 ≈ 10-5 моль/л рОН = - lg [OH-] = - lg 10-5 = 5
 ,
, = 6∙10-8 (См. Приложение I)
= 6∙10-8 (См. Приложение I)


 (См. Приложение I)
(См. Приложение I)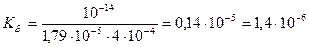
 .
.