|
|
Основные принципы качественного анализаЗадачей качественного анализа является обнаружение («открытие») отдельных элементов или ионов, входящих в состав исследуемого вещества. Качественный анализ обычно предшествует количественному, так как только зная, какие другие элементы или ионы присутствуют в анализируемом веществе, можно выбрать наиболее подходящий метод количественного анализа данной составной части. В то же время, качественный анализ может дать представление и о количественном содержании того или иного компонента в анализируемом объекте: много этого компонента, мало или только «следы». В зависимости от агрегатного состояния исследуемого вещества качественные аналитические реакции выполняют «сухим» и «мокрым» способами. Важную роль играют условия выполнения реакций, одним из которых является достаточно большая концентрация обнаруживаемого иона в растворе. В качественном анализе применяют только те реакции, обнаруживаемый минимум, которых не превышает 50 мкг (10-6 г). Обнаружению того или иного иона может мешать присутствие посторонних ионов в растворе. Для устранения их влияния применяют так называемые маскирующие средства. Большое значение для анализа имеет специфичность реакций. Однако, таких реакций не так много. Поэтому чаще приходится иметь дело с селективными(избирательными) реакциями. В качественном анализе применяют два метода: дробныйи систематический, которые взаимно дополняют друг друга и имеют каждый свою область применения. При систематическом ходе анализа ионы выделяют из сложной смеси целыми группами, пользуясь их одинаковым отношением к действию так называемых групповых реагентов. Существует аналитическая классификация ионов, в основу которой положены отличия в растворимости образуемых ими соединений, позволяющие отделить одни группы ионов от других. Так, выделяют пять аналитических групп катионов, различающихся между собой по растворимости образуемых ими карбонатов, сульфидов, хлоридов и гидроксидов, что функционально связано с электронными структурами ионов и положением соответствующих элементов в периодической системе Д.И. Менделеева. Анионы чаще всего подразделяют на три аналитические группы, в основе такой классификации лежит различная растворимость солей бария и серебра соответствующих кислот. В зависимости от количества анализируемого вещества, объема раствора и техники выполнения операций различают макро-, микро-, полумикро- и ультрамикрометоды. Наиболее удобен полумикроанализ, так как позволяет уменьшить расход реактивов, ускорить выполнение исследования, избежать загрязнения воздуха лаборатории вредными веществами и при достаточно тщательной работе дает вполне надежные результаты.
Лабораторное оборудование, применяемое в полумикроанализе Капельницы с реактивами служат для хранения реактивов. Необходимо тщательно следить за тем, чтобы реактивы не загрязнялись во время работы. Во избежание этого нельзя прикасаться кончикомпипетки к стенке пробирки,в которую приливают данный реактив, или предметному стеклу, на которое его наносят. Если это произошло, необходимо тщательно обмыть пипетку дистиллированной водой, прежде чем поместить ее обратно в капельницу. Нельзя также класть пипетку на стол, она может находиться только в соответствующей капельнице или в руках работающего. Капельницы с реактивами располагаются на полках специального штатива в строго определенном порядке. Пробирки вместимостью 3-4 мл применяются для выполнения аналитических реакций. Для микрокристаллоскопических и капельных реакций применяют предметные стекла. Для перемешивания растворов используют стеклянные палочки. Для нагревания растворов применяют водяную баню. Особое внимание уделяют чистоте посуды, так как часто присутствие даже незначительных количеств загрязнений искажает результат реакции. Пробирки, предметные стекла, ст еклянные палочки перед работой тщательно моются водопроводной водой, затем ополаскиваются дистиллированной водой. Это же следует повторить и после выполнения анализа.
? Контрольные вопросы 1. Аналитические реакции. Требования, предъявляемые к ним. Обнаруживаемый минимум. 2. Специфические и селективные реакции (дать определение, привести примеры). 3. Дробный и систематический анализ. 4. Что такое маскировка ионов? 5. Открытие катионов NH4+, Ca2+, K+. Указать внешний эффект реакций. Какие из перечисленных качественных реакций выполняются капельным и микрокристаллоскопическими способами? Для ионов NH4+ и Ca2+ написать уравнения качественных реакций в ионном и молекулярном виде (см. ЛР №1 – часть А). 6. Открытие анионов SO42-, PO43-, NO3-. Указать внешний эффект реакций. Для аниона SO42- написать уравнение качественной реакции в ионном и молекулярном виде (см. ЛР №1 – часть А). 7. Что такое групповой реагент? 8. На чем основана аналитическая классификация катионов? Сколько групп катионов выделяют? Приведите примеры катионов I, II и III аналитических групп. 9. На чем основана аналитическая классификация анионов? Приведите примеры анионов различных аналитических групп. 10. В чем различие между макро-, микро- и полумикроанализом? Какой из перечисленных методов использовался Вами в лабораторной практике? В чем его преимущество? 11. Перечислите операции, применяемые в полумикроанализе? 12. Сущность «сухого» и «мокрого» способов выполнения аналитических реакций. 13. Основные принципы качественного анализа. Области применения. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ Задачей количественного анализа является определение количественного содержания элементов, ионов или химических соединений, входящих в состав анализируемых веществ или материалов. Для этого определяют интенсивность аналитического сигнала, т.е. находят численное значение массы прокаленного осадка, объем раствора титранта и т.п. По результатам количественного измерения аналитического сигнала рассчитывают содержание определяемого компонента в исследуемой пробе (обычно в массовых долях, %). Среди химических методов количественного анализа выделяют гравиметрический, титриметрический, газоволюметрический анализы.
Гравиметрический анализ Сущность гравиметрического анализа. Операции, применяемые в гравиметрическом анализе.Гравиметрия представляет собой старый «классический», но достаточно точный метод, в основе которого лежит измерение массы вещества. Сущность гравиметрического анализа заключается в том, что навеску исследуемого материала переводят в раствор, определяемый компонент осаждают в виде малорастворимого соединения, полученный осадок отфильтровывают, промывают от примесей, высушивают, прокаливают и взвешивают. Зная массу осадка, рассчитывают массовую долю (%) определяемого компонента в исследуемом веществе. Перечисленные операции относятся к методу осаждения, наиболее часто используемому в гравиметрии. Наряду с ним используют также метод выделения и метод отгонки. Одним из важных этапов гравиметрического анализа является отбор средней пробы, так как даже самый тщательный анализ неправильно взятой пробы не даст верных результатов. В результате отбора средней пробы получают однородный материал, из которого затем берут навески для анализа. Выбор величины навески анализируемого вещества определяется массой осадка, наиболее удобной в работе. При определениях, не связанных с получением осадка, например, при изучении влажности зерна и других объектов допустимы навески в 1,0 – 2,0 грамма и более. Так как техника взвешивания на аналитических весах длительна, вначале берут приблизительную навеску исследуемого вещества на технохимических весах, а затем точно взвешивают на аналитических весах. При работе с весами следует помнить, что результаты взвешивания будут верными только тогда, когда взвешиваемый предмет имеет температуру весов. Чтобы взвешиваемый предмет (тигель, бюкс) принял температуру весов, его помещают не менее чем на 15–20 минут в специальный прибор эксикатор, предназначенный для охлаждения бюксов и тиглей, а также для хранения гигроскопичных веществ. Работа на аналитических весах требует аккуратности и внимательности, так как весы быстро портятся и не дают достаточно точных результатов. Правила работы с аналитическими весами ВЛР-200: 1. Работа на аналитических весах не допускает резких движений, приводящих к их быстрому изнашиванию. 2. Во время взвешивания не облокачивайтесь на стол, на котором установлены весы. 3. Перед взвешиванием проверьте на весах нулевые отметки. 4. Плавно включите весы и проверьте на экране нулевую точку, при необходимости корректируйте «0» ручкой сверху слева (№1). 5. Поместите взвешиваемый предмет, например, бюкс на левую чашку весов, на правую чашку поместите гирьки, соответствующие целому числу граммов массы бюкса. Верхней ручкой справа (№2) устанавливают первый знак после запятой в значении массы бюкса. (Например, масса бюкса на технохимических весах 8,53г, значит, на чашку весов помещают гирьки, соответствующие 8г, ручкой №2 выставляют в окошке цифру 5). После этого плавно включают весы. На экране должно появиться изображение шкалы. Если его нет, следует орретировать весы (выключить) и в зависимости от появившихся на экране «+» или «–» добавить или убавить соответственно одну десятую грамма верхней ручкой справа (№2). При появлении на экране изображения шкалы устанавливают с помощью ручки №3 (вверху справа) точный вес бюкса. 6. Записывают результаты взвешивания. 7. Весы выключают, снимают бюкс и гирьки и выводят механизмы весов на нулевые отметки. Важной операцией гравиметрического анализа считается осаждение. При её выполнении следует правильно выбрать осадитель, рассчитать его объем, соблюсти условия осаждения и убедиться в полноте осаждения иона из раствора. В качестве осаждаемой формы (формы осаждения) в гравиметрическом анализе можно использовать далеко не каждый осадок. Форма осаждения должна удовлетворять следующим требованиям: 1) осадок должен быть малорастворимым, то есть осаждение должно быть достаточно полным; 2) полученный осадок должен быть чистым и легко отфильтровываться, а также отмываться от примесей; 3) осаждаемая форма при прокаливании должна легко превращаться в гравиметрическую форму. Ни один из осадков в полной мере этим требованиям не удовлетворяет. Поэтому, основываясь на теоретических представлениях о свойствах растворов и осадков и опираясь на практический опыт аналитической химии, следует создать такие условия осаждения, при которых требования, предъявляемые к осаждаемой форме, будут удовлетворены в максимально возможной степени. Важное влияние на полноту осаждения и свойства осадка оказывают следующие условия: 1) количество осадителя; 2) температура; 3) концентрация посторонних солей. Для отделения полученного осадка от раствора применяют фильтрование. Одним из основных источников погрешностей в гравиметрическом анализе является соосаждение – увлечение осадком посторонних веществ из раствора. Различают четыре основных вида соосаждения: - окклюзия; - изоморфное соосаждение; - соосаждение с образованием химических соединений; - соосаждение в результате адсорбции примесей осадком. Загрязнение осадка посторонними примесями приводит к тому, что состав осадка (гравиметрической формы) невозможно представить в виде какой либо определенной химической формулы, а следовательно, точное вычисление содержания того или иного элемента в осадке становится невозможным. Уменьшить соосаждение можно в результате: - рационального выбора хода анализа; - рационального выбора осадителя; - создания соответствующих условий осаждения (проводить осаждение в условиях, при которых образуются крупнокристаллические осадки); - применения настаивания (выдерживание кристаллического осадка под маточным раствором в течение определенного времени); - замены одних ионов другими либо связывания соосаждаемых ионов в какой либо достаточно прочный и менее соосаждающийся комплекс. Наиболее радикальным средством борьбы с загрязнением осадка является переосаждение (повторное осаждение). Для этого осадок отфильтровывают, промывают на фильтре, растворяют в кислоте и снова осаждают. Содержание примесей в полученном осадке резко снижается. Промывание осадка осуществляют с целью удаления примесей, адсорбированных им из раствора. Чтобы исключить потери осаждаемого вещества, выбор промывной жидкости осуществляют, исходя из свойств промываемого осадка. Только в редких случаях в качестве промывной жидкости используют дистиллированную воду. Обычно используют разбавленный раствор осадителя или раствор электролита-коагулятора. На заключительной стадии гравиметрического анализа осадок (осаждаемую форму) высушивают или прокаливают, в результате получают гравиметрическую форму – соединение, пригодное для взвешивания. В зависимости от физико-химических свойств осадка при прокаливании он остается неизменным, как, например, сульфат бария, или претерпевает химические превращения. Последнее характерно для осадков гидроксида алюминия, гидроксида железа (III), оксалата кальция и др.
2 Fe(OH)3 → Fe2O3 + 3H2O осаждаемая гравиметрическая форма форма
2 Al(OH)3 → Al2O3 + 3H2O осаждаемая гравиметрическая форма форма
Еще более сложные превращения могут происходить с осадком оксалата кальция:
СаС2О4∙2Н2О → СаС2О4 + Н2О (2000С)
СаС2О4 → СаСО3 + СО (475-5250С)
СаСО3 → СаО + СО2 (900-10000С)
Таким образом, в зависимости от температуры прокаливания можно получить: а) карбонат кальция СаСО3; б) оксид кальция СаО; в) смесь СаСО3 + СаО. Если в результате прокаливания получится смесь карбоната кальция и оксида кальция с неизвестным соотношением компонентов, то рассчитать результат анализа по массе осадка будет невозможно. Чтобы по массе осадка можно было рассчитать содержание определяемого компонента в анализируемой пробе, состав гравиметрической формы должен точно соответствовать определенной химической формуле. Это главное требование к гравиметрической форме. Кроме того, гравиметрическая форма должна обладать определенной химической устойчивостью при достаточно широком интервале температур (она должна получаться при 400-5000С и не изменяться при 700-8000 до 10000С), быть устойчивой на воздухе при обычной температуре (не поглощать влагу и не взаимодействовать с другими компонентами воздуха). Для точности определения (чтобы погрешности взвешивания менее сказывались на результатах анализа) важно, чтобы у гравиметрической формы была большая молярная масса и содержание определяемого элемента в ней было как можно меньше. Для вычислений результатов в гравиметрическом анализе нередко применяют фактор пересчета Ф (аналитический фактор), представляющий собой отношение молярной массы определяемого вещества к молярной массе вещества, находящегося в осадке:
Используя фактор пересчета, можно рассчитать массовую долю (%) элемента (или другой составной части вещества) по готовой формуле:
▲ Обучающие задачи Задача №1 Какую навеску карбоната кальция следует взять для определения в нем содержания кальция в виде оксида кальция, считая норму осадка 0,5г?
m (СаО) = 0,5г 1) Найдем количество вещества СаО:
m(СаСО3) - ? 2) Найдем количество вещества СаСО3: n (CaCO3) = n (CaO) = 0,0089 моль 3) Найдем величину навески СаСО3: m (СаСО3) = n (СаСО3) · М (СаСО3) = = 0,0089 · 100 = 0,89 ≈ 0,9г Ответ:m (СаСО3) = 0,9г.
Задача №2 Какой объем 0,25М раствора (NH4)2C2O4 потребуется для осаждения иона Са2+ из раствора, полученного растворением 0,6г СаСО3 в соляной кислоте? Перед решением такой задачи сделаем следующие пояснения. Необходимый объем осадителя рассчитывают: 1) учитывая содержание осаждаемого иона в растворе, а, следовательно, величину навески анализируемого вещества; 2) исходя из того факта, что абсолютно нерастворимых веществ нет, поэтому, чтобы добиться полного осаждения иона необходимо взять полуторный избыток осадителя.
С((NH4)2C2O4) = 0,25 моль/л СаСО3 + 2НСI = СаСI2 +Н2О+СО2↑ (1) m (СаСО3) = 0,6г СаСI2+(NH4)2C2O4=СаС2О4 ↓+2NH4CI (2)
n ((NH4)2C2O4) = n (СаСО3) n (СаСО3) = n ((NH4)2C2O4) = 0,006 моль По условию в 1000 мл раствора (NH4)2C2O4 содержится 0,25 моль вещества, составим пропорцию: 0,25 моль – 1000 мл раствора 0,006 моль – х мл раствора х = С учетом полуторного избытка: V = 24 ∙ 1,5 = 36 мл Ответ: V ((NH4)2C2O4) = 36 мл. Задача №3 Рассчитать объем 2% раствора NH4OH (ρ= 0,988 г/мл) для осаждения иона АI3+ из навески хлорида алюминия массой 0,3г. Дано: Решение:
С(NH4OH) = 2% По уравнению реакции ρ(NH4OH) = 0,988 г/мл n (NH4OH) = 3n (AICI3)
n (NH4OH) = 3 · 0,0023 = 0,0069 моль Переведем % концентрацию раствора NH4OH в молярную:
0,57 моль – 1000мл раствора 0,0069 моль – х мл раствора х = С учетом полуторного избытка: V (NH4OH) = 12,1 ∙ 1,5 = 18,2 мл Ответ:V (NH4OH) = 18,2 мл. Задача №4 Вычислить фактор пересчета при определении кальция в виде оксида кальция. Решение:
Ответ: 0,7143. Задача №5 Вычислить фактор пересчета при определении сульфата магния, если гравиметрическая форма Мg2P2O7.
Решение:
Ответ: 1,0811. Задача №6 Для определения общего Р2О5 в двойном суперфосфате Са(Н2РО4)2 взяли навеску 2,4835г. Фосфат-ион осадили в виде МgNH4PO4, который при прокаливании превратился в Мg2P2O7, масса которого составила 1,6337г. Найти массовую долю (%) Р2О5 в двойном суперфосфате.
m (Мg2P2O7) = 1,6337г
ω (Р2О5) - ?
Ответ:ω (Р2О5) = 42,07%. ▼ Задачи для самостоятельного решения 1. Какую навеску сульфата железа FeSO4·7H2O следует взять для определения в нем железа в виде Fe2O3, считая норму осадка равной 0,2г? Ответ: ~ 0,7г. 2. Какую навеску хлорида калия следует взять для определения хлорид-иона в виде АgCI, считая норму осадка ~ 0,3г? Ответ: 0,16г. 3. Какой объем 0,5н раствора (NH4)2C2O4 потребуется для осаждения иона Са2+ из раствора, полученного растворением 0,7г СаСО3? Ответ: 42 мл. 4. Какой объем 0,1М раствора НСI потребуется для осаждения серебра из навески АgNO3 массой 0,6г? Ответ: 53 мл. 5. Какой объем 1н раствора ВаСI2 потребуется для осаждения иона SO42-, если растворено 2г медного купороса СuSO4∙5H2O с массовой долей примесей 5%? Ответ: 23 мл. 6. Какой объем 10% раствора NH4OH (ρ = 0,958 г/мл) потребуется для полного осаждения иона Fe3+ из навески FeCI3 массой 0,5г? Ответ: 5,1мл. 7. Какой объем 1М раствора серной кислоты потребуется для полного осаждения иона Ва2+ из навески ВаСI2∙2Н2О массой 0,4526г? Ответ: 2,85мл. 8. Для определения магния в известняке была взята навеска 1,2456г. После отделения SiO2, Fe, AI и Ca был осажден магний в виде MgNH4PO4, который при прокаливании превратился в Mg2P2O7, масса которого составила 0,0551г. Найти массовую долю (%) магния в известняке. Ответ: 0,96%. 9. Для определения кальция в СаСО3 навеску массой 0,4116г растворили в соляной кислоте и осадили Са2+ действием (NH4)2C2O4. Выпавший осадок отфильтровали, промыли, прокалили и взвесили. Зная, что при прокаливании осадок превратился в СаО и что масса последнего составила 0,2302г, вычислить массовую долю (%) кальция в СаСО3. Написать уравнения всех реакций. Ответ: 39,95%. 10. После соответствующей обработки 0,9г КАI(SO4)2 получено 0,0967г АI2О3. Найти массовую долю (%) алюминия в исследуемом веществе. Ответ: 5,69%. 11. Для определения лития навеску силикатной породы массой 0,9542г обработали смесью кислот НF и НCI. После извлечения хлорида лития ацетоном раствор выпарили, остаток прокалили и превратили в Li2SO4, масса его составила 0,3416г. Найти массовую долю (%) Li в силикатной породе. Ответ: 4,56%. 12. Вычислите фактор пересчета при определении: а) бария в виде BaSO4; б) алюминия в виде AI2O3; в) оксида натрия в виде NaCI; в) хрома в виде Cr2O3. Ответ: а) 0,58798; б) 0,5294; в) 0,5299; в) 0,6842. 13. Вычислить фактор пересчета:
Ответ: а) 1,8457; б) 0,9000; в) 0,8829; г) 0,8084; д) 0,3604; е) 0,4483.
? Контрольные вопросы 1. Области применения гравиметрического анализа, его преимущества и недостатки. 2. Приведите последовательность операций в гравиметрическом анализе. 3. Какому принципу подчиняется отбор средней пробы? В чем заключается прием квартования? 4. Требования к величинам навески. Каковы рекомендуемые величины навески для кристаллических и аморфных веществ? Чем они определяются? 5. Осаждение. Выбор осадителя. Требования к осадителю. Объем осадителя. 6. Чем следует осаждать ионы Са2+ - раствором Na2C2O4 или (NH4)2C2O4? Почему ионы Ва2+ осаждают серной кислотой, а не раствором Na2SO4? 7. Кратко охарактеризуйте условия осаждения кристаллических и аморфных веществ. 8. Что такое осаждаемая и гравиметрическая формы (приведите примеры). Требования к осаждаемой и гравиметрической формам. 9. Соосаждение (определение). Перечислите виды соосаждения и кратко их охарактеризуйте. 10. Почему соосаждение является источником погрешностей в гравиметрическом анализе? За счет каких приемов можно уменьшить соосаждение? 11. Для чего используют промывание? Что применяют в качестве промывной жидкости? Какими свойствами осадков руководствуются при выборе промывной жидкости? 12. Фактор пересчета (определение, практическое значение). Титриметрический анализ Сущность титриметрического анализа. Основные понятия, Определения, формулы Это метод количественного анализа, основанный на точном измерении объема раствора реактива, израсходованного на реакцию с определяемым компонентом. В титриметрическом анализе применяют титрованные растворы, или титранты, титр которых точно известен. Титр является наиболее точным способом выражения концентрации раствора. Под титром понимают количество граммов вещества, содержащееся в 1 мл раствора (г/мл):
Наряду с титром в титриметрическом анализе используют еще один способ выражения концентрации раствора – это молярная концентрация эквивалента, под которой понимают отношение количества вещества эквивалента в растворе к объему раствора:
Единица измерения – моль/л. После численного значения обычно применяют сокращенное «н». Например, 1н., 0,1н. раствор. Для расчета молярной концентрации эквивалента (нормальности) раствора следует знать молярную массу эквивалента Э. Молярную массу эквивалента кислот, оснований и солей рассчитывают по формулам:
Титрование – это процесс постепенного приливания титранта к анализируемому раствору. При титровании используют не избыток реактива (как в гравиметрическом анализе), а количество его, точно соответствующее уравнению реакции и химически эквивалентное количеству анализируемого вещества. Поэтому в ходе титрования важно установить момент окончания реакции, или точку эквивалентности, в которой согласно закону эквивалентов количество титранта равно количеству анализируемого вещества. По достижении точки эквивалентности титрование прекращают. Сущность титриметрического анализа можно выразить формулой:
C1∙V1=C2∙V2 , (28)
где С1 – молярная концентрация эквивалента титранта; С2 – молярная концентрация эквивалента анализируемого раствора; V1 и V2 – соответственно их объемы. Точку эквивалентности в титриметрическом анализе устанавливают по изменению окраски индикатора. Индикаторы – это вещества, изменяющие свою окраску при определенных значениях рН. По типу используемой реакции, различают следующие методы титриметрического анализа: - кислотно-основное; - осадительное; - комплексонометрическое; - окислительно-восстановительное титрование. В зависимости от способа получения титрованные растворы делят на стандартные (приготовленные) и стандартизированные (установленные). Стандартных веществ немного, они должны удовлетворять определенным требованиям. Их готовят по точной навеске. По стандартному веществу затем устанавливают концентрацию стандартизированного раствора. Точность титриметрического анализа зависит от следующих факторов: - точности измерения объемов реагирующих веществ; - правильности и точного приготовления стандартных веществ и титрантов; - правильного выбора индикатора.
|
|
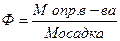 (21)
(21)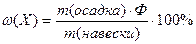 (22)
(22) Дано: Решение:
Дано: Решение: n (CaO) =
n (CaO) = 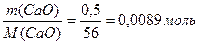
 Дано: Решение:
Дано: Решение: V ((NH4)2C2O4) - ? Из уравнений реакций 1 и 2 следует, что
V ((NH4)2C2O4) - ? Из уравнений реакций 1 и 2 следует, что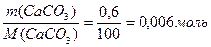
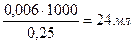
 m(AICI3) = 0,3г АICI3 + 3NH4OH = AI(OH)3↓+ 3NH4CI
m(AICI3) = 0,3г АICI3 + 3NH4OH = AI(OH)3↓+ 3NH4CI V (NH4OH) - ? n (AICI3) =
V (NH4OH) - ? n (AICI3) = 
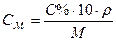 (См. Приложение III)
(См. Приложение III)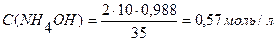
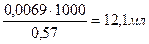


 Дано: Решение:
Дано: Решение: m (Са(Н2РО4)2) = 2,4835г
m (Са(Н2РО4)2) = 2,4835г 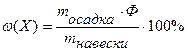
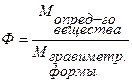
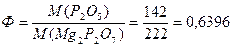

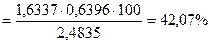
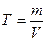 (23)
(23) (24)
(24)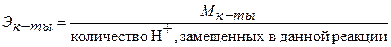 , (25)
, (25)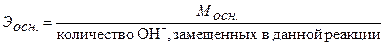 , (26)
, (26)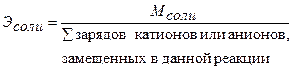 (27)
(27)