|
|
Теория растворов слабых электролитов.Сильные и слабые электролиты Количественной характеристикой процесса электролитической диссоциации является степень диссоциации. Степенью диссоциации a называется отношение количества электролита, распавшегося на ионы (n), к общему количеству электролита (n0):
Величина a выражается в долях единицы или в % и зависит от природы электролита, растворителя, температуры, концентрации и состава раствора. Особую роль играет растворитель: в ряде случаев при переходе от водных растворов к органическим растворителям степень диссоциации электролитов может резко возрасти или уменьшиться. В дальнейшем, при отсутствии специальных указаний, будем считать, что растворителем является вода. По степени диссоциации электролиты условно разделяют на сильные (a > 30%), средние (3% < a < 30%) и слабые (a < 3%). К сильным электролитам относят: 1) некоторые неорганические кислоты (HCl, HBr, HI, HNO3, H2SO4, HClO4 и ряд других); 2) гидроксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов; 3) почти все растворимые соли. Принято считать, что эти соединения диссоциируют полностью, т.е., на 100%. К электролитам средней силы относят Mg(OH)2, H3PO4, HCOOH, H2SO3, HF и некоторые другие. Слабыми электролитами считают все карбоновые кислоты (кроме HCOOH) и гидратированные формы алифатических и ароматических аминов. Слабыми электролитами являются также многие неоргани-ческие кислоты (HCN, H2S, H2CO3 и др.) и основания (NH3∙H2O). Несмотря на некоторые совпадения, в целом не следует отождествлять растворимость вещества с его степенью диссоциации. Так, уксусная кислота и этиловый спирт неограниченно растворимы в воде, но в то же время первое вещество является слабым электро-литом, а второе - неэлектролит. Теория растворов слабых электролитов. Процесс диссоциации слабых электролитов является обратимым: KtnAnm ⇄ nKtm+ + mAnn- и характеризуется константой равновесия, которая в данном случае называется константой диссоциации:
Величина Слабые одноосновные кислоты типа HA диссоциируют по общему уравнению: HA ⇄ H+ + A-. Константа диссоциации равна:
Здесь индекс a (acidum) указывает на кислотный тип диссоциации. Например, для слабой кислоты HNO2 можно записать: HNO2 ⇄ H+ + NO2-,
Аналогичным образом записывают константы диссоциации оснований: NH3×H2O ⇄ NH4+ + OH-.
Индекс b (basicum) обозначает основный тип диссоциации. Диссоциация многоосновных кислот (многокислотных осно-ваний) происходит в несколько ступеней, каждая из которых характе-ризуется своей константой. Например, для фосфорной кислоты имеем:
Видно, что Суммарная константа диссоциации определяется соотношением:
Несложно видеть, что суммарная константа диссоциации
На практике вместо величин
На основании значений чем больше значение чем меньше значение Величины констант диссоциации для некоторых слабых электролитов представлены в таблице 1. Таблица 1. Константы диссоциации некоторых слабых электро-литов при 298 К.
Таким образом, при постоянной температуре сравнительную силу слабых электролитов определяют две величины: степень диссо-циации a и константа диссоциации Действительно, для бинарного электролита, диссоциирующего по уравнению: KtAn ⇄ Kt+ + An- можно записать:
Представив
где С0(KtAn) – общая концентрация электролита, получим:
Данное соотношение выражает закон разведения Оствальда. Для слабых электролитов a << 1, поэтому можно записать:
или:
Таким образом, закон Оствальда можно сформулировать следующим образом: Степень диссоциации слабого электролита возрастает с разбавлением раствора. |
|


 зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора.
зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора.





 . Данное неравенство соблюдается для всех без исключения случаев ступенчатой диссоциации. Последовательное снижение величин констант диссоциации легко объяснимо: с увеличением отрицательного заряда иона отщепление каждого последующего протона становится все более энергоемким.
. Данное неравенство соблюдается для всех без исключения случаев ступенчатой диссоциации. Последовательное снижение величин констант диссоциации легко объяснимо: с увеличением отрицательного заряда иона отщепление каждого последующего протона становится все более энергоемким.
 равна произведению констант диссоциации отдельных ступеней:
равна произведению констант диссоциации отдельных ступеней:
 и
и  часто используют значения
часто используют значения 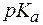 и
и  , которые рассчитываются следующим образом:
, которые рассчитываются следующим образом:














 .
.