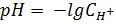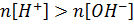|
|
Расчет кривой титрования хлороводородной кислоты раствором гидроксида натрияЗАДАНИЕ на лабораторно-практическое занятие № 21 по дисциплине «Аналитическая химия»
тема: «Кислотно-основное титрование (тема 10)» »
Для курсантов по специальности «Фармация»
Уточнено (дополнено):
«___»_________20___года __________________________
Санкт-Петербург
ПЛАН ПОДГОТОВКИ К лабораторному ЗАНЯТИЮ № 21 ТЕМА: «Кислотно-основное титрование (тема 10)» Литература для подготовки: 1. Лекция № 17; 2. [2] – С. 100‒165. 3. Ю.Я.Харитонов, В.Ю.Григорьева. Примеры и задачи по аналитической химии. – М.: ГЭОТАР-Медиа, 2009. – 304 с. 4. Лабораторный практикум по аналитической химии для курсантов и студентов военно-медицинской академии. Под ред. И. Гармашовой. Базисные вопросы: 1. Кривые кислотно-основного титрования. Расчет и построение кривой титрования сильных и слабых кислот и оснований. Определение области скачка титрования и точки эквивалентности. 2. Кислотно-основные индикаторы. Интервал перехода окраски индикатора. Выбор индикатора по кривой титрования. 3.Лабораторная работа: «Стандартизация рабочего раствора соляной кислоты». 3.1 Теоретические основы работы. 3.2 Выполнение лабораторной работы.
Теоретическая часть Кривые кислотно-основного титрования позволяют проследить за качественными и количественными изменениями титруемого раствора, подобрать условия определения конкретного вещества и выбрать подходящий индикатор для установления точки эквивалентности. Кривые кислотно-основного титрования строят в координатах: по оси абсцисс - объема титранта или степень оттитрованности, по оси ординат - значения рН титруемого раствора. В основе титриметрических расчетов лежит закон эквивалентности. Независимо от варианта титрования при построении кривых рассчитывают рН на следующих четырех этапах: 1) до начала титрования:
Или
2) титрование до точки эквивалентности
В процессе титрования до точки эквивалентности титруемый раствор содержит смесь катионов сильной кислоты (или основания) и соли, образованной катионами сильного основания и анионами сильной кислоты. Т.О., при расчете значений рН при титровании раствора кислоты раствором щелочи используют уравнение
Или при титровании раствора щелочи раствором кислоты
3) в точке эквивалентности
4) титрование после точки эквивалентности: при титровании раствора кислоты раствором щелочи используют уравнение:
Или при титровании раствора щелочи раствором кислоты
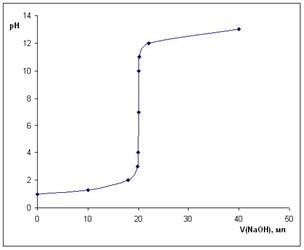
Число рассчитываемых на втором этапе точек может быть различным, обязательно рассчитывают в точках нейтрализации 50% и 99,9% титруемого вещества. Значение рН соответствует началу скачка титрования. На четвертом этапе рассчитывают рН в момент добавления 0,15 избытка титранта, т.е. 100,1% оттитрованности. Значение рН соответствует концу скачка титрования. Чем больше скачок титрования, тем точнее можно оттитровать определяемое вещество. Построение кривых кислотно-основного титровани. Для обоснованного выбора индикатора процесс титрования моделируют в виде кривой титрования. Ошибка титрования будет минимальной, если рТ индикатора попадает в область скачка на кривой титрования. Например, рассмотрим процесс построения кривой титрования 20 мл раствора хлороводородной кислоты (С = 0,10 моль/л) раствором гидроксида натрия (С = 0,10 моль/л) без учета разбавления раствора. Для этого рассчитаем рН в начальный момент титрования (когда щелочь не добавлена), рН в промежуточные моменты до точки эквивалентности (т. э.), рН в т. э. и рН после т. э. (данные представлены в табл. , кривая титрования на рис. 1). Расчет кривой титрования хлороводородной кислоты раствором гидроксида натрия
Кривая титрования 0,1 М HCl раствором 0,1 М NaOH
Область скачка на кривой титрования лежит в диапазоне 4-10 единиц рН, поэтому для фиксирования точки эквивалентности можно использовать кислотно-основные индикаторы, меняющие окраску в данном интервале (например, метиловый оранжевый или фенолфталеин).
ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ 1. В чем сущность метода нейтрализации? Какая химическая реакция лежит в основе метода? 2. Назовите основные титранты в методе нейтрализации. 3. Назовите типы кислотно-основного титрования. 4. Напишите уравнения реакций, лежащих в основе метода ацидиметрии. 5. Напишите уравнения реакций, лежащих в основе метода алкалиметрии. 6. Что такое индикатор? Какие индикаторы применяют в методе нейтрализации? 7. Как объясняют изменение окраски индикатора в растворе: а) с точки зрения ионной теории; б) с точки зрения хромофорной теории? 8. Перечислите требования, предъявляемые к кислотно-основным индикаторам. 9. Что такое интервал перехода индикатора? Дайте понятие показателю титрования. Приведите математическую запись расчета рТ. 10. Стандартизацию раствора HCl можно сделать по титрованному раствору NaOH и по Na2B4O7∙10H2O. Какой из этих способов обеспечит более высокую точность и почему? 11. В каких координатах строят кривые титрования? Какие значения рН рассчитывают при их построении? 12. Приведите вид кривой титрования сильной кислоты сильным основанием. Укажите области скачка титрования, линию нейтральности, линию эквивалентности, точку эквивалентности. 13. Как с помощью кривой титрования выбрать индикатор? 14. Приведите вид кривой титрования сильного основания сильной кислотой. Укажите области скачка титрования, линию нейтральности, линию эквивалентности, точку эквивалентности. 15. Какие факторы или характеристики (Кдис., Т, Сm, Vт-та, скорость титрования) влияют на: а) положение точки эквивалентности; б) величину и положение скачка титрования. 16. В каком случае (из двух сравниваемых) величина скачка титрования будет больше: а) 0,1М NH3 + 0,1М HCl или 0,1М NaOH + 0,1М HCl; б) 0,1M HF + 0,1MNaOH или 0,1M HIO3 + 0,1M HCl. 17. Какой из индикаторов (м/о, ф/ф, лакмус) пригоден для титрования: а) С6Н5СООН + NaOH; б) Na2CO3 + 2HCl; в) HNO3 + NaOH; г) NH3 + HCl. 18. Какая методика – прямое или обратное кислотно-основное титрование – используется при определении содержания следующих веществ: KCN, NH4Cl, NH3, Na2CO3, CaCO3? Указать применяемые титранты. 19. Напишите формулу для расчета титра раствора HCl при титровании K2HPO4 в присутствии CaCl2. 20. Как приготовить рабочие растворы: а) 0,1М HCl; б) 0,1М NaOH; в) 0,1н Na2CO3 (f = ½); г) 0,1н H2SO4. Решите следующие задачи 1. Рассчитайте степень оттитрованности серной кислоты с концентрацией 0,1 моль/л гидроксидом натрия (СNaOH = 0,05 моль/л) после добавления 30 мл гидроксида натрия к 20 мл серной кислоты. 2. Вычислить молярную концентрацию и титр раствора HCl, если на титрование 0,4217 г буры израсходовано 17,50 мл этой кислоты. 3. Навеску Н2С2О4∙2Н2О массой 0,6000 г растворили в мерной колбе вместимостью 100,0 мл. На титрование 20,00 мл полученного раствора израсходовали 18,34 мл NaOH. Определить молярную концентрацию раствора NaOH и его титр по Н2С2О4. 4. Рассчитать область скачка титрования, рН в точке эквивалентности и подобрать индикатор, если а) определяемое вещество 0,2 М HCl, а титрант 0,2М NaOH; б) определяемое вещество 0,1 н. H2SO4, а титрант 0,1 М NaOH. 5. На титрование с фенолофталеином навески массой 0,4478 г, состоящей из Na2CO3, NaHCO3 и NaCl, потребовалось 18,80 мл 0,1998 М раствора HCl. При титровании с метиловым оранжевым на ту же массу израсходовали 40,00 мл раствора кислоты. Вычислить массовую долю (%) Na2CO3 и NaHCO3 в смеси.
|
|