|
|
ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЁМЕПУТЕЙ СООБЩЕНИЯ (МИИТ)
Кафедра «Физика»
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЁМЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОЙ РАБОТЕ № 144 по дисциплине «Физика»
Под редакцией профессора Марченко В.И.
МОСКВА – 2011
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ (МИИТ)
Кафедра «Физика»
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЁМЕ
Под редакцией профессора В.И. Марченко
Рекомендовано редакционно-издательским советом университета в качестве методических указаний для студентов ИУИТ, ИТТСУ и ИПСС
Л-90
Р.М. Лагидзе, Ю.Н. Харитонов, А.М. Куюмчян. Определение отношения теплоёмкостей воздуха при постоянном давлении и объёме. Методические указания к лабораторной работе № 144 по дисциплине «Физика» / под ред. проф. В.И. Марченко – М.: МИИТ, 2011. – 13 с.
Методические указания к выполнению лабораторной работы № 144 «Определение отношения теплоёмкостей воздуха при постоянном давлении и объёме» соответствуют программе и учебным планам по физике (раздел «Молекулярная физика») и предназначены для студентов 1, 2 курсов технических специальностей.
© Московский государственный университет путей сообщения (МИИТ), 2011
Работа 144
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЁМЕ
Цель работы: Определение отношения теплоёмкости воздуха при постоянном давлении к теплоёмкости при постоянном объёме. Приборы и принадлежности: установка ФПТ1-6, общий вид которой приведён на рис. 3.
Введение
Удельной теплоемкостью вещества называется величина, равная количеству теплоты, которую необходимо сообщить единице массы вещества для увеличения её температуры на один Кельвин: с = Молярной теплоёмкостью (или теплоёмкостью одного моля вещества) называется величина, равная количеству теплоты, которую необходимо сообщить одному молю вещества для увеличения его температуры на один Кельвин: C = cμ = где m – масса; m – масса одного моля вещества, n = В СИ удельная теплоёмкость выражается в Дж/кг∙К, а молярная – в Дж/моль∙К. Численное значение теплоёмкости зависит от природы газа и процесса нагревания. Согласно первому закону термодинамики количество теплоты δQ, сообщенное системе, расходуется на увеличение внутренней энергии dU и на выполнение системой работы δA против внешних сил:
δQ = dU + δA. (1)
Увеличение внутренней энергии идеального газа при увеличении его температуры на dT: dU = где i – число степеней свободы молекулы, под которым подразумевается число независимых координат, определяющих положение молекулы в пространстве: i = 3 – для одноатомных; i = 5 – для двухатомных; i = 6 – для трёх- и многоатомных молекул; R – универсальная газовая постоянная; R =8,31 Дж/(моль·К). При расширении газа он выполняет работу:
δA = PdV.
Если газ нагревать при постоянном объёме V = const, то δА = 0, и согласно (1) все полученное газом количество теплоты расходуется только на увеличение его внутренней энергии (dQV = dU), и, учитывая (2), молярная теплоемкость идеального газа при постоянном объеме:
CV = Если газ нагревать при постоянном давлении P = const, то полученное газом количество теплоты расходуется на увеличение внутренней энергии dU и выполнение работы δА:
δQ =dU+PdV.
Тогда молярная теплоемкость идеального газа при постоянном давлении: CP = Используя уравнение состояния идеального газа (уравнение Клапейрона – Менделеева), PV = можно доказать, что для одного моля газа
P
и поэтому молярная теплоемкость при P = const:
CP = Для отношения теплоёмкостей g можно записать: g =
Методика измерений
Для определения отношения СР/CV для воздуха в данной лабораторной работе применен метод, предложенный Клеманом и Дезормом, в котором использовано охлаждение газа при его адиабатическом расширении. Предполагается, что воздух – идеальный газ. Адиабатическим называется процесс, который происходит без теплообмена с окружающей средой. Быстрое сжатие и быстрое расширение газа приблизительно можно рассматривать как адиабатический процесс. Согласно первому закону термодинамики (1) для адиабатического процесса: 0 = dU + δA. Откуда δA = -dU = -
Из последнего уравнения видно, что при адиабатическом сжатии температура газа повышается за счёт работы внешних сил (δA<0), а при адиабатическом расширении (δA>0) температура газа понижается, т.к. часть внутренней энергии газа расходуется на работу по расширению газа. Рисунки 1 и 2 поясняют метод Клемана и Дезорма. На рисунке 1 изображён лабораторный стенд, который состоит из стеклянного баллона Б, наполнённого воздухом и соединённого с водяным манометром М. Посредством крана К баллон может сообщаться с атмосферой. Первоначально в баллоне было атмосферное давление РА и температура TА, равная температуре окружающей среды.
Рис. 1
Рис. 2
Если с помощью насоса Н подкачать в баллон некоторое количество воздуха, то давление в баллоне повысится до значения Р1. Манометрический водяной столбик не сразу займет окончательное положение, так как при быстром сжатии температура повышается. Благодаря теплопроводности стенок сосуда через некоторое время температура воздуха в баллоне сравняется с температурой воздуха окружающей среды. Это состояние газа характеризуется температурой Т1 = ТА, и давлением Р1 (на рис. 2 точка 1). Давление Р1 равно сумме первоначального давления газа в баллоне РА и избыточного давления газа в баллоне DР1:
Р1 = РА + DР1.
После того как давление газа в баллоне установилось, открывается кран и воздух адиабатически расширяется, выходя в атмосферу. В тот момент, когда давление воздуха в баллоне становится равным атмосферному (высота столбиков воды в обоих коленах манометра сравнивается), кран быстро закрывается. При расширении температура газа в баллоне понижается. Это состояние представлено точкой 2 на рис. 2. В первоначальный момент температура ниже ТА окружающей среды. Через некоторое время после закрытия крана температура воздуха в баллоне повышается до температуры ТА за счет теплообмена с окружающей средой, а давление в баллоне при этом повысится на величину избыточного давления DР2. Состояние газа будет характеризоваться температурой Т1 и давлением: Р3 = РА + DР2.
Это состояние представлено точкой 3 на рис. 2. Таким образом, процесс перехода газа из состояния 1 в состояние 2 происходит адиабатически, а из состояния 2 в состояние 3 изохорически. Точки 1 и 3 диаграммы лежат на одной изотерме. Адиабатическое расширение при переходе из состояния 1 в состояние 2 описывается уравнением Пуассона: Р1
Для изохорического процесса при переходе газа из состояния 2 в состояние 3 имеем:
Из уравнений (4) и (5), исключив T2/T1, получим:
Логарифмируя выражение (6), получим:
(1 - g) (lgP1 - lgP2) = g(lgP2 - lgP3).
откуда g =
Заменив Р1, Р2 и Р3 на Р1 = РА + DР1, Р2 = РА, Р3 = РА + DР2, получим: g =
Учитывая, что Dlgx » Dх/х, если Dх малая по сравнению с х величина, имеем (DР1 и DР2 малы по сравнению с РА): g =
Учитывая также, что DР = rgDh, где Dh - разница высот столбиков воды в манометре, окончательно получаем:
g =
Экспериментальная установка
Для определения отношения теплоёмкостей воздуха g = CP/CV используется экспериментальная установка ФПТ1-6, общий вид которой показан на рис. 3. Установка состоит из стеклянной колбы, соединённой с открытым вертикальным водяным манометром 2. Воздух нагнетается в колбу микрокомпрессором, размещённым в блоке рабочего элемента 1. Микрокомпрессор включается тумблером «Воздух», расположенным на передней панели блока рабочего элемента. Пневмотумблер «Атмосфера», расположенный на передней панели блока рабочего элемента, в положении «Открыто» позволяет соединять колбу с атмосферой.
Рис. 3.
Порядок выполнения работы:
1. Включите установку тумблером «Сеть».
2. Установите пневмотумблер «Атмосфера» в положение «Закрыто». Для подачи воздуха в колбу включите тумблер «Воздух».
3. По изменению уровней воды в коленах манометра контролируйте давление в колбе. Когда разность уровней воды в манометре достигнет значения Dh1 = 150 ¸ 250 мм, отключите тумблер «Воздух».
4. Подождите две - три минуты, пока температура воздуха в колбе Т1 сравняется с температурой окружающего воздуха ТА. При этом в колбе установится постоянное давление P1 = PА + rgDh1. Определите разность уровней Dh1, окончательно установившуюся в коленах манометра, и внесите её значение в таблицу 1.
5. На короткое время соедините колбу с атмосферой, установив пневмотумблер «Атмосфера» в положении «Открыто». Как только уровни воды в коленах манометра сравняются, возвратите пневмотумблер «Атмосфера» в положение «Закрыто».
6. Через две - три минуты, когда в колбе установится постоянное давление P3 = PА + rgDh2, определите разность уровней Dh2, установившуюся в коленах манометра, и внесите её в таблицу 1.
Таблица 1
7. Повторите измерения по пп. 2 ¸ 6 не менее 10 раз при различных значениях величины Dh1.
По окончании работы выключите установку тумблером «Сеть».
Обработка результатов измерений
1. Вычислите g по формуле (7) и внесите их значения п последнюю строку таблицы 1.. 2. Вычислите <g> как среднее арифметическое для всех полученных значений gi по формуле: <g> = 3. Вычислите величину среднего квадратичного отклонения S по формуле: S =
где n - число измерений. 4. Найдите абсолютную погрешность измерений: Δγ = aS,
где a - коэффициент Стьюдента, определяемой по таблице, приведённой в работе [4] и на информационном стенде лаборатории. Доверительная вероятность задается преподавателем. Результат запишите в виде:
g = <g> ± Δγ.
5. Оцените относительную погрешность полученного значения g по формуле:
δg = (Δγ /<g>)·100%.
Полученное значение <g> сравните с теоретическим значением, вычисленным по формуле (3), рассматривая воздух как двухатомный газ.
Контрольные вопросы
1. Какой процесс изменения состояния газа называется изотермическим, изобарическим, изохорическим и адиабатическим? Нарисуйте графики этих процессов. 2. Сформулируйте первый закон термодинамики. Запишите этот закон для изотермического, изобарического, изохорического и адиабатического процессов. 3. Дайте определение удельной и молярной теплоемкостей. В каких единицах СИ они измеряются? 4. Приведите формулы расчёта молярных теплоёмкостей СV и СP 1-, 2-, 3- и многоатомного идеальных газов. 5. Что называется числом степеней свободы молекулы и чему оно равно для 1-, 2-, 3- и многоатомного идеальных газов? 6. Рассчитайте теоретическое значение g для 1-, 2-, 3- атомного газа. 7. В чем заключается метод Клемана и Дезорма для определения отношения СP/СV? 8. Опишите рабочий цикл и изменения состояния воздуха по диаграмме P-V, приведённой на рис. 2. 9. Как изменяется температура газа при адиабатическом расширении и адиабатическом сжатии и почему?
Список литературы
1. Савельев И.В. Курс общей физики в 3-х тт. Т. 1. Механика. Молекулярная физика. – М.: Астрель АСТ, 2007. – 352 с. 2. Яворский Б.М., Детлаф А.А. Курс физики. – М.: Изд-во «Академия», 2003. – 720 с. 3. Трофимова Т.И. Курс физики. – М.: Высшая школа, 2004. – 544 с. 4. Селезнёв В.А., Тимофеев Ю.П. Методические указания к вводному занятию в лабораториях кафедры физики. – М.: МИИТ, 2006. – 30 с.
Учебно-методическое издание
Лагидзе Раули Михайлович Харитонов Юрий Николаевич Куюмчян Аарон Максимович
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЁМКОСТЕЙ ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЁМЕ
Методические указания к лабораторной работе №144 под редакцией профессора В.И. Марченко
Подписано к печати Заказ № Формат 60 × 84 × 21/16 Усл.-печ. л. Изд. № 179-11 Тираж 300 экз. 127994, Москва, ул. Образцова д. 9, стр. 9. Типография МИИТа |
|
 МОСКВА -2011
МОСКВА -2011 УДК 531.53
УДК 531.53 .
. =
=  ,
, – число молей.
– число молей.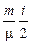 RdT, (2)
RdT, (2)
 = (i/2)R.
= (i/2)R. +
+  .
. RT,
RT, = R,
= R,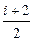 R.
R. =
=  . (3)
. (3) RdT.
RdT.

 = Р2
= Р2 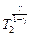 .(4)
.(4) =
= 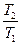 . (5)
. (5) =
=  (6)
(6) .
.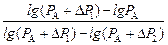 .
.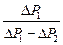 .
. . (7)
. (7)
 .
.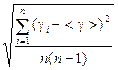 ,
,