|
|
Применение численных методов в физической химии
Расчет стехиометрии химических процессов Стехиометрические расчеты являются неотъемлемой частью рассмотрения каждого процесса, в котором происходит химическое превращение. Цель стехиометрического расчета – выявление соотношения количества реагирующих компонентов по уравнению химической реакции.
Стехиометрический расчет одной химической реакции
Совокупность веществ, изучаемых химией, можно рассматривать как множества, элементами которых являются атомы, молекулы, ионы, комплексы, а также заряды. Молекулы, атомы или ионы каждого отдельного соединения определяются брутто-формулой, например, CO2, H2O, NH3. Каждая брутто-формула - это упорядоченная совокупность чисел. Если на первом месте записать число атомов водорода, на втором - углерода, на третьем - кислорода, на четвертом - азота, то указанным соединениям будут соответствовать совокупности (0,1,2,0), (2,0,1,0), (3,0,0,1) и т.д. Каждому элементу периодической системы можно в такой последовательности отвести место, соответствующее его порядковому номеру. Дополнительным числом можно указать положительный либо отрицательный заряд иона. При этом все вещества или молекулы будут характеризоваться определенными последовательностями чисел. Химические системы представляют собой конечную совокупность (N) атомов, из которых построены молекулы рассматриваемого множества. Обозначив виды атомов, входящих в молекулу вещества Aj через ВК, где к=1,2,3,…N, число атомов, входящих в молекулу Aj, через bjK, можно записать молекулу любого вещества:
Совокупность молекул А1, А2, А3, Аn, состоящих из атомов В1, В2, В3, ВN, записывается с помощью системы равенств:
Представив совокупность атомов BK в виде матрицы-столбца В, а совокупность молекул Аj - в виде матрицы-столбца А
с учетом правил матричного умножения можно записать состав молекулярной смеси в виде:
Или: А = b × В, где b - атомная матрица, размером n×N, которая представляет состав молекулярной смеси. Пример. Композиция из трех молекул H2, O2, H2O может быть связана с ее атомными составляющими Н и О следующим образом:
Обозначив номер произвольной химической реакции i=1,2,3,…m, где m – количество химических реакций, стехиометрический коэффициент вещества Aj в реакции – аij, можно записать выражение химической реакции:
Или: a11А1 + а12А2 + …. + а1nАn = 0 a21А1 + а22А2 + …. + а2nАn = 0 a31А1 + а32А2 + …. + а3nАn = 0 ------------------------------------- am1А1 + аm2А2 + …. + аmnАn = 0. Если аj – отрицательное число, то говорят, что j-тое вещество является исходным в реакции, если аj – положительное число, то j-тое вещество является продуктом реакции. Систему стехиометрических коэффициентов всех реакций можно представить в виде стехиометрической матрицы:
Тогда выражение химической реакции можно переписать в матричном виде: а × А = 0. Учитывая, что А = b × В, получим а × b × В = 0, и следовательно а × b = 0. Пример.
Найти эту реакцию из условия а × b = 0. а = (а1, а2, а3) А1 = Н2, А2 = О2, А3 = Н2О а1H2 + а2О2 + а3H2О = 0, т.к. H2 = 2H, O2 = 2O, H2О = 2H + O, то (2а1 + 2а3)H + (2а2 + а3)O = 0
a1 = 2a2 Пусть a1 = 1, тогда a2 = 0,5, a3 = -1 а = (1; 0,5; -1) H2 + 0,5О2 - H2О = 0 или H2О=H2 + 0,5О2. Рассмотрим реакцию: aA + bB = cC, где a,b,c – стехиометрические коэффициенты при участниках реакции. Общее количество молей в системе обозначим через N:
Nj = Nj0 + aj · x, где Nj0 – начальное количество молей j-го вещества; Nj – конечное количество молей j-го вещества; x – химическая постоянная, характеризующая степень полноты реакции. Аналогично записывается выражение массы:
Mj = Mj0 + aj · mj · x, где Mj = Nj · mj Mj0 = Nj0 · mj.
Обозначим молярную долю через nj:
Распишем это выражение:
Разделив числитель и знаменатель на N0, и получим:
где Обозначим массовую долю вещества через qj и проведем расчет, используя следующие преобразования:
Поскольку Σaj∙mj = 0 по закону сохранения масс, то
где
Пример. Дана стехиометрическая смесь азота и водорода: N2 + 3H2 = 2NH3 Начальные количества молей соответственно равны: N10 = 1, N20 = 3, N30 = 0. Молярная доля аммиака в конечной реакционной смеси n3 = 0,25. Рассчитать степень полноты реакции x. Составить материальный баланс. Решение.
Расчет материального баланса. Приход. N2: M10 = N10 · m1 = 1 · 28 = 28 кг H2: M20 = N20 · m2 = 3 · 2 = 6 кг NH3: M30 = 0 M0 = Расход. M1 = M10 + a1 · m1 · x =28 – 28 · 0,4 = 16,8 кг M2 = M20 + a2 · m2 · x = 6 – 3 · 2 · 0,4 = 3,6 кг M3 =M30+a3 · m3 · x=0 + 2 · 17 · 0,4 = 13,6 кг M = |
|
 .
.
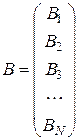 ;
;  ,
, .
. .
. аijAj = 0.
аijAj = 0.
 .
.



 .
.
 ,
,  .
. ,
, .
. .
.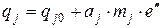 ,
,  ,
, .
.
 кг.
кг. кг.
кг.