|
|
ПОЛИМЕРИЗАЦИИ ГИДРОФИЛЬНЫХ МОНОМЕРОВ.Химия и физика водорастворимых Высокомолекулярных соединений
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Химия и физика водорастворимых Высокомолекулярных соединений
Учебное пособие
Волгоград 2003 УДК 678.7.01(075)+541.6 (075)
Под редакцией доктора химических наук, профессора И.А. Новакова
Авторы: Навроцкий А.В., Крюкова Я.М., Дрябина С.С., Котляревская О.О., Ковалева О.Ю., Шулевич Ю.В., Навроцкий В.А.
Рецензенты: доктор химических наук А.Н. Брель,
Химия и физика водорастворимых высокомолекулярных соединений: Учебное пособие / Навроцкий А.В., Крюкова Я.М., Дрябина С.С., Котляревская О.О., Ковалева О.Ю., Шулевич Ю.В., Навроцкий В.А. / ВолгГТУ, Волгоград, 2003. – 113 с.
isbn
В учебном пособии рассматриваются теоретические основы по синтезу и исследованию физико-химических свойств полиэлектролитов, которые отличаются от других классов высокомолекулярных соединений рядом специфических свойств. Экспериментальная часть включает описание одиннадцати лабораторных работ по четырем основным разделам, каждый из которых предполагает ознакомление студентов со специфическими свойствами водорастворимых полимеров. В ходе выполнения лабораторных работ студенты получают практические навыки в исследовании закономерностей синтеза и определения физико-химических характеристик полимеров, формируемых на стадии получения. Предназначены для инженерной и магистерской подготовки студентов, обучающихся по специальности 2505 и магистерской программе 550810. Ил. 7, табл. 21, Библиогр.: 29 назв.
Печатается по решению редакционно-издательского совета Волгоградского государственного технического университета
isbn © Волгоградский государственный технический университет, 2003 ВВЕДЕНИЕ Общие теоретические курсы «Химия полимеров» и «Особенности кинетики и термодинамики синтеза ВМС», освоенные студентами на третьем и четвертом курсах, а также изучаемая будущими инженерами и магистрами на пятом курсе «Общая химическая технология высокомолекулярных соединений», знакомят студентов с основами науки о полимерах и дают представление о ее важнейших практических приложениях. В общих курсах рассматриваются наиболее важные аспекты химии, физико-химии и физики полимеров в их единстве, определяемом макромолекулярностью и цепным строением. Исходя из тех же принципов, предлагаемое учебное пособие по химии и физике полимеров со специальными свойствами способствует закреплению у студентов полученных ими в общих и специальных курсах представлений о химических и физических особенностях полимера в зависимости от его структуры, а также прививает навыки в области синтеза, изучения физико-химических свойств и микроструктуры полимеров, со специальными свойствами Учебное пособие включает лабораторный практикум с описанием одиннадцати работ по синтезу и исследованию свойств водорастворимых полимерных электролитов. Основной целью практикума является получение студентами практических навыков в исследовании физико-химических свойств полимеров и выявлении специфических качеств, определяемых их микроструктурой. ВОДОРАСТВОРИМЫЕ ПОЛИМЕРЫ. ОСОБЕННОСТИ ПОЛИМЕРИЗАЦИИ ГИДРОФИЛЬНЫХ МОНОМЕРОВ.
Водорастворимые полимеры являются одними из наиболее перспективных высокомолекулярных соединений и находят все более широкое применение. Преимущества использования таких полимеров во многом связаны с решением экологических проблем. Действительно, производство и применение водорастворимых полимеров не требует использования органических растворителей. В результате исключается огне- и взрывоопасность производственных операций и минимизируется загрязнение промышленных сточных вод и газовых выбросов. При этом некоторые области применения водорастворимых полимеров прямо связаны с процессами очистки природных и сточных вод. С позиции практического использования водорастворимые полимеры делят на две группы – сохраняющие растворимость в воде и теряющие растворимость при изготовлении изделий. В первом случае полимеры, как правило, применяют в виде растворов. Основные направления использования растворов – это регулирование свойств дисперсных систем (стабилизация или разрушение), регулирование реологических свойств жидкостей (загустители или агенты для снижения гидравлического сопротивления при турбулентном течении). Применение водорастворимых полимеров в качестве клеев, адгезивов, связующих, а также упаковочных материалов связано с потерей растворимости в процессе переработки. Водорастворимыми являются полимеры, в структуре которых содержатся звенья способные к сольватации водой (неиногенные водорастворимые полимеры) или к диссоциации (полиэлектролиты). В зависимости от знака заряда полииона полиэлектролиты делятся на катионные, анионные и амфолиты. К неионогенным водорастворимым полимерам относятся полимеры, содержащие гидроксильные, эфирные, амидные группы, например, поливиниловый спирт (а), полиоксиэтилен (б), производные целлюлозы, полиакриламид (в), поливинилпирролидон (г):
а), б), в), г) Однако полиакриламид относится к неионогенным полимерам с достаточной долей условности, так как в условиях получения полимера существует возможность гидролиза отдельных амидных групп с образованием звеньев акриловой кислоты, что приводит к получению анионного по свойствам полиэлектролита- сополимера, содержащего звенья акриламида и акриловой кислоты. Особую группу водорастворимых полимеров составляют полиэлектролиты, образующие при диссоциации полиионы. К анионным полиэлектролитам относятся водорастворимые полимеры, содержащие карбоксильные, сульфонатные, сульфатные и фосфатные группы. В зависимости от константы диссоциации ионогенных групп различают сильнокислотные (-SO3-, -РO42-) и слабокислотные (-СООН) полиэлектролиты. Типичными слабыми поликислотами являются полиакриловая (а), полиметакриловая (б), альгиновая и другие кислоты. Сильные поликислоты – это полиэтиленсульфокислота (в), полистиролсульфокислота (г), гепарин и др.
а), б), в), г). Катионные полиэлектролиты в зависимости от константы диссоциации ионогенных групп подразделяются на сильно- и слабоосновные. К слабоосновным полиэлектролитам относятся полимеры, содержащие в цепи первичные, вторичные и третичные атомы азота, способные протонироваться в водных растворах: поливиниламин (а), полиэтиленимин (б), поливинилпиридины (в) и др.
а), б), в) Сильные полиоснования чаще всего получают алкилированием атомов азота слабоосновных поликатионитов или мономеров на стадии синтеза. К ним относятся четвертичные соли винилпиридинов (а), аминоалкиловых эфиров акриловой (б) и метакриловой кислот, ионены и другие ониевые полимеры, содержащие в основной цепи четвертичные атомы азота или фосфора, третичные атомы серы.
а), б)
1.1 Специфика гомо - и сополимеризации водорастворимых мономеров.
Радикальная полимеризация является одним из основных методов синтеза макромолекул и важнейшим способом получения полимеров в промышленности. Получение водорастворимых полимеров также в большинстве случаев реализуется путем радикальной гомо - и сополимеризации соответствующих мономеров. Радикальные реакции, независимо от конкретных объектов, в большинстве случаев подчиняются закономерностям теории цепных реакций, в соответствии с которой они достаточно четко разделяются на три этапа: инициирование, рост цепи и обрыв цепи. Каждая из этих стадий требует для своей реализации соответствующих условий. Стадия инициирования предполагает условия, обеспечивающие, во-первых, появление свободных радикалов. Если в качестве инициаторов используются органические пероксиды, то условиями, обеспечивающими генерацию радикалов, являются либо повышение температуры, либо введение добавок (например ИМПВ) активирующих гомолиз кислород – кислородной связи. Во-вторых, на этой стадии необходимо создать условия для формирования радикального состояния (неспаренного электрона) на полимере при его переработке или на мономере в процессе радикальной полимеризации. Эти условия реализуются с учетом реакционной способности обоих партнеров. Чаще всего радикал должен либо присоединится к субстрату по кратной связи, либо оторвать от него атом водорода. Вторая стадия начинается, в случае полимеризации, присоединением второй или третьей молекулы мономера к растущему радикалу и проходит со скоростью превышающей инициирование на несколько порядков. Обрыв цепи почти всегда контролируется автоматически и начинается в тот момент, когда концентрация радикальных частиц достигает величины при которой их встреча становится вероятной. Управлять такой системой достаточно сложно, во-первых, потому, что для каждой из стадий оптимальные условия могут не только не совпадать, но и быть противоречивыми; во-вторых, часто оно (стадии) практически неразделимы во времени, т.е. все три могут проходить одновременно. Одним из вариантов управления такой системой может быть учет реакционной способности радикалов в зависимости от их структуры и, в первую очередь, в зависимости от локализации неспаренного электрона. В соответствии с этими признаками радикалы можно разделить на углерод-центрированные, кислород-центрированные, элемент-центрированные (азот-, сера-, фосфор- и др.) Анализ радикальных реакций позволяет выявить закономерность в соответствии с которой кислород-центрированные радикалы преимущественно отрывают водород от субстрата. Исключение составляют силокси- и перфторалкокси-радикалы, которые как и углерод-центрированные преимущественно присоединяются по кратной связи. Сера-центрированные радикалы занимают промежуточное положение, то есть могут и отрывать водород и присоединятся по кратной связи. Азот-центрированные радикалы скорее отрывают водород, а фосфор-центрированные скорее присоединяются по кратной связи. В соответствии с изложенной концепцией можно говорить о некоторой селективности радикальных реакций и, учитывая реакционную способность радикальных частиц, появляется инструмент для управления такими реакциями. Исходя из классической теории радикальной полимеризации, реакционная способность растущего радикала роста полностью определяется химическим строением и природой мономера, из которого он образован. Будучи электронейтральными, свободные радикалы в очень малой степени чувствительны к полярности и сольватирующей способности реакционной среды. В этом случае скорость процесса полимеризации мономера и степень полимеризации (молекулярная масса) образующегося полимера описываются известными классическими уравнениями:
где [М] и [S] – концентрация мономера и растворителя (агента передачи цепи) соответственно, Р - среднечисленная степень полимеризации, Vи – скорость инициирования полимеризации, kр, kо, kМ, kп – константы скоростей роста, обрыва, передачи на мономер и передачи на растворитель (агент передачи цепи) соответственно. В случае сополимеризации мгновенный состав образующегося сополимера описывается уравнением Майо-Льюиса:
где [М1] и [M2] – мольные доли мономеров, вступающих в сополимеризацию, в мономерной смеси, m1 и m2 – мольные доли звеньев мономеров в составе сополимера, r1 и r2 – константы сополимеризации. Параметрами таких уравнений при постоянной температуре являются кинетические константы, зависящие от природы мономера, скорости инициирования, определяющейся природой и концентрацией инициатора, и концентрации реагирующих веществ. Необходимо отметить, что все эти теоретические положения были получены при изучении полимеризации неполярных или малополярных мономеров в массе или в углеводородных растворителях. Положения классической теории радикальной полимеризации неприменимы в случае полимеризации водорастворимых мономеров и мономеров-электролитов в воде и других высокополярных растворителях. Значительные отклонения хода полимеризации от классической схемы происходят вследствие того, что реакционная способность водорастворимых мономеров и мономеров электролитов, а также образованных из них радикалов роста сильно зависит от свойств среды. Следовательно, свойства реакционной среды оказывают существенное влияние на кинетические константы, скорость полимеризации, молекулярную массу, состав сополимера. С одной стороны, такая ситуация существенно осложняет процесс исследования и описания процессов полимеризации водорастворимых мономеров, а с другой стороны предоставляются дополнительные возможности управления процессом полимеризации с целью получения водорастворимых полимеров с заданными молекулярными характеристиками и физико-химическими свойствами. В качестве основных факторов, оказывающих влияние на реакционную способность мономеров и радикалов можно отметить следующие: образование Н-комплексов при взаимодействии с растворителем, изменение степени ионизации (диссоциации) мономеров-электролитов, ассоциация молекул мономера в результате гидрофобных взаимодействий, изменение реологических характеристик раствора мономера по сравнению с чистым растворителем. Рассмотрим более подробно механизмы действия указанных факторов. Образование Н-комплексов мономеров. Н-комплексы представляют собой систему мономер-растворитель, образованную за счет водородных связей. Эффективность образования таких комплексов определяется протоноакцепторными и протонодонорными свойствами мономеров и растворителей. Наиболее вероятно ожидать образования Н-комплексов в водных растворах. При этом при переходе от апротонных растворителей (например, диметилсульфоксид (ДМСО), формамиды) к воде наблюдается значительные изменения кинетических параметров полимеризации. Рассмотрим в качестве примера полимеризацию акриламида, акриловой и метакриловой кислот, скорость которой возрастает в ряду ДМСО <формамид <вода, то есть с увеличением протонодонорных свойств растворителя. Из данных таблицы 1.1 следует, что при переходе к водным растворам значительно повышается константа скорости роста цепи, что обусловлено соответственно снижением энергии активации реакции роста. Аналогичные выводы можно сделать из рассмотрения зависимости констант роста и обрыва цепи от природы растворителя при полимеризации N-винилпирролидона (таблица 1.2). Таблица 1.1 Кинетические параметры полимеризации ряда водорастворимых мономеров
Таблица 1.2 Кинетические константы полимеризации N-винилпирролидона
Причиной наблюдаемых кинетических эффектов является уменьшение степени делокализации неспаренного электрона радикала роста. Такая делокализация возможна при взаимодействии неспаренного электрона с сопряженной карбонильной группой. В водном или спиртовом растворе карбонильный кислород образует водородную связь с молекулами растворителя (формируется Н-комплекс), как показано на схеме реакции. В результате карбонильная группа, затрачивая свою электронную плотность на образование водородной связи, теряет способность вступать в сопряжение с неспаренным электроном. Следовательно, возрастает электронная плотность на углеродном атоме с неспаренным электроном и реакционная способность повышается.
Перенос заряда в Н-комплексе влияет и на полярность двойной связи мономера. Параметр полярности схемы Алфрея-Прайса е возрастает, когда мономер является акцептором протона в Н-комплексе и снижается, если мономер выступает в качестве донора. Перераспределение зарядов в Н-комплексе может изменить характер полярности двойной связи, то есть знак параметра е, как показано на схеме реакции:
В результате при сополимеризации могут возникать существенные изменения констант сополимеризации в зависимости от природы растворителя, что приводит к значительному изменению состава образующегося сополимера. Возможно образование чередующихся сополимеров из-за увеличения скорости перекрестного роста цепи. Изучение закономерностей (со)полимеризации ионогенных мономеров, то есть мономеров-электролитов также требует учета влияния среды на их реакционную способность. В этом случае реакционная среда существенно влияет на распределение электронной плотности в мономере и макрорадикале из-за изменения ионизационного состояния ионогенных групп. Последнее во многом определяет характер межмолекулярных и внутримолекулярных электростатических взаимодействий и конформационное состояние макрорадикалов, что также влияет на их реакционную способность. Влияние природы растворителя на кинетические параметры полимеризации ионогенного мономера можно рассмотреть на примере 1,2-диметил-5-винилпиридинийметилсульфата (1,2-ДМ-5-ВПМС). Данные, приведенные в таблице 1.3 показывают, что с увеличением полярности растворителя (ε) в ряду уксусная кислота-метанол-вода, скорость гомополимеризации 1,2-ДМ-5-ВПМС несколько снижается
Таблица 1.3 Скорость полимеризации 1,2-ДМ-5-ВПМС
[M]0=1,33 моль/л, инициатор - [ДАК]=4´10-3 моль/л, t=50 оС.
Снижение скорости происходит так, что при переходе к более сольватирующему растворителю (СН3СООН→СН3ОН→СН3ОН+Н2О) заметно снижается как константа роста, так и константа обрыва цепи. Отношение кр/ко1/2 при этом также уменьшается (таблица 1.4). Причины наблюдаемых явлений можно объяснить с привлечением данных о диссоциации ионогенных групп мономера и полимера. Таблица 1.4. Константы роста и обрыва цепи при полимеризации 1,2-ДМ-5-ВПМС в различных средах
[M]0=1,33 моль/л, [ДАК]=0,001 моль/л, длина волны 365 нм, t=23 оС.
В малополярных средах электростатическое отталкивание между одноименно заряженными мономером и радикалом 1,2-ДМ-5-ВПМС в результате ионной ассоциации нивелируется (высокие значения кр):
При переходе к более полярным растворителям степень диссоциации ионных пар увеличивается, поэтому вероятность взаимодействия одноименно заряженных мономера и растущего радикала уменьшается:
Аномально высокое значение кр при полимеризации 1,2-ДМ-5-ВПМС в уксусной кислоте (таблица 1.4) связывают как со снижением константы диссоциации, так и с образованием более сложных ассоциатов молекул мономера. Снижение константы скорости обрыва ко при переходе к более сольватирующему растворителю связано, по всей вероятности, с изменением вязкости реакционной среды, так как с увеличением полярности растворителя в ряду: СН3СООН → СН3ОН → СН3ОН+Н2О происходит увеличение эффективного заряда и размера клубков макромолекул. На величину ко может оказывать влияние появление дополнительного электростатического отталкивания при сближении одноименно заряженных макрорадикалов:
Cледует особо отметить увеличение соотношения kp/ko с ростом полярности растворителя. Из данных таблицы 1.4 следует, что увеличение полярности растворителя должно способствовать росту молекулярной массы образующегося полимера. Этот факт свидетельствует о преимуществах проведения полимеризации мономеров электролитов в водных растворах с целью получения полиэлектролитов высокой молекулярной массы, что требуется, например, в производстве полимерных флокулянтов. Активность ионизирующихся мономеров в реакциях радикальной сополимеризации также связана с особенностями поведения их молекул в реакционной среде. Способность водорастворимых мономеров к диссоциации обуславливает мультикомпонентность реакционной системы, которая заключается в возможности сосуществования в растворе различных ионизационных состояний ионогенных групп молекул мономеров и растущих цепей (молекулы, контактные и разделенные ионные пары, ионы):
Положение равновесия между ними определяется природой и концентрацией мономера, полярностью растворителя, и может смещаться в ходе сополимеризации из-за изменения ионной силы при увеличении конверсии мономеров. Помимо этого, в таких системах существует возможность гидрофобных взаимодействий, которые способны приводить к появлению межцепных ассоциатов типа мицелл. В совокупности, эти факторы приводят к изменению скоростей реакций роста и обрыва цепей, появлению кинетически неоднородных зон в полимеризующейся системе при изменении концентрации мономеров и глубины конверсии, что, в результате, затрудняет описание данных систем классическим уравнением сополимеризации с фиксированными значениями констант. Тем не менее, обобщение данных по сополимеризации ионизирующихся и комплексно связанных мономеров, позволило вывести уравнение состава сополимера, которое количественно учитывает эффекты диссоциации и комплексообразования. По форме оно аналогично уравнению Майо-Льюиса, но включает вместо истинных активностей мономеров – эффективные константы сополимеризации:
где r1эф= f(a), а r2эф= f(b) – эффективные константы сополимеризации; a и b - мольные доли диссоциированных или комплексно связанных мономеров и радикалов роста ~ М1· и ~ М2· соответственно; М01 и М02 – суммарные концентрации мономеров М1 и М2. Таким образом, приведенное уравнение может использоваться для анализа сополимеризации ионогенных и комплексно-связанных мономеров и определения эффективных констант сополимеризации, зависящих от условий эксперимента. Влияние природы реакционной среды можно рассмотреть на примере сополимеризации 1,2-ДМ-5-ВПМС с 2-метил-5-винилпиридином (МВП) и метилакрилатом (МА) в различных растворителях. В этом случае с увеличением концентрации воды в водно-метанольных растворах уменьшаются скорость сополимеризации и величины r1эф и r2эф. Особенно сильно уменьшается значение r1эф, т.е. относительная скорость реакции 1,2-ДМ-5-ВПМС со "своим" радикалом резко снижается (таблица 1.5). Таблица 1.5. Параметры сополимеризации 2-М-5-ВП и МА с 1,2-ДМ-5-ВПМС (М2) в различных растворителях
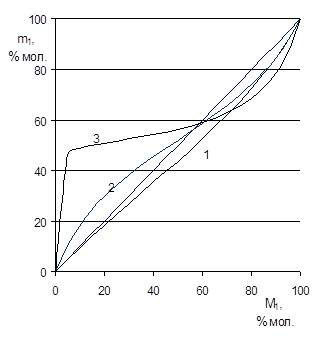
Действительно, при увеличении содержания воды молекулы 1,2-ДМ-5-ВПМС диссоциируют, и электростатическое отталкивание одноименно заряженного радикала и мономера должно приводить к падению элементарной константы к11 и, следовательно, эффективной константы r1эф. При добавлении бромида натрия, то есть при повышении вероятности образования ионных пар, наблюдается возрастание величины r1эф. В случае сополимеризации с МА эффект значительно меньше, так как падение r1эф=к11/к12 в результате уменьшения к11 компенсируется уменьшением константы к12, характеризующей взаимодействие одноименно поляризованных радикала 1,2-ДМ-5-ВПМС и мономера МА. Возрастание эффективной константы r2эф при переходе к более полярным средам объясняется, по-видимому, уменьшением константы скорости взаимодействия одноименно поляризованных радикала МА и мономера 1,2-ДМ-5-ВПМС - к21 с увеличением степени диссоциации ионогенных групп последнего. Эффект изменения состава сополимера при изменении констант сополимеризации в зависимости от состава растворителя можно наглядно представить на кривых состава, представленных на рис. 1.1. Так в метаноле во всем диапазоне составов мономерной смеси сополимер несколько обогащен звеньями мономера-электролита. При переходе к смеси метанол-вода кривая состава резко изменяется. При малом содержании МВП сополимер обогащается звеньями последнего, а на зависимости появляется точка азеотропного состава. Причем в случае смеси с равным содержанием метанола и воды фактически наблюдается чередующаяся сополимеризация.
Рис. 1.1 Зависимость состава сополимера 2-М-5-ВП (М1) с 1,2-ДМ-5-ВПМС от состава мономерной смеси в метаноле (1), смеси метанол:вода 4:1 об. (2) и смеси метанол-вода 1:1 (3).
Таким образом, основной особенностью полимеризации мономеров-электролитов является снижение реакционной способности мономеров и радикалов в растворителях способствующих диссоциации из-за возникновения электростатического отталкивания между реагирующими частицами. Водорастворимые мономеры содержат, как правило, в составе молекулы гидрофильную и гидрофобную часть. Такие вещества проявляют способность к межмолекулярной ассоциации в водных растворах за счет гидрофобных взаимодействий. В этом случае водорастворимые мономеры ведут себя подобно поверхностно-активным веществам. Кроме того, в состав молекул некоторых мономеров-электролитов специально вводят длинноцепочечные углеводородные заместители с целью получения полимеров с резко выраженными поверхностно-активными свойствами. Поэтому водорастворимые мономеры можно разделить на две группы. К первой группе относятся мономеры, не проявляющие ярко выраженных поверхностно-активных свойств, но они склонны к ассоциации при высоких (порядка 1-3 моль/л) концентрациях. Вторую группу составляют мономеры являющиеся типичными мицеллообразующими ПАВ. Мономеры первой группы в качестве гидрофобной части молекулы обычно имеют винильную группу, которая и является реакционным центром. Поэтому ассоциация таких мономеров ведет, как правило, к резкому и нелинейному росту скорости полимеризации при повышении начальной концентрации мономера выше некоторого критического значения. Это значение, очевидно, отвечает ситуации, когда концентрационные условия начинают благоприятствовать гидрофобным взаимодействиям, сближающим и фиксирующим двойные связи в выгодном для реакции роста положении. Типичная ситуация для полимеризации в таких условиях - повышение значения порядка реакции полимеризации по концентрации мономера от 1 до 1,5 и более. В случае мицеллообразующих мономеров зависимость скорости полимеризации от концентрации мономера не является однозначной. Действительно, формирование мицелл – ассоциатов мономера происходит уже не за счет сближения двойных связей, а в результате гидрофобных взаимодействий между длинноцепочечными углеводородными фрагментами. Причем, в зависимости от концентрации мономера происходит формирование мицелл различной архитектуры. Ассоциаты различного строения не являются кинетически однородными при полимеризации. В некоторых ассоциатах двойные связи занимают кинетически выгодное положение для протекания реакции роста, в то время как другие архитектуры затрудняют полиприсоединение. В результате зависимость скорости полимеризации от концентрации мономера характеризуется наличием, как возрастающих участков, так и убывающих, разделенных абсциссами, соответствующими различным критическим концентрациям мицеллообразования (ККМ). Таким образом, особенности радикальной полимеризации водорастворимых мономеров связаны с действием ряда факторов, приводящих к изменению реакционной способности мономеров и радикалов роста при образовании Н-комплексов с молекулами растворителя, изменении ионизационного состояния, а также за счет образования кинетически выгодных или невыгодных ассоциативных образований в растворах.
Экспериментальная часть
Лабораторная работа № 1
|
|



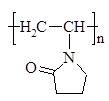



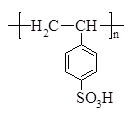


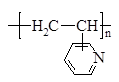

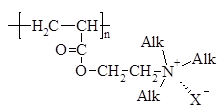
 , (1.1)
, (1.1) , (1.2)
, (1.2) , (1.3)
, (1.3) константы
константы
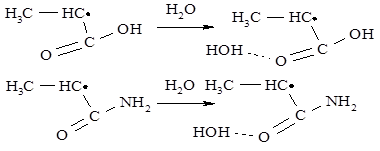
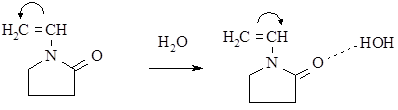
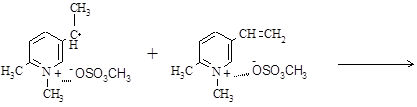
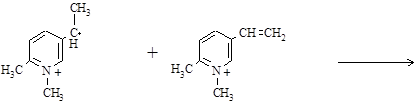
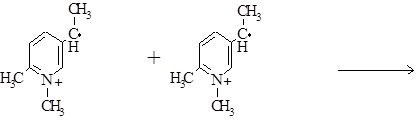
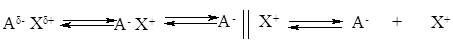
 , (1.4)
, (1.4)