|
|
Исследование кинетики полимеризацииИоногенных мономеров
Цель работы: изучение кинетических закономерностей полимеризации ионизирующихся мономеров в водном растворе дилатометрическим методом.
Оборудование и реактивы Реактивы: Мономер – 1,2-ДМ-5-ВПМС (перекристаллизованный) или N,N,N-триметилоксиэтилметакрилоиламмонийметилсульфат (ДМАЭМА*ДМС),
1,2-ДМ-5-ВПМС ДМАЭМА*ДМС Инициатор – пероксид водорода (ПВ), персульфат калия (ПК), трет.-бутилгидропероксид (ТБГП), β-оксиэтил-трет.-бутилпероксид (ОЭП), β-оксипропил-трет.- бутилпероксид (ОПП),
вода дистиллированная. Оборудование: аналитические весы (точность до 0,0001 г), набор разновесов, катетометр (КМ-6 или аналогичный), ультратермостат с точностью установки температуры
Порядок выполнения работы В ходе выполнения лабораторной работы необходимо выполнить следующие операции: Ø подготовить исходный раствор мономера, Ø подготовить реакционные смеси для полимеризации, Ø провести исследование кинетики процесса дилатометрическим методом. Для изучения кинетических закономерностей полимеризации 1,2-ДМ-5-ВПМС в водном растворе используют дилатометрический метод, основанный на измерении уменьшения объема реакционной массы, сопровождающего протекание данного процесса. Для проведения кинетических исследований предварительно готовятся водные растворы мономера ([M]исх = 1,67 – 2,78 моль/л) и инициатора ([I]исх = 0,001 – 0,1 моль/л) в соответствии с данными таблицы 1.6. Далее исходные растворы смешиваются в соотношении 9:1 об. с образованием полимеризата с концентрациями компонентов [M]0 и [I]0 (см. таблицу 1.6) Таблица 1.6 Полимеризационные рецептуры для исследования кинетики полимеризации ионогенных мономеров
Для приготовления исходных растворов инициатора навеску пероксида, взвешенную с точностью до 0,0002 г, помещают в мерную колбу на 100 мл, растворяют в небольшом количестве воды и доводят объем до метки. Навеску пероксида для приготовления раствора с концентрацией 0,1 моль/л рассчитывают по формуле:
где mи – навеска пероксида, г, Ми – молярная масса пероксида, г/моль, Си – содержание основного вещества в реактиве инициатора, масс. доли. Растворы мéньших концентраций готовятся методом последовательного разбавления. Для приготовления раствора мономера навеску 1,2-ДМ-5-ВПМС, взвешенную с точностью до 0,001 г, помещают в стакан и растворяют в 20 – 30 мл дистиллированной воды. Полученный раствор переносят в мерную колбу на 50 мл и доводят до метки, промывая стакан. Полученный раствор мономера в количестве 9 мл вносят в три чистых сухих бюкса и захолаживают в бане со льдом. После охлаждения в бюксы вносят по 1 мл растворы инициатора. Далее растворы перемешивают и вводят шприцем в предварительно взвешенные на аналитических весах дилатометры в таком количестве, чтобы высота столба жидкости в трубке дилатометра составляла 25 – 30 мм. Дилатометры помещают в баню термостата, в которой поддерживается температура 30 Контроль за ходом полимеризации осуществляют по измерению уровня реакционной смеси в дилатометре с помощью катетометра. Измерение координат уровня в начале полимеризации проводят через 1 – 2 мин (в течение 20 – 30 мин), затем через 3 – 5 мин. Общая продолжительность наблюдений должна составлять 45 – 60 мин. По окончании измерений дилатометры вынимают из бани, взвешивают и по разности масс определяют количество реакционной массы в них с помощью катетометра определяют внутренний диаметр его трубки. Степень превращения мономера в полимер рассчитывают по формуле:
где ρm – плотность раствора мономера, г/см3 (см.табл. 1.6), ∆h – изменение высоты уровня в дилатометре, см, dд – внутренний диаметр трубки дилатометра, см, m – масса раствора в дилатометре, г, cm – концентрация мономера в растворе, масс. доли (см таблицу 1.6), К – коэффициент контракции. Исходные данные и результаты расчета степени превращения заносятся в таблицу 1.7. Таблица 1.7 Измерение и расчет кинетических параметров полимеризации ионогенных мономеров дилатометрическим методом
По данным таблицы 1.7 строят графики зависимости x = f(τ) и для начального участка кинетических кривых (xн = 10 – 20 %) определяют начальную скорость полимеризации V0 по формуле:
Далее строят зависимости в координатах lgVo – lg[I]o и f1(Vo) – f2(Vo), и графическим методом определяют порядок реакции полимеризации по инициатору (ni) и соотношение констант А и В (см таблицу 1.8). Данные расчета заносят в таблицу 1.8
Таблица 1.8 Кинетические параметры полимеризации 1,2-ДМ-5-ВПМС
Исследование кинетики полимеризации дилатометрическим методом можно проводить, используя в качестве дилатометра пробирку с градуированным капилляром (1 деление = 0,001 мл). Для этого 9 мл полученного раствора мономера вносят в пробирку (дилатометр), затем пипеткой вводится 1 мл инициатора. Полученную реакционную смесь перемешивают. С помощью шприца в дилатометр вводят вакуумное масло, так чтобы уровень масла был 0,5 – 1 см. Затем в дилатометр вставляют трубку капилляра (так чтобы кончик капилляра был полностью погружен в масло). Отмечая уровень масла в капилляре, дилатометр устанавливают в термостат, в котором поддерживается температура 30 Пока раствор термостатируется масло поднимается по капилляру и его излишки отбирают шприцем. Затем уровень масла фиксируют на нулевой отметке по шкале капилляра. В течение некоторого времени, которое соответствует индукционному периоду реакции полимеризации, уровень масла остается на нулевой отметке шкалы; протеканию реакции полимеризации соответствует уменьшение уровня масла в капилляре. При проведении эксперимента снимают значения по шкале капилляра при прохождении уровня масла через каждую отметку шкалы и соответствующее этому моменту время. Таким образом снимают 10-15 значений, вынимают пробирку из термостата и охлаждают реакционную массу. Шприцем отбирают масло с поверхности полимеризата. Полимеризат смешивают с изопропиловым спиртом и количественно собирают выпавший в осадок полимер. Полимер сушат и взвешивают на аналитических весах. Определяют выход полимера φ для ряда опытов и зная конечную усадку Задание: написать схему элементарных реакций полимеризации 1,2-ДМ-5-ВПМС с учетом ионизационного состояния компонентов системы, комплексообразования, межмолекулярной ассоциации мономера и объяснить наблюдаемые кинетические закономерности. Отчет должен содержать таблицы с полученными и рассчитанными данными, графики зависимостей x = f(τ), lgVo – lg[I]o и f1(Vo) – f2(Vo).
1.3 Контрольные вопросы к разделу: “Водорастворимые полимеры. Особенности полимеризации гидрофильных мономеров.”
1. Структура молекул водорастворимых ионизирующихся мономеров, природа активных центров. 2. Особенности инициирования полимеризации ионизирующихся мономеров. 3. Влияние ионизационного равновесия на протекание элементарных реакций радикальной полимеризации. 4. Влияние межмолекулярной ассоциации молекул мономера и реологических свойств полимеризационных растворов на кинетику полимеризации. 5. Схема элементарных реакций и кинетические особенности полимеризации при обрыве растущей цепи на первичных радикалах. 2 Физико-химические свойства растворов полимеров
Изучение поведения макромолекул в растворе имеет большое значение. Высокомолекулярные соединения не существуют в газообразном состоянии и всю основную информацию о свойствах индивидуальных макромолекул, их конформациях и размерах, молекулярных массах и распределении по молекулярным массам можно получить только при изучении растворов. Знание свойств полимерных растворов необходимо также для использования полимерных материалов в растворенном состоянии или их переработки из растворов. Полиэлектролиты — обширный класс полимеров, звенья которых содержат функциональные группы (ионогенные группы), способные к электролитической диссоциации. Полиэлектролиты своеобразным образом сочетают некоторые важнейшие свойства неионогенных полимеров и низкомолекулярных электролитов. Так растворы полиэлектролитов, как и растворы других полимеров, обладают аномально высокой вязкостью и, подобно растворам простых электролитов, хорошо проводят электрический ток. В тоже время и гидродинамическое поведение, и электрохимические свойства полиэлектролитов в растворах характеризуются рядом особенностей, отличающих их как от растворов незаряженных полимеров, так и от растворов низкомолекулярных электролитов. Все специфические свойства полиэлектролитов проявляются лишь в условиях, когда их макромолекулы несут локально некомпенсированные заряды. Эти свойства, которые и обуславливают широкое применение полиэлектролитов в качестве флокулянтов, структурообразователей почв, агентов уменьшения гидравлического сопротивления в турбулентном режиме течения, в производстве бумаги для улучшения ее физико-механических свойств, при шлихтовании нитей, в основном определяются взаимодействием заряженных групп полиионов между собой и с окружающими их низкомолекулярными противоионами. Поэтому огромный интерес представляют водные растворы полиэлектролитов, в которых происходит электролитическая диссоциация соответствующих функциональных групп, входящих в состав звеньев молекулярных цепей. Различают разбавленные, концентрированные и умеренно-концентрированные растворы полимеров. Разбавленным раствором полимера называют такой раствор, в котором макромолекулы находятся друг от друга на расстояниях, значительно превышающих их собственные геометрические размеры. В разбавленном растворе имеются хорошо выраженные области, каждая из которых занята одной макромолекулой, где средняя концентрация звеньев отлична от нуля, и области, не занятые макромолекулами, в которых концентрация звеньев полимера равна нулю. Под умеренно концентрированными растворами понимают растворы, в которых содержание полимера достаточно для установления одинаковой концентрации звеньев во всем объеме раствора. К концентрированным относят растворы полимеров, в которых имеет место взаимодействие макромолекул друг с другом. Положение граничных областей между разбавленными, умеренно-концентрированными и концентрированными растворами зависит от степени полимеризации макромолекул и от природы полимера и растворителя. Особый интерес к разбавленным растворам высокомолекулярных соединений обуславливается, прежде всего, тем, что растворение полимеров в достаточно большом количестве растворителя является единственным способом диспергирования их до молекулярного уровня. Только в разбавленных растворах, когда расстояние между макромолекулами сравнительно велико, появляется возможность определения так называемых макромолекулярных характеристик полимера (размеры и форма макромолекулы, способность ее изменять свою форму и т.д.). По имеющимся представлениям, в разбавленном растворе длинная гибкая макромолекула сворачивается в так называемый статистический клубок, возникающий как наиболее вероятная конформация в результате внутримолекулярного движения у многих полимеров. Существует две точки зрения на поведение таких клубков при течении. Согласно первой точке зрения, клубок рассматривается как образование, через которое свободно проникают молекулы растворителя. Это означает, что движение среды не зависит от движения сегментов или что каждый сегмент испытывает такое трение в окружающей среде, как если бы других сегментов не было. Вторая точка зрения сводится к тому, что макромолекула, свернутая в клубок, удерживает внутри себя определенное количество растворителя и движется вместе с этим растворителем. Такой клубок представляет собой как бы непроницаемую для остальной массы растворителя сферическую частицу с эффективным радиусом Re (радиус сферы набухшего клубка). Макромолекулярные клубки могут двигаться относительно молекул растворителя поступательно. Это движение может быть хаотическим (броуновское движение), направленным (диффузия), или движение в центробежном поле (седиментация). Энергия, рассеиваемая в форме теплоты в процессе течения жидкости, оценивается характеристической вязкостью [η]. Как известно, растворы полимеров обладают более высокой вязкостью по сравнению с низкомолекулярными жидкостями. Это происходит потому, что даже в разбавленном растворе макромолекула, находясь в ламинарном потоке растворителя, разными своими частями оказывается в слоях, движущихся с различными скоростями. В результате молекулярный клубок испытывает действие момента сил, который заставляет его вращаться в потоке, что приводит к дополнительной затрате энергии.Снижение вязкости с увеличением напряжения или градиента скорости объясняется разворачиванием молекулярных клубков и их взаимной ориентацией в потоке, которая нарушается тепловым движением. Поэтому степень ориентации зависит от соотношения интенсивности теплового движения и величины приложенного напряжения или градиента скорости. Чем больше градиент скорости, тем меньше роль теплового движения, тем больше ориентация и тем меньше вязкость. Когда макромолекулы полностью ориентированы, вязкость раствора перестает меняться с напряжением сдвига, т.е. наблюдается течение с наименьшей ньютоновской вязкостью. Для исследования гидродинамических свойств полимеров в разбавленных растворах наиболее часто применяется метод вискозиметрии как один из самых простых в аппаратурном оформлении. Этот метод позволяет получить такие важные характеристики макромолекул как молекулярная масса, размеры, коэффициент набухания макромолекулярного клубка, степень полидисперсности макромолекул. Как известно, вязкость (внутреннее трение жидкости) обусловлена взаимодействием молекул жидкости и проявляется при ее течении. Рассмотрим модель слоистого течения жидкости. Течение жидкости в капилляре диаметром x характеризуется градиентом скорости dv/dx вследствие того, что молекулярный слой, непосредственно примыкающий к стенке капилляра, остается неподвижным, а слой находящийся в центре капилляра, движется с максимальной скоростью. Ламинарное течение жидкости описывается законом Ньютона, согласно которому напряжение сдвига t, вызывающее течение жидкости, пропорционально градиенту скорости течения:
Коэффициент пропорциональности h называется динамическим коэффициентом вязкости или просто динамической вязкостью с размерностью Па·с. Кинематическая вязкость есть отношение динамической вязкости к плотности раствора:
Размерность кинематической вязкости м2/с, см2/с. Измерение вязкости жидкостей проводят чаще всего в капиллярных вискозиметрах. Оно основано на использовании уравнения Пуазейля, которое, в свою очередь, выведено из закона Ньютона:
где Q– количество жидкости, протекающей через капилляр за время t, r, l– радиус и длина капилляра соответственно, ∆P– разность давлений на концах капилляра. Если жидкость течет под действием собственного веса, то:
где ρ – плотность жидкости, g– ускорение свободного падения. Решая уравнение (2.3) относительно η, получим:
где Параметр К называется постоянной вискозиметра и находится по времени истечения жидкости с известной вязкостью и плотностью. При исследовании разбавленных растворов полимеров определяют обычно не абсолютную, а относительную вязкость, т.е. отношение вязкости раствора полимера η к вязкости чистого растворителя η0. Это отношение равно
где t и t0 – времена истечения соответственно раствора и чистого растворителя (при условии, что плотности разбавленного раствора полимера и чистого растворителя практически совпадают). Отношение Зависимость приведенной вязкости от концентрации раствора полимера описывается уравнением Хаггинса:
где К΄- константа Хаггинса, характеризующая взаимодействие макромолекул в данном растворителе. В хороших растворителях К΄ = 0,2-0,3, в плохих – К΄ ≥ 0,5. Уравнение Хаггинса справедливо для незаряженных полимеров, приведенная вязкость которых ηпр линейно убывает с уменьшением концентрации раствора, стремясь при экстраполяции к своему пределу– характеристической вязкости [η] (см. рис. 2.1, график 1). Для растворов ионизированных макромолекул при низких ионных силах зависимость приведенной вязкости от концентрации раствора аномальна: их приведенная вязкость с уменьшением концентрации полиэлектролита нелинейно возрастает (см. рис. 2.1, график 2). Это делает невозможным определение характеристической вязкости раствора полиэлектролита путем экстраполяции измеренной в таких условиях приведенной вязкости к нулевой концентрации полимера. Для определения характеристической вязкости водных растворов полиэлектролитов Фуоссом было предложено следующее уравнение:
где В – константа, характеризующая взаимодействие макромолекул в воде. Подставляя в данное уравнение значения C и ηуд (определенные методом вискозиметрии), строят график зависимости C/ηуд от C1/2, который имеет прямолинейный характер, и экстраполируют его к нулевому значению C1/2. Величина отрезка, отсекаемого прямой на оси C/ηуд, обратно пропорциональна характеристической вязкости раствора полиэлектролита в воде.
Рис. 2.1 Зависимость приведенной вязкости от концентрации полимера Возрастание приведенной вязкости при разбавлении раствора полиэлектролита вызвано так называемым полиэлектролитным набуханием, т.е. увеличением объема и соответственно линейных размеров макромолекулярных клубков из-за увеличения электростатического отталкивания одноименно заряженных звеньев цепи. При разбавлении раствора полиэлектролита ионная сила раствора, создаваемая самим полиэлектролитом, уменьшается. По мере разбавления все большее количество компенсирующих низкомолекулярных противоионов уходит из объема заряженного макромолекулярного клубка, образуя вокруг него диффузный слой, расширяющийся с разбавлением. Эффективный заряд макромолекул соответственно возрастает, что и приводит к дополнительному набуханию полиэлектролитных клубков. Следует отметить, что удельная вязкость раствора полиэлектролита при разбавлении уменьшается. Возрастает именно приведенная вязкость, которая, как и характеристическая вязкость, пропорциональна эффективному объему, занимаемому полиионом в растворе. Полиэлектролитное набухание можно устранить путем введения в исходный раствор некоторого избытка нейтрального низкомолекулярного полиэлектролита или путем поддержания постоянной ионной силы раствора при разбавлении. Тогда концентрация компенсирующих противоионов в молекулярных клубках не изменяется при разбавлении, и полиэлектролит в растворе ведет себя как незаряженный полимер: приведенная вязкость линейно уменьшается с уменьшением концентрации. Аналогичное поведение обнаруживает полиэлектролит в растворителях с относительно низкой диэлектрической проницаемостью, в которых электролитическая диссоциация практически полностью подавлена. Полиэлектролит в растворе ведет себя как незаряженный полимер: приведенная вязкость линейно уменьшается с уменьшением концентрации, и зависимость ηпр от концентрации раствора описывается уравнением Хаггинса. Полиэлектролитное набухание полимера оценивается коэффициентом полиэлектролитного набухания γ, который определяется отношением характеристической вязкости водного раствора полимера [ηв] к характеристической вязкости водно-солевого раствора полимера [ηc].
Полиэлектролитное набухание наблюдается также при изучении зависимости вязкости раствора слабого полиэлектролита от рН или от степени ионизации. Рассмотрим разбавленные водные растворы слабых низкомолекулярных кислот вида Н+А- с одной ионогенной группой, у которых степень диссоциации где Ка – константа ионизации; С – концентрация. При этом принимается, что заряды равномерно распределены по всему объему раствора. В таких системах ионная сила раствора слабо влияет на Ка и соответствующие коэффициенты активности можно записать как: или Логарифмируя, находим: или откуда: Приняв во внимание, что: и подставив эту величину в уравнение (2.15), получаем: При переходе к типичному представителю слабых полимерных электролитов, например полиметакриловой кислоте, каждый мономерный остаток которой содержит одну группу СООН, картина значительно осложняется. В результате диссоциации этой кислоты в водном растворе образуется полианион и ионы водорода; степень диссоциации ее где n– число ионогенных карбоксильных групп, равное степени полимеризации; z – общий заряд макроиона. В этом случае α и z фактически являются средними величинами, так как в растворе будут находиться частицы со всеми промежуточными степенями ионизации, начиная от недиссоциированных и кончая полностью ионизированными. Кроме того, на диссоциацию каждой ионогенной группы влияют все остальные, и наблюдаемая величина α будет зависеть от большого числа различных констант диссоциации (каждая группа СООН имеет свою собственную константу). Также необходимо учесть, что даже в случае сильных полимерных электролитов и очень больших разбавлений заряды распределены по объему раствора неравномерно. В результате появляются участки с повышенной плотностью зарядов, и у макроиона возникает электростатический потенциал ψ, предопределяющий все специфические свойства полиэлектролита. В уравнении (2.15) появляется ещё один член, где К0 – характеристическая константа группы СООН, связанная с отщеплением первого протона. При добавлении кислоты (или щелочи) к слабому полиоснованию (или слабой поликислоте) образуется полисоль, которая хорошо диссоциирована в водном растворе. Поэтому по мере нейтрализации увеличивается число одноименных зарядов в цепи, между ними возникают силы электростатического отталкивания, приводящие к тому, что конформации полиэлектролитных клубков становятся более вытянутыми. Изменение конформации сопровождается увеличением вязкости раствора в десятки и сотни раз. Максимальное разворачивание наблюдается не в точке полной нейтрализации, а при α = 0,5-0,8. При более высоких значениях α вязкость уменьшается, что объясняется повышением ионной силы раствора и экранированием зарядов в цепи. Повышение ионной силы приводит к подавлению полиэлектролитного набухания. Поэтому максимум на кривых зависимости приведенной вязкости от рН снижается при повышении концентрации полиэлектролита или при введении в раствор низкомолекулярных солей. Вязкость раствора полимера зависит от качества растворителя, т.е. от его термодинамического сродства к полимеру. Впервые на это было обращено внимание Элфри и Марком. Макромолекулярный клубок в различных растворителях набухает по-разному. Чем лучше качество растворителя, тем он больше набухает, тем больше его размеры, тем больше гидродинамическое сопротивление потоку он оказывает, тем больше [η]. Поэтому обычно размеры молекул изучают в θ-растворителях, в которых макромолекулы не взаимодействуют с молекулами растворителя, и оцениваются величиной среднеквадратичного расстояния где М – молекулярная масса полимера, Φ0 – универсальная вискозиметрическая постоянная для всех полимеров. В зависимости от того, в каких единицах выражена [η] (мл/г или дл/г) Φ0 соответственно равна 2,84·1023 или 2,84·1021. Размер клубка в неидеальном растворителе в β3, раз больше, чем в θ-растворителе. Поэтому для неидеальных растворителей: Для гибкоцепных полимеров справедливо уравнение Штокмайера–Фиксмана: где Kθ – постоянная, которая определяется в θ-растворителе, М – молекулярная масса полимера, Φ0 – универсальная вискозиметрическая постоянная, В – величина, связанная с параметром взаимодействия χ1 уравнением: где V1 - парциальный мольный объем растворителя, NA – число Авогадро. Уравнение (2.22) может быть записано в форме: Если построить графическую зависимость [η]/Μ1/2 от M1/2, то получим прямую линию, отсекающую на оси ординат отрезок, равный Kθ, из наклона которой можно определить величину В, а затем χ1. Таким образом, параметр взаимодействия полимера с растворителем можно определить из измерения характеристической вязкости. Зависимость характеристической вязкости от молекулярной массы полимера обычно выражают эмпирическим уравнением Марка-Хаувинка-Куна: где К и а – постоянные. В уравнении (2.25) а - составляет 0,6-0,8 и зависит от гибкости цепи полимера и его взаимодействия с растворителем. Уравнение (2.25) можно вывести теоретически на основании модели непроницаемых для растворителя невзаимодействующих молекулярных клубков. Причем для клубков, обтекаемых растворителем, согласно теории, характеристическая вязкость пропорциональна М1/2, а для клубков, через которые молекулы растворителя проникают свободно, она пропорциональна М в первой степени. В действительности, а меняется от 0,6 до 1. Расхождение теории с опытом объясняется объемным эффектом, т.е. тем, что реальный клубок в β раз больше идеального. Отсюда: В идеальном растворителе при β= 1 характеристическая вязкость определяется по уравнению: Очевидно, что для расчета молекулярной массы полимера по формуле (2.25) необходимо предварительное определение констант. Поэтому вискозиметрический метод определения молекулярной массы является лишь относительным. Константы К и а находят, представив уравнение Марка-Хаувинка-Куна в логарифмической форме: Молекулярные массы серии узких фракций полимера определяют с помощью какого-либо абсолютного метода (осмометрии, светорассеяния и др.). Из линейной зависимости (2.28) находят К и а.
Экспериментальная часть
Лабораторная работа № 2.
|
|
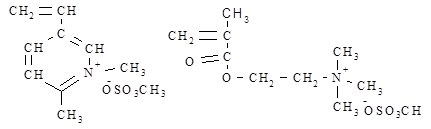
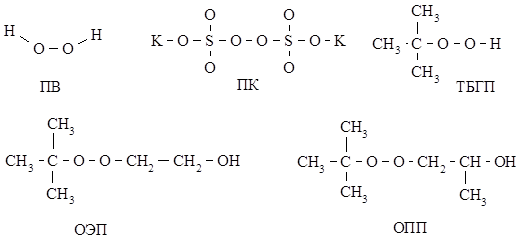
 0,1 оС, секундомер, дилатометр шариковый – 3 шт, колбы мерные на 100 мл – 3 шт, на 50 мл – 1 шт, на 25 мл – 1 шт, химический стаканчик на 50 мл – 1 шт, бюксы емкостью 10 мл – 3 шт, шприц стеклянный, объем 5 – 10 мл (со стальной иглой), пипетки стеклянные градуированные на 5мл – 1 шт, на 1 мл – 1 шт, ледяная баня.
0,1 оС, секундомер, дилатометр шариковый – 3 шт, колбы мерные на 100 мл – 3 шт, на 50 мл – 1 шт, на 25 мл – 1 шт, химический стаканчик на 50 мл – 1 шт, бюксы емкостью 10 мл – 3 шт, шприц стеклянный, объем 5 – 10 мл (со стальной иглой), пипетки стеклянные градуированные на 5мл – 1 шт, на 1 мл – 1 шт, ледяная баня. , (1.5)
, (1.5) , (1.6)
, (1.6) , (1.7)
, (1.7)
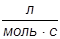




 , объем раствора V, строят зависимость φ = f
, объем раствора V, строят зависимость φ = f  , (2.1)
, (2.1)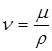 , (2.2)
, (2.2) , (2.3)
, (2.3) , (2.4)
, (2.4)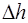 – высота столба жидкости в приборе,
– высота столба жидкости в приборе, , (2.5)
, (2.5)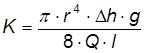 .
. , (2.6)
, (2.6)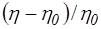 показывает относительный прирост вязкости вследствие введения в растворитель полимера и называется удельной вязкостью ηуд, отношение ηуд/С– приведенной вязкостью ηпр и lim ηпр при концентрации полимера (С) стремящейся к нулю называется характеристической вязкостью [η].
показывает относительный прирост вязкости вследствие введения в растворитель полимера и называется удельной вязкостью ηуд, отношение ηуд/С– приведенной вязкостью ηпр и lim ηпр при концентрации полимера (С) стремящейся к нулю называется характеристической вязкостью [η].  Характеристическая вязкость определяет поведение изолированных макромолекул. Она представляет собой меру потерь энергии на трение изолированных макромолекул о растворитель при их вращении в результате поступательного движения в потоке с градиентом скорости, отличным от нуля. Характеристическая вязкость зависит от размеров макромолекул в растворе, от природы растворителя и температуры раствора и может быть использована в качестве критерия перехода от разбавленного к умеренно-концентрированному раствору. Значение [η] пропорционально объему макромолекулярного клубка, поэтому раствор можно считать разбавленным, если для него С«1/[η]. Последнее неравенство означает, что объем раствора, занятый макромолекулами, значительно меньше общего объема раствора. Раствор считают умеренно концентрированным при условии С~1/[η] и концентрированным – при с »1/[η].
Характеристическая вязкость определяет поведение изолированных макромолекул. Она представляет собой меру потерь энергии на трение изолированных макромолекул о растворитель при их вращении в результате поступательного движения в потоке с градиентом скорости, отличным от нуля. Характеристическая вязкость зависит от размеров макромолекул в растворе, от природы растворителя и температуры раствора и может быть использована в качестве критерия перехода от разбавленного к умеренно-концентрированному раствору. Значение [η] пропорционально объему макромолекулярного клубка, поэтому раствор можно считать разбавленным, если для него С«1/[η]. Последнее неравенство означает, что объем раствора, занятый макромолекулами, значительно меньше общего объема раствора. Раствор считают умеренно концентрированным при условии С~1/[η] и концентрированным – при с »1/[η]. , (2.7),
, (2.7),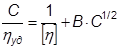 , (2.8),
, (2.8),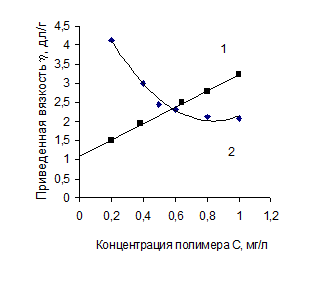
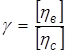 , (2.9)
, (2.9) , (2.10)
, (2.10) , (2.11)
, (2.11) , (2.12)
, (2.12) , (2.13)
, (2.13)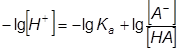 , (2.14)
, (2.14) (2.15)
(2.15) , (2.16)
, (2.16)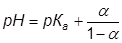 ,(2.17)
,(2.17) , (2.18)
, (2.18) , учитывающий дополнительную работу диссоциации ионогенной группы против электростатического поля ранее ионизированных групп:
, учитывающий дополнительную работу диссоциации ионогенной группы против электростатического поля ранее ионизированных групп: (2.19),
(2.19), . Флори вывел зависимость между этой величиной и характеристической вязкостью раствора:
. Флори вывел зависимость между этой величиной и характеристической вязкостью раствора: , (2.20)
, (2.20) , (2.21)
, (2.21) , (2.22),
, (2.22), , (2.23),
, (2.23), – удельный объем полимера,
– удельный объем полимера, , (2.24)
, (2.24)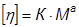 , (2.25),
, (2.25), , (2.26),
, (2.26), , (2.27),
, (2.27), , (2.28),
, (2.28),