|
|
Загальні положення. Тепловий ефект реакції
При хімічних перетвореннях відбувається зміна хімічних зв'язків, що призводить до перерозподілу енергії між молекулами. Загальним результатом такого перерозподілу енергії в системі під час хімічної реакції є виділення або поглинання теплоти. Вивченням теплот хімічних реакцій займається термохімія. В коло її задач входять: експериментальне визначення теплових ефектів, їх порівняння і систематика, а також установлення закономірностей, що дозволяють визначити теплові ефекти процесів, в яких їх експериментальне визначення неможливе. Термохімія має як теоретичне, так і практичне значення. Знання теплових ефектів необхідне для розрахунків хімічних рівноваг, а в технологічній практиці теплові ефекти потрібні при складанні теплових балансів металургійних процесів. З першого закону термодинаміки випливає, що для ізохорних процесів QV = DU (1.4), а для ізобарних процесів Qp = DН (1.6). Таким чином, тепловим ефектом реакції називається зміна ентальпії при сталому тиску або внутрішньої енергії при сталому об'ємі системи, розрахована на стехіометричні кількості реагуючих речовин. Зміну ентальпії називають ізобарним тепловим ефектом реакції (DН), а зміну внутрішньої енергії – ізохорним тепловим ефектом (DU). Співвідношення між ними описуються рівняннями: DН = DU + PDV; DH = DU + DnRT, де Dn = n2 – n1 – зміна числа моль газоподібних речовин в реакції; n1 і n2 – число моль початкових та кінцевих газів; R – універсальна газова стала, Дж/(моль×К); Т – температура, при якій протікає реакція, К. Для систем, в яких реагують лише конденсовані (тверді і рідкі) речовини, зміна об'єму мала, РDV ® 0 і DН » DU. При 0 К DnRT = 0 і DHo = DUo. Тепловий ефект реакції залежить від природи і агрегатного стану реагуючих речовин та температури. Часто користуються стандартним тепловим ефектом реакції - Якщо реакція протікає з виділенням теплоти, її називають екзотермічною. Для неї DН < 0. Якщо ж реакція супроводжується поглинанням теплоти, її називають ендотермічною. Для ендотермічних реакцій DН > 0. Тепловий ефект і теплота реакції не завжди співпадають. Дійсно, для ізобарно-ізотермічного процесу можна записати такі рівності:
Таким чином, тільки при умовах, коли корисна робота процесу W' дорівнює нулю, тепловий ефект і теплота процесу співпадають. Якщо ж W' ¹ 0, DН ¹ Qр. В термохімії користуються так званими термохімічними рівняннями. Це рівняння хімічних реакцій з обов'язковим наведенням величин теплових ефектів, наприклад
З огляду на те, що теплові ефекти реакцій залежать від агрегатного стану і кристалічної модифікації реагуючих речовин, в термохімічних рівняннях необхідно приводити відповідні вказівки. З термохімічними рівняннями можна проводити різні математичні вправи (додавання, віднімання і т.д.). Такі ж математичні вправи здійснюють і з величинами теплових ефектів реакцій.
Закон Гесса. Визначення стандартних теплових ефектів Хімічних реакцій
Термохімія базується на двох законах – Гесса і Кірхгофа. Г.Гесс у 1836 році, ще до того, як було сформульоване перше начало термодинаміки, відкрив основний закон термохімії, названий законом сталості сум теплоти: тепловий ефект хімічної реакції не залежить від шляху реакції (від проміжних реакції), а залежить лише від виду та стану початкових і кінцевих речовин. Слід зазначити, що це формулювання має сенс тільки за умов, що хімічна реакція здійснюється при сталих тиску або об'єму, коли незалежність від шляху процесу може бути розповсюджена і на теплоти процесу. Проілюструємо закон Гесса на реакціях відновлення оксидів заліза до заліза оксидом вуглецю (ІІ), що відбуваються у доменному процесі. Відновлення оксиду заліза (ІІІ) можливе як безпосередньо до заліза, так і через проміжну стадію утворення оксиду заліза (ІІ). Наведемо схему процесів.
Початковий стан Кінцевий стан
Проміжний стан Fe2O3+CO=2FeO+CO2+DH2 2FeO+2CO=2Fe+2CO2+DH3
Перший шлях: Fe2O3 + 3CO = 2Fe + 3CO2 + DH1, DH1 = -26,78 кДж. Другий шлях: Fe2O3 + CO = 2FeO + CO2 + DH2, DH2 = 9,48 кДж; 2FeO + 2CO = 2Fe + 2CO2 + DH3, DH3 = -36,26 кДж. При складанні реакцій другого шляху, одержуємо термохімічну реакцію Fe2O3 + 3CO = 2Fe + 3CO2 + DH2 + DH3, яка тотожна реакції, що здійснена першим шляхом. Отже і теплові ефекти реакцій однакові. Тому можна записати DH1 = DH2 + DH3, що підтверджується чисельними розрахунками. Дійсно, -26,78 = 9,48 + (-36,26) = -26,78. Закон Гесса має велике значення, бо дозволяє визначити теплові ефекти реакцій без їх експериментального проведення. Це особливо важливо для реакцій, що не проходять однозначно і до кінця, а також для реакцій, що відбуваються в умовах високих температур і тисків. В таких випадках користуються законом Гесса і його наслідками, основними з яких є такі: - Теплові ефекти прямої і зворотної хімічних реакцій однакові за величиною та протилежні за знаком DНпр. = -DНзв.(3.1) Проілюструємо цей наслідок на прикладі реакції, що відбувається при корозії заліза: пряма реакція 3Fe + 2O2 = Fe3O4 + DНпр.; зворотна реакція Fe3O4 = 3Fe + 2O2 + DНзв.. При складанні рівнянь реакцій, одержуємо: DНпр. + DНзв. = 0, тобто DНпр. = -DНзв. Наступні наслідки з закону Гесса дозволяють обчислити стандартні теплові ефекти реакцій, користуючись деякими термодинамічними характеристиками, величини яких відомі. - Стандартний тепловий ефект хімічної реакції дорівнює алгебраїчній сумі стандартних теплот утворення кінцевих речовин (продуктів) мінус алгебраїчна сума стандартних теплот утворення початкових (вихідних) речовин, тобто
де ni – кількість моль і-ої речовини (стехіометричний коефіцієнт перед даною речовиною в рівнянні реакції); Теплотою утворення сполуки називається тепловий ефект реакції утворення одного моль даної сполуки з відповідних простих речовин (але не атомів). Наприклад, теплоти реакцій С + О2 = СО2 і 2Fe + 3/2 O2 = Fe2O3 є теплотами утворення СО2 і Fe2O3, а теплоти реакцій СО + ½ О2 = СО2 і Fe + O = FeO не є теплотами утворення СО2 і FeO, бо СО – складна речовина, а О – атом кисню. Звичайно користуються стандартними теплотами утворення речовин Тепловий ефект реакції Fe3O4 + 4CO = 3Fe + 4CO2, визначений за допомогою стандартних теплот утворення реагуючих речовин, складатиме
Велике значення має наступний наслідок з закону Гесса, який дозволяє визначити стандартний тепловий ефект реакції шляхом алгебраїчного підсумовування рівнянь допоміжних реакцій, стандартні теплові ефекти яких відомі. - Правило: якщо Х = ±mI ±nII ±… ±iI,(3.3) то де Х – основна (базова) реакція, для якої треба визначити стандартний тепловий ефект При розрахунках за цим правилом треба виконати наступні умови: - підібрати допоміжні реакції. Їх вибирають таким чином і стільки, щоб речовини базової реакції зустрічались в допоміжних реакціях мінімум раз, а речовини, що не входять до базового рівняння, повинні зустрічатись в допоміжних реакціях мінімум двічі. Звичайно прагнуть брати найменшу кількість допоміжних реакцій (оптимально – дві); - підібрати для кожної допоміжної реакції індикатор – речовину, що міститься в даній допоміжній і в базовій реакціях, але відсутня в інших допоміжних реакціях; - підібрати для кожної допоміжної реакції знаки за правилом: якщо індикатор в допоміжній і базовій реакціях знаходиться по один бік від знаку рівності, то беруть знак плюс, а якщо по різні боки – знак мінус; - підібрати коефіцієнти для кожної допоміжної реакції за правилом: коефіцієнт визначається діленням стехіометричного коефіцієнту перед індикатором базового рівняння реакції на стехіометричний коефіцієнт перед індикатором допоміжної реакції; - провести перевірку правильності виконання приведених вище умов. Якщо перевірка позитивна (тобто в результаті алгебраїчного підсумовування допоміжних реакцій за рівнянням (3.3) одержуємо базове рівняння), то розраховують Закон Гесса дозволяє визначити лише стандартні теплові ефекти реакцій. Щоб визначити за законом Гесса теплові ефекти при будь-якій температурі бракує даних. У цьому разі користуються законом Кірхгофа.
|
|
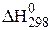 . Це тепловий ефект реакції при стандартних умовах: Т = 298 К, Р = 1,013×105 Па. Вважають також, що реакція протікає з участю речовин, стійких за даних умов. Стандартні теплові ефекти багатьох реакцій визначені і наводяться в довідниках (табл. Д.3). В системі одиниць СІ за одиницю вимірювання теплового ефекту реакції взято джоуль (Дж).
. Це тепловий ефект реакції при стандартних умовах: Т = 298 К, Р = 1,013×105 Па. Вважають також, що реакція протікає з участю речовин, стійких за даних умов. Стандартні теплові ефекти багатьох реакцій визначені і наводяться в довідниках (табл. Д.3). В системі одиниць СІ за одиницю вимірювання теплового ефекту реакції взято джоуль (Дж). ;
; ;
;  .
. ,
,  кДж.
кДж. Fe2O3 + 3CO = 2Fe + 3CO2 + DH1
Fe2O3 + 3CO = 2Fe + 3CO2 + DH1 , (3.2)
, (3.2) - стандартна теплота утворення і-ої речовини, кДж/моль.
- стандартна теплота утворення і-ої речовини, кДж/моль. , які для багатьох сполук визначені і наводяться у довідниках (табл. Д.2). Для простих речовин (С, Fe, Cu, Mn, O2, H2 тощо) стандартні теплоти утворення дорівнюють нулю. За одиницю вимірювання теплот утворення в системі СІ взято Дж/моль (кДж/моль).
, які для багатьох сполук визначені і наводяться у довідниках (табл. Д.2). Для простих речовин (С, Fe, Cu, Mn, O2, H2 тощо) стандартні теплоти утворення дорівнюють нулю. За одиницю вимірювання теплот утворення в системі СІ взято Дж/моль (кДж/моль).
 ,(3.4)
,(3.4) ; І, ІІ, …, І – допоміжні реакції, стандартні теплові ефекти яких відомі
; І, ІІ, …, І – допоміжні реакції, стандартні теплові ефекти яких відомі  і т.д.; m, n, …, i – коефіцієнти, що підбираються до кожної з допоміжних реакцій.
і т.д.; m, n, …, i – коефіцієнти, що підбираються до кожної з допоміжних реакцій. за рівнянням (3.4).
за рівнянням (3.4).