|
|
Характеристичні функції. Умови рівноваги
Розглянуті у попередніх розділах чотири функції стану системи U, H, G і F називаються термодинамічними потенціалами, оскільки, як всякий потенціал, вони є рушійною силою процесу. При будь-яких умовах оборотного процесу робота отримується за рахунок зменшення відповідного потенціалу. При хімічному процесі будь-який з потенціалів зменшується. Після закінчення хімічної реакції, коли настає стан рівноваги, термодинамічні потенціали набувають мінімальних значень. Таким чином вони можуть служити мірою хімічних процесів. При необоротному (самодовільному) перебігу хімічних реакцій зменшення термодинамічних потенціалів таке ж саме, як і при оборотних, бо як функції стану вони не залежать від шляху процесу. Тому значення зміни цих функцій, розраховані на основі вивчення оборотних процесів, можуть бути використані для кількісної характеристики хімічних реакцій, що перебігають в металургійних процесах. У вигляді повних диференціалів функції U, H, G і F можуть бути записані так: dU = TdS – PdV, де U = f(S,V); dH = TdS + VdP, де H = f(S,P); dG = -SdT + VdP, де G = f(P,Т); dF = -SdT – PdV, де F = f(V,T). Ці вирази утворюють замкнену групу, в якій дві пари змінних – Т і S (параметри, пов'язані з теплотою) та Р і V (параметри, пов'язані з роботою) дають всі можливі варіації. В залежності від характеру досліджуваного процесу може бути використана та чи інша функція. На рис. 5.2(а) наведені співвідношення між найважливішими термодинамічними функціями, що були нами розглянуті. За допомогою вказаних функцій, а також часткових похідних цих функцій, взятих за відповідними двома параметрами (з чотирьох: P, T, V і S), може бути виражена будь-яка термодинамічна властивість системи. Тому вказані функції (термодинамічні потенціали) називають ще характеристичними функціями. На рис. 5.2(б) показаний взаємозв'язок характеристичних функцій з їх природними параметрами. З цієї схеми видно, що характеристичними функціями можуть бути не лише чотири термодинамічні потенціали (U, H, G і F), але і параметри T, P, S і V, якщо їх виразити як функції інших величин, наприклад P = f(H,S), V = f(U,S) тощо. Таким чином, термодинамічні потенціали і ентропія, як характеристичні функції, можуть бути критеріями напрямку хімічних процесів і рівноваги. Так, умови рівноваги можуть бути записані у вигляді перших і других похідних цих функцій: (¶U)V,S = 0, (¶2U)V,S > 0: (¶H)Р,S = 0, (¶2H)Р,S > 0; (¶G)P,T = 0, (¶2G)P,T > 0; (¶F)V,T = 0, (¶2F)V,T > 0; (¶S)U,V = 0, (¶2S)U,V < 0.
а в Рис. 5.2. Співвідношення між основними термодинамічними функціями (а) і схема взаємозв'язку характеристичних функцій та їх природних параметрів (б)
На основі цього можна сформулювати умови рівноваги системи: в стані рівноваги її термодинамічні потенціали мають мінімальні значення при сталості своїх природних змінних, а ентропія має максимальне значення при сталості внутрішньої енергії та об'єму системи.
5.3. Хімічна спорідненість як критерій спрямованості самодовільних процесів. Стандартна хімічна спорідненість
Хімічна спорідненість – це здатність речовин реагувати між собою. Раніше за міру хімічної спорідненості приймали тепловий ефект реакції (DН). За принципом Бертло-Томсона самодовільно можуть протікати лише екзотермічні реакції (DН < 0). Пізніше було показано, що самодовільно можуть перебігати і ендотермічні реакції (DН > 0). Зараз за міру хімічної спорідненості приймають зміну ізобарно-ізотермічного термодинамічного потенціалу - DG (DG часто називають ізобарним потенціалом реакції). Як вже вказувалось, у системах де температура і тиск сталі, самодовільно можуть протікати процеси,які супроводжуються зменшенням ізобарного потенціалу системи, тобто такі, для яких DG < 0. Якщо DG > 0, то пряма реакція самодовільно не протікає (самодовільно протікає зворотна реакція). Умовою рівноваги є досягнення деякого мінімального значення ізобарного потенціалу (DG = 0). З рівняння Гіббса-Гельмгольца DG = DН - ТDS випливає, що DG залежить не тільки від теплового ефекту реакції, але й від температури та зміни ентропії процесу. Вант-Гофф показав, що DG залежить також від вихідних та кінцевих (рівноважних) тисків реагуючих речовин. Згідно з рівнянням ізотерми реакції Вентгоффа
або
де Рвих.,і і Ррівн.,і – вихідні та рівноважні (кінцеві) тиски реагуючих речовин; Кр – константа рівноваги реакції. Початкові (вихідні) тиски (концентрації) реагуючих речовин для однієї і тої ж реакції можуть бути різні. Отже і DG буде мати різне значення. Це не зручно, бо не дозволяє порівнювати хімічну спорідненість різних реакцій. Тому звичайно користуються стандартною хімічною спорідненостю
Визначається
|
|


 , (5.6)
, (5.6) . Це хімічна спорідненість реакцій за умов, коли початкові тиски (концентрації) кожної з вихідних речовин дорівнюють одиниці. Тоді D
. Це хімічна спорідненість реакцій за умов, коли початкові тиски (концентрації) кожної з вихідних речовин дорівнюють одиниці. Тоді D 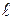 nРвих.,і = 0 і рівняння Вант-Гоффа приймає вигляд
nРвих.,і = 0 і рівняння Вант-Гоффа приймає вигляд . (5.7)
. (5.7) в джоулях.
в джоулях.