|
|
Зміщення стану рівноваги. Принцип Ле-ШательєРівновага є динамічним процесом, бо вона зумовлена одночасним протіканням процесів у двох протилежних напрямах з однаковою швидкістю. Зміна одного з факторів, що визначають рівноважний стан, порушує рівновагу. Згодом система самодовільно, без затрати роботи, переходить з нерівноважного стану в рівноважний. Напрямок переходу системи з нерівноважного стану в рівноважний, тобто зміщення рівноваги залежно від зміни зовнішніх умов, визначається принципом Ле-Шательє: якщо змінити одну з умов, при яких система перебуває в стані рівноваги, то рівновага зміщується в напрямі того процесу, який протидіє зробленій зміні. При підвищенні температури рівновага зміщується в бік процесу, що протікає з поглинанням теплоти, а при зниженні температури – в бік процесу, що протікає з виділенням теплоти. При збільшенні тиску рівновага зміщується в бік меншого об'єму, тобто в бік утворення меншого числа моль газів, а при зменшенні тиску – в бік утворення більшого числа моль газів. При збільшенні концентрації однієї з початкових (вихідних) речовин рівновага зміщується в бік утворення кінцевих речовин (продуктів), а при зменшенні концентрації вихідної речовини – в бік утворення початкових речовин. Наприклад, для реакції одержання карбіду заліза 3Fe(т) + 2СО(г) = Fe3C(т) + СО2(г), що проходить з виділенням теплоти ( Для реакції одержання міді 2Cu2O(т) + Cu2S(т) = 6Сu(т) + SO2(г), що відбувається з поглинанням теплоти ( Якщо число моль газоподібних речовин у вихідних і кінцевих речовин однакове, зміна тиску не призведе до зміщення рівноваги реакції.
Залежність константи рівноваги від температури. Рівняння ізобари реакції Принцип Ле-Шательє дозволяє лише якісно судити про вплив температури на зміщення рівноваги реакції. Визначити вплив температури на величину константи рівноваги можна за рівнянням ізобари, яке було ваідкрите Гіббсом у 1879 році і знайшло широке застосування завдяки працям Вант-Гоффа. Це рівняння виражає залежність константи рівноваги від температури при сталому тиску і має вигляд
де DНт – тепловий ефект реакції, Дж; Т – температура, К; R – універсальна газова стала, Дж/(моль×К); Кр – константа рівноваги реакції. З рівняння ізобари виходить, що вплив температури на величину константи рівноваги залежить від знака і величини теплового ефекту реакції. Дійсно, якщо реакція проходить з поглинанням теплоти (DН > 0), то підвищення температури супроводжується збільшенням величини константи рівноваги. Для екзотермічних реакцій (DН < 0) підвищення температури приводить до зменшення константи рівноваги. Якщо DН = 0, температура на величину константи рівноваги не впливає (рис. 6.1).
Рис. 6.1. Залежність температури: 1. DН>0; 2. DН=0; температури 3. DН<0
Для практичних кількісних обчислень треба знати величини констант рівноваги при різних температурах. Тому рівняння ізобари (6.10) треба інтегрувати. При інтегруванні в межах температур від 0 до Т для випадків, коли тепловий ефект залежить від температури (що має місце майже завжди) дістанемо рівняння
де В – стала інтегрування, обрахунки якої потребують додаткових постулатів, які не можуть бути одержані на основі першого і другого законів термодинаміки. Ці постулати одержали назву теплової теореми Нернста або третього закону термодинаміки.
Третій закон термодинаміки
Перший закон термодинаміки є загальним законом природи. Він призводить до поняття енергії. Другий закон термодинаміки призводить до понять ентропії та температури (якраз за допомогою цього закону доведено існування абсолютної температури). Теплова теорема Нернста не вводить нових понять, а лише встановлює граничні властивості знайдених раніше величин – ентропії і теплоємкості. Дослідження залежності DН і DG різних реакцій від температури аж до температур, близьких до абсолютного нуля, показало, що ці залежності мають вигляд, зображений на рис. 6.2. Це дозволило Нернсту сформулювати третій закон термодинаміки: для реакцій, які протікають в конденсованих системах, при наближенні температури до абсолютного нуля криві теплового ефекту і ізобарного потенціалу реакцій зливаються і мають загальну дотичну, що паралельна осі температур (абсцис). У математичній формі теплова теорема Нернста має вигляд
З теплової теореми випливають наступні важливі наслідки: - для реакцій, які протікають у конденсованих системах, стала інтегрування дорівнює нулю (В = 0); - при абсолютному нулі ентропія і теплоємкість будь-якої кристалічної речовини дорівнюють нулю (постулат Планка): So = 0іСо = 0. У зв'язку з цим показано, що ніякими процесами неможливо досягти температури рівної нулю кельвіна. Дійсно, оскільки теплоємкість речовин при наближенні до нуля прагне теж до нуля, то неможливо повністю відібрати тепло від охолоджуваного тіла і досягти абсолютного нуля. Слід зазначити, що для реакцій, які проходять з участю газів, теплова теореми не придатна. У цьому випадку В ¹ 0.
|
|
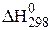 = -149,84 кДж), при підвищенні температури рівновага зміщується в бік процесу, що протікає з поглинанням теплоти, тобто ліворуч. Підвищення загального тиску зміщує рівновагу реакції в бік утворення СО2, тобто праворуч. І навпаки.
= -149,84 кДж), при підвищенні температури рівновага зміщується в бік процесу, що протікає з поглинанням теплоти, тобто ліворуч. Підвищення загального тиску зміщує рівновагу реакції в бік утворення СО2, тобто праворуч. І навпаки.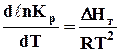 , (6.10)
, (6.10)
 nКр від Рис. 6.2. Залежність
nКр від Рис. 6.2. Залежність  і
і  від
від ,
,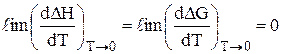 .
.