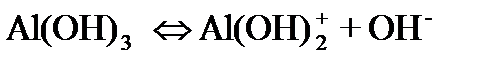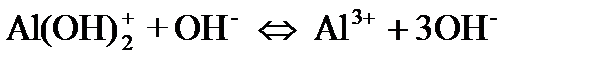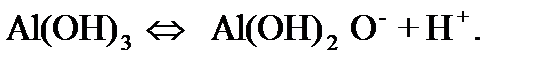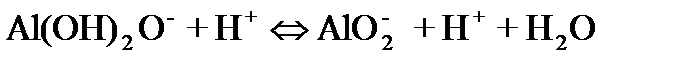|
|
Электролитпен коагуляциялау кинетикасы 17 главаМіне осы айтылғандар, жалпы потенциал мен электркинетикалық потенциал екі түрлі шама, ал Гельмгольц-Перрен теориясы электркинетикалық құбылыстарды түсіндіре алмайтындығын көрсетеді.
Гуй -Чэпмен теориясы Бір-біріне байланыссыз Гуй (1910 ж.) және Чэпмен (1913 ж.) қарсы иондардың диффузиялық қабаты болатын қос электрлік қабаттың теориясын жасады. Бұл теория Гельмгольц-Перрен теориясының кемшіліктерін еске ала отырып көптеген нәрселерді түсіндірді. Гуй-Чэпмен теориясы бойынша қарсы иондар фазалар арасында бір қабат жасап жиналмайды, олар фазалар арасынан белгілі бір қашықтықта бүкіл сұйықтыққа таралған. Бұның себебі қарсы иондарға екі түрлі күш әсер ететіндіктен. Біріншісі – оларды бетке тартатын электрлік күш болса, екіншісі – оларды бүкіл сұйықтыққа тарататын иондардың жылуық қозғалысынан болатын диффузиялық күш. Әрине, фазалар арасында электр өрісінің әсері күшті. Фазаарлық шекарадан қашықтаған сайын оның әсері нашар болады. Ендеше қарсы иондардың концентрациясы да фазааралық шекарадан қашықтаған сайын азая бастайды. Белгілі бір қашықтықта олардың концентрациясы ерітіндінің бүкіл көлеміндегі концентрациясына тең болады, міне осындай иондардың жылулық қозғалысының нәтижесінде қарсы иондардың тепе-теңдік диффузиялық қабаты болады екен. Гуй-Чэпмен жасаған қос электрлік қабаттың құрылысы мен ол қабаттағы потенциалдың кемуі сұлбалық түрде 4.13-суретте көрсетілген. Бұл сұлбадан потенциалдың түзу сызықты емес, қисық сызықты түрде кемитіндігін көруге болады. Беттік зарядтарының концентрациясы неғұрлым көп болса соғұрлым потенциал жылдам кемиді, ал компенсация жасайтын қарсы ионның аз жағында оның кемуі де баяу болады. Диффузиялық қабат карсы иондардың жылулық қозғалысынан болатындықтан абсолюттік 0 температурасында барлық қарсы иондар бетке жақын бір қабатқа орналасады деп қарастыруға болады. Ендеше Гельмгольц-Перреннің теориялық түсініктерін Гуй-Чэпменнің дербес жағдайы деп қарастыруға болады. Иондардың тепе-теңдікте (орналасуы) бөлінуі атмосферадағы газдардың салмақ күшінің әсерінен тепе-теңдікте орналасуына ұқсас. Тек гравитациалық өріс молекулалардың орналасуына байланыссыз, ал ол қос электрлік өріс иондарының орналасуына байланысты болады. Бұнда қарсы иондардың зарядталған беттегі саны беттен ерітіндіге қашықтаған сайын Больцман заңы бойынша азаяды да, ал потенциал анықтағыш иондардың саны керісінше сол заң бойынша көбейеді. Гуй-Чэпмен теориясы бойынша электркинетикалық құбылыстарды түсіндіріп көрейік. Бұл теория бойынша қатты және сұйық фазалар қозғалғандағы жылжу (сырғу) жазықтығы фазаларының шекарасында емес, одан белгілі бір ∆ қашықтығында болады. Бұл жердің потенциалы сұйық ортаның потенциалынан әлдеқайда жоғары. Ендеше осы сұйық ортаның потенциалының айырмасы диффузиялық қабаттың зарядына тең. Міне осы потенциал электрфорез, иә электросмос кезінде фазалардың тасымалдауын анықтайды, яғни электркинетикалық құбылыстарды тудырады. Бұдан осы электркинетикалық потенциалдың (кейде оны ξ-потенциал деп те атайды) жалпы потенциалдың бір бөлігі екені көрініп тұр. Ендеше электркинетикалық потенциалдың жалпы потенциалдан өзгеше және оған тең болмайтындығын оңай түсінуге болады. Гуй-Чэпмен теориясы осы екі потенциалға әртүрлі факторлардың әрқалай әсер ететіндігін де түсіндіреді. Индифферентік электролиттің жалпы және электркинетикалық потенциалдарға әсерін қарастырайық. Индифферентік электролитті жүйеге енгізгенде жалпы потенциал өзгермейді. Ал оның электркинетикалық потенциалға әсері басқаша. Потенциал анықтағыш иондарды компенсациялау үшін эквивалентті түрде қарсы иондардың болуы керек, ендеше жүйеге енгізген индифферентік электролиттің концентрациясы көбейген сайын, қос электрлік қабаттың қалыңдығы кемиді (азаяды), басқаша бұндай жағдайды қос электрлік қабаттың қысылуы деп атайды. Ендеше электркинетикалық потенциалдың мәні өзгереді. ξ
4.14-сурет. Индифференттік электролиттің ҚЭҚ қалыңдығына және ξ-потенциалға әсері
Біз жоғарыда Гуй-Чэпмен теориясының артықшылықтарын айттық. Сонымен қатар оның кемшіліктері де бар. Біріншіден Гуй-Чэпмен теориясында иондардың шамалары есепке алынбаған. Екінші кемшілігі Гуй-Чэпмен теориясы қайта зарядталу құбылысын түсіндіре алмайды. Гуй-Чэпмен теориясының тағы бір кемшілігі, ол валенттігі бірдей әртүрлі иондардың қос электрлік қабатқа әртүрлі әсерлерінің болатынын түсіндіре алмайды. Бұл теория бойынша бірдей валентті қарсы иондар қос электрлік қабатты бірдей қысу керек. Ендеше потенциалы бірдей көрсеткішке кему керек. Алайда тәжірибелік мәліметтерге қарағанда бірдей валентті иондардың қос электрлік қабатқа әсерлері олардың радиустарының өсуіне байланысты күшейеді екен. Айта кететін Гуй-Чэпмен теориясының тағы бір кемшілігі, бұл теория сұйылтылған коллоидтық ерітінділер үшін жақсы орындалғанымен концентрлі ерітіндіге оны қолдануға болмайды екен. Бұл теорияның кемшіліктерін еске ала отырып 1924 ж. Штерн қос электрлік қабаттың құрылысының тағы бір теориясын жасады.
Штерн теориясы Штерн жасаған қос электрлік қабат құрылысының сұлбасы Гельмгольц-Перрен мен Гуй-Чэпмен сұлбаларын біріктірді. Ол мынандай жағдайларды қарастырды. Біріншіден, иондардың белгілі бір шамалары болатындықтан олар бетке ион радиустарына жақын орналаса алмайды. Екіншіден Штерн бет пен иондардың электрлік емес спецификалық әрекеттесуін еске алды. Бұл әрекеттесу беттен белгілі бір қашықтықта молекулалық (адсорбциялық) күштің әсерінен болады. Штерн теориясы бойынша қарсы иондар электрстатикалық және адсорбциялық күштердің әсерінен бетке тартылып, одан 1-2 молекула шамаларындай қашықтықта орналасатын болады. Бұл қабатты түзетін иондар беттен (δ) қашықтығында болады, яғни Гельмгольц-Перрен теориясындағыдай. Бұл қабатта потенциалдың өзгеруі өте жылдам (күрт) болады, ол қабатты бір авторлар Гельмгольцтік қабат десе, екінші біреулері Штерндік, ал басқалары адсорбциялық қабат деп атайды. Ал қалған потенциал анықтағыш иондарды компенсациялайтын қарсы иондар жылулық қозғалыстың әсерінен қос электрлік қабаттың диффузиялық бөлігін түзеді. Диффузиялық қабаттағы қарсы иондардың орналасуы Гуй-Чэпмен диффузиялық қабатындағы иондардың орналасу заңына бағынады. Әрине бұл қабаттан потенциалдардың өзгеруі салыстырмалы түрде баяу болады, сондықтан диффузиялық қабатты кейде Гуй қабаты деп те атайды. Штерн жасаған қос электрлік қабаттың құрылысының сұлбасы және ондағы потенциалдың кемуі 4.15-суретте көрсетілген. 4.15-сурет. Штерн жасаған ҚЭҚ сұлбасы
Сұлба бойынша жалпы потенциалдың Міне осындай сұлба бойынша қос электрлік қабатты қарастырғанда, осы уақытқа дейінгі белгісіз нәрсе – жылжу (сырғу) жазықтығының орны. Кейбір авторлар жылжу жазықтығының шекарасы Гуй мен Гельмгольц қабаттарының аралығы деп есептейді. Жалпы алғанда оны 4.15-суреттегідей Гуй қабатында деп қарастыруға болады. Мұнда жылжу жазықтығы пунктирлік АВ сызықтарымен көрсетілген. Міне сол себепті Гуй мен Гельмгольц қабаттарының арасындағы потенциалдың ξ-потенциалына тең болуы шарт емес. Бұл сұлбадан егер жүйеге электролит енгізсек диффузиялық қабаттың қысылып қарсы иондардың көбі адсорбциялық қабатқа өтетіндігін білуге болады. Бұдан қос электрлік қабат, егер қосқан электролиттің концентрациясы көп болса Гельмгольц-Перрен теориясындағы қабатқа жақындайтыны, яғни ξ-потенциалдың азайып 0-ге тең болатындығын аңғаруға болады. Керісінше егер жүйені сұйылтатын болсақ, қос электрлік қабат кеңейіп, оған сәйкес ξ - потенциалының мәні де артады. Штерн теориясы бойынша неғұрлым қарсы иондардың валенттілігі жоғары болған сайын соғұрлым қос электрлік қабат жұқа және оған сәйкес ξ- потенциалының мәні аз болады. Бұл да Гуй-Чэпмен теориясында қарастырылған. Егер қарсы иондардың валентілігі бірдей болса, онда қос электрлік қабаттың қалыңдығы және қарсы иондардың диффузиялық қабаттағы саны иондардың төлсипаттық адсорбциялану қабілетімен анықталады. Иондардың төлсипаттық адсорбциясы олардың поляризациялану және гидратацияланумен анықталатынын бұрын айтқанбыз. Ендеше иондардың бұл қасиеттері олардың таза радиустарымен, немесе Д.И. Менделеев жүйесіндегі олардың орналасу жағдайларымен анықталады. Иондардың поляризациясы оңай болса соғұрлым қос электрлік қабат жақсы қысылады. Гидратацияның азаюы да қос электрлік қабаттың қысылуына әкеледі. Өйткені гидратация азайған сайын иондардың электрстатикалық әрекеттесуі де күшейеді. Бұл айтылғандардан иондардың қос электрлік қабатты қысу жағынан бұрынғы өзімізге белгілі лиотроптық қатар бойынша әсер ететінін байқаймыз. Енді Штерн теориясының бұрынғы теориялардан артықшылықтарына тоқталайық. Штерн теориясы бойынша иондардың радиусын еске ала отырып қос электрлік қабаттың сыйымдылығын есептеу оның тәжірибе жүзіндегі табылған мәнімен өте дәл келетінін көрсетті.
Мұндағы:
Гуй-Чэпмен теориясынан тағы бір айырмашылығы Штерн теориясы бойынша жүйеге көп валентті қарсы иондары көп валентті электролитті қарсы иондары енгізгенде электркинетикалық потенциалдың таңбасының өзгеруін (қайта зарядталу құбылысы) түсіндіруге болады. Көп валентті қарсы иондар адсорбциялық қабатқа электркинетикалық әрекеттесумен қатар өздерінің жақсы адсорбцияланатындығымен де тартылады. Қарсы иондар тек бетті бейтарап етіп қана қоймай бөлшекті қайта зарядталатындай мөлшерде адсорбциялануы мүмкін. Осының нәтижесінде электркинетикалық потенциалдың таңбасы өзгереді. Қайта зарядталуды сұлба түрінде 4.16- суреттегідей етіп қарастыруға болады. Бұдан көп валентті қарсы иондардың адсорбциясының нәтижесіндe Сурет
Әрине қарсы иондардың концентрациясын одан әрі көбейтсек қос электрлік қабаттың қысылуына байланысты ξ-потенциалы да кемиді (2 - қисық). Егер беттік заряды теріс болса, қайта зарядтау үшін электролиттер көбінде көп валентті катиондары (Fe+3, Al+3, Th+4) бар электролиттер қолданылады. Егер адсорбциялық қабілеттілігі күшті болса бір валентті иондар да қайта зарядталу құбылысын береді. Мысалы, оларға көптегөн алколлоидтар мен бояу заттарының катиондары жатады. Міне осы айтылғандардан Штерн теориясының Гуй-Чэпмен теориясына қарағанда тәжрибеллік мәліметтерге өте сәйкес келетінін көруге болады. Иондардың өлшемдерін еске ала отырып, Штерн теориясы әртүрлі электролиттердің қос қабат пен ξ-потенциалына әсерін жақсы түсіндіреді. Әрине Штерн теориясының кейбір кемшіліктері бар, өйткені ол да барлық жағдайларды еске алмаған. Мысалы, адсорбциялық потенциалды Штерн теориясы концентрацияға байланыссыз деп қарастырды. Бұлай болуы мүмкін емес. Штерн теориясында жылжу жазықтығының орны да толық шешілген мәселе емес. Міне бұндай кемшіліктеріне қарамастан электркинетикалық құбылыстарды және ондағы болатын құбылыстарды түсіндіруде басқа теорияға қарағанда Штерн теориясының маңызы зор. 4.5 Электркинетикалық потенциалға әртүрлі факторлардың әсерлері ξ - потенциалының коллоидтық химияда маңызы зор. Өйткені ол арқылы көп жағдайларда коллоидтық жүйелердің тұрақтылығын сипаттайды. Енді осы шамаға әсер ететін факторларға тоқталайық. 4.5.1 Индифференттік электролиттердің әсерлері Ең қарапайым, практикада маңызы зор жағдайды қарастырайық. Ол – иондары кристалдық торға енбейтін индифференттік электролиттерді жүйеге енгізгендегі жағдай. Бұндай жағдайлар практикада көп қолданылады. Бұндай электролиттердің коллоидтық бөлшектердің жалпы потенциалына әсері болмайтынын айттық. Ал олар қос электрлік қабатты қысатындықтан оған сәйкес ξ-потенциалды да азайтатыны туралы да жоғарыда ескерттік. Осындай индифференттік электролиттерді жүйеге енгізгенде мынандай екі түрлі жағдай болу мүмкін: 1. Жүйеге енгізген электролиттің иондарының бірі жүйедегі қарсы иондармен бірдей болуы мүмкін; 2. Жүйеге енгізген электролиттің иондары жүйедегі электролит-стабилизатор иондарынан басқаша болуы мүмкін. Бірінші жағдайды Гуй-Чэпмен және Штерн теориясын қарастырғанда айттық. Онда қос қабаттың тығыздалуының (қысылуының) нәтижесінде ξ-потенциалы азаяды. ξ-потенциалының кеміп, 0-ге тең болғандағы жағдайды жүйенің изоэлектрлік жағдайы деп атайды. Екінші жағдайда коллоидтық бөлшектің қарсы иондары енгізген электролит иондарымен алмасады, әрине таңбасы бірдей иондар және эквивалентті мөлшерде. Иондардың алмасуы, егер төлсипаттың (спецификалық) адсорбция болмаған жағдайда жақсы болады. Бұндай жағдайда алмасу иондарының валенттілігімен анықталады. Иондық алмасу бір валенттік иондар үшін өзімізге белгілі Б.Л. Никольский заңдылығына бағынады.
Егер иондардың валенттілігі әртүрлі болса, алмасу жоғарғы валенттілік жағына қарай ығысады. Әрине егер төлсипаттық адсорбция болатын жағдайды иондардын алмасуы жоғарғы заңдылыққа бағынбайды және өте күрделі болады. 4.5.2 Индифференттік емес электролиттердің әсерлері Бұл- әрине, электролит иондарының бірі кристалдық торға енетін қабілеттілігі бар жағдай. Мұндай электролиттерді жүйеге енгізгенде оның потенциал анықтағыш ионы φ0 -ді көбейтеді де, ол қарсы ионы қос электрлік қабатты қысатын болады. Егер осындай электролиттердің концентрациясы аз болса, онда алғашқы үрдіс әсері басым болады, яғни кристалдық торға ену үрдісі күшті болады. Ал электролиттің концентрациясы жоғары болғанда, кристалдық торға ионның енуі аяқталып, екінші үрдісі басым болады, яғни қос электрлік қабаттың қысылуы басым болады. Сол себепті, енгізген электролиттің концентрациясы артқан сайын, бұндай электролитті жүйеге өнгізгенде алдымен ξ-потенциалы көбейіп кейіннен кемитін болады. Мұны 4.17-суреттегі сұлбадан көруге болады. Одан жүйеге индифференттік емес электролитті енгізгенде тек ξ-потенциал емес,
4.17-сурет. Индифференттік емес электролиттің потенциалдарға әсері
Жүйеге индифференттік емес электролитті енгізгенде қайта зарядталу құбылысы болуы мүмкін. Енді сол құбылысты, яғни индиференттік емес электролиттің ξ және φ0-ге әсерін AgJ-кірнесін мысалға алып түсіндірейік. AgNО3 ерітіндісімен стабилизацияланған (тұрақталған) AgJ кірнесін КJ ерітіндісіне енгізейік. КJ ертіндісіне енгізгенге дейін бұл кірнедегі потенциал анықтағыш ионы Ag+, ал қарсы Міне қайта зарядталу осылайша болады. Бұл қайта зарядталудың бұрынғы қарастырған көп валентті иондардың әсерінен болатын қайта зарядталудан айырмашылығы, мұнда тек ξ- потенциалы ғана емес, оған қоса φ0-потенциалы да өзгереді.
4.18-сурет φ0 және ξ – потенциалдарының индифференттік емес электролит әсерінен қайта зарядталу кезіндегі өзгеруі
Индифференттік емес электролиттердің әсерінен дисперстік фазаның қайта зарядталуын 4.18-суреттегі сұлба бойынша көрсетуге болады. 4.18-суреттегі 1-қисық потенциалдың қайта зарядталуға дейінгі, ал 2-қисық қайта зарядталудан кейінгі (өзгеруін) кемуін көрсетеді.
4.5.3 Ортаның рНы-ның әсері Сутектік және гидроксиль иондарының жақсы адсорбциялық қабілеттері болғандықтан дисперсиялық ортаның рН-ы коллоидтық бөлшектердің ζ-потенциалына күшті әсер етуі мүмкін. Олардың себептері: сутек ионының радиусы өте аз болуы және гидроксиль тобының дипольдік сәтінің көп болуы. Бұл факторлар олардың бетке жақын келуіне жағдай жасайды. рН-тың әсері лиокірнелер дисперстік фазасы амфотерлі болғанда күштірек болады. Мысалы, Al(OH)3, Fe(OH)3, Sn(OH)2, Th(OH)4, және т.б. Бұл кірнелерде рН-тың өзгеруіне байланысты коллоидтық бөлшектердің қайта зарядталуы мүмкін. Al(OH)3 кірнесін мысалға алып қайта зарядталуын қарастырайық. Онша қышқыл емес ортада коллоидтық бөлшектердің бетіндегі Al(OH)3 молекулалары былай диссоциацияланады:
Мұндағы Al(OH)2+ ионы потенциаланықтағыш ионы, ал ОН- ионы қарсы ион болады.
Ендеше коллоидтық бөлшек оң зарядты болады. рН-тың мәні төмен болғанда Al3+ иондары түзіледі.
Бұл алдымен беттің оң зарядын арттырады, содан соң алюминий гидроксиді қышқылда еріп, коллоидтық ерітінді шын ерітіндіге айналады. Сілтілік ортада алюминий гидроксиді қышқылдық қасиет көрсетіп, былайша диссоциацияланады:
Нәтижесінде Al(OH)2О- ионы потенциаланықтағыш ион, ал Н+ ионы қарсы ион болады. Ендеше коллоидтық бөлшек заряды теріс болады. рН-тың мәні өте жоғары болғанда AlO2- ионы түзіледі.
Гидроксиль ионының концентрация одан да жоғары болғанда алюминий гидроксиді сілті ерітіндісінде еріп алюминат түзеді де, коллоидтық ерітінді бұл жағдайда шын ерітіндіге айналады. Әрине φ0 потенциалы өзгергенде ζ-потенциалының мәні де өзгереді. Қышқылдық ортада электрокинетикалық потенциалдың таңбасы φ0-потенциалы сияқты оң, ал сілтілік ортада керісінше теріс болады. рН-тың белгілі бір мәнінде ζ-потенциалының мәні нөльге тең болып, жүйе изоэлектрлік күйінде болады. Ол кезде беттегі оң және теріс зарядтарының саны бірдей болады. Осы айтылған дисперстік фазаның қайта зарядталуы бұрынғы қарастырылған қайта зарядталу құбылысынан (ζ-потенциалының таңбасының ауысуы) айырмашылығы бар. Қарастырылып отырған жағдайда қайта зарядталудан кейінгі потенциалдың таңбасын анықтайтын ион жүйеге енгізілмейді, ол дисперстік фазаның өзінің иондалу сипатының өзгеруіне байланысты түзіледі.
4.5.4 Коллоидтық жүйенің концентрациясының әсері Жалпы түсініктер бойынша кез-келген коллоидтық жүйені сұйылтқанда ζ-потенциал өсу керек, өйткені ҚЭҚ қалыңдығы артады. Алайда сұйылтқан кезде дисперстік фаза бетінен потенциал анықтағыш ионның десорбциясы болуы мүмкін. Ендеше φ0-потенциалының мәні төмендейді, оған сәйкес ζ-потенциалы да азаю керек. Коллоидтық жүйенің концентрациясын арттыру осы айтылғандарға қарама-қарсы болады. Коллоидтық жүйенің концентрациясын арттырғанда ζ-потенциалының қандай бағытта өзгеруі екі фактордың – ҚЭҚ қысылуы (иә қалыңдауы),немесе потенциал анықтағыш ионның десорбциясы (адсорбциясы) – қайсының әсері күштірек болатындығымен түсіндіріледі.
4.5.5 Температураның әсері Температураның ζ-потенциалға әсері концентрацияның әсеріне ұқсас болады. Температураны арттырғанда қарсы иондардың жылулық қозғалысының артуының салдарынан ҚЭҚ қалыңдығы көбейетіндіктен ζ-потенциалының мәні арту керек. Алайда сонымен қатар потенциал анықтағыш ионның десорбциясы артады. Ендеше φ0- және ζ-потенциалдары азаяды. Сондықтан температураға байланысты потенциалының өзгеруі әрбір коллоидтық жүйенің өзіндік ерекшелігімен сипатталады. |
|
 -потенциалының жүйеге индифференттік электролитті енгізудегі (әртүрлі мөлшерде) өзгеруі 4.14-суретте көрсетілген. Бұндай индифференттік электролиттің белгілі бір жоғары концентрациясында қос электрлік қабат қысылып моноиондық қабатқа айналады екен, яғни қос электрлік қабатымыз Гельмголыд-Перрен қабатына айналады екен. Осыған сәйкес, яғни индифферентік электролиттің концентрациясы өскен сайын ξ-потенциалының мәні азайып, ал қос қабат Гельмгольц-Перрен қабатына айналғанда ξ-потенциалының мәні 0 -ге тең болады екен.
-потенциалының жүйеге индифференттік электролитті енгізудегі (әртүрлі мөлшерде) өзгеруі 4.14-суретте көрсетілген. Бұндай индифференттік электролиттің белгілі бір жоғары концентрациясында қос электрлік қабат қысылып моноиондық қабатқа айналады екен, яғни қос электрлік қабатымыз Гельмголыд-Перрен қабатына айналады екен. Осыған сәйкес, яғни индифферентік электролиттің концентрациясы өскен сайын ξ-потенциалының мәні азайып, ал қос қабат Гельмгольц-Перрен қабатына айналғанда ξ-потенциалының мәні 0 -ге тең болады екен. кемуі қос электрлік қабаттың диффузиялық бөлігінің потенциалынан және Гельмгольц бөліктің
кемуі қос электрлік қабаттың диффузиялық бөлігінің потенциалынан және Гельмгольц бөліктің 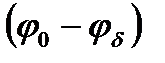 қосындысынан тұратыны көрініп тұр.
қосындысынан тұратыны көрініп тұр.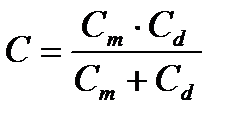
 – молекулалық қабаттың сыйымдылығы;
– молекулалық қабаттың сыйымдылығы;  – диффузиялық қабаттың сыйымдылығы.
– диффузиялық қабаттың сыйымдылығы.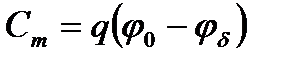
 - және ξ-потенциалдары таңбаларын өзгертетіні көрініп тұр. Ал
- және ξ-потенциалдары таңбаларын өзгертетіні көрініп тұр. Ал  тұрақты өйткені басқа текті иондар кристалдық торға енбейді.
тұрақты өйткені басқа текті иондар кристалдық торға енбейді.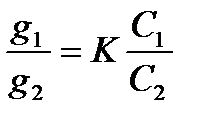
 - иондардың қос электрлік қабаттағы концентрациясы;
- иондардың қос электрлік қабаттағы концентрациясы;  - сол иондардың ертіндідегі концентрациясы.
- сол иондардың ертіндідегі концентрациясы. -потенциалының да өзгеретіні көрініп тұр.
-потенциалының да өзгеретіні көрініп тұр. ионы болды. Әрине бұл кірненің бөлшектері оң зарядталған. Ал КJ ертіндісіне AgJ-ты енгізгеннен кейін, потенциаланықтағыш ионымыз J-, ал қарсы ионымыз К+ иондары болады. Сондықтан кірнеміздің бөлшектері теріс зарядталады.
ионы болды. Әрине бұл кірненің бөлшектері оң зарядталған. Ал КJ ертіндісіне AgJ-ты енгізгеннен кейін, потенциаланықтағыш ионымыз J-, ал қарсы ионымыз К+ иондары болады. Сондықтан кірнеміздің бөлшектері теріс зарядталады.