|
|
Электролитпен коагуляциялау кинетикасы 20 глава
1.3 - сурет. Микрожарықшақтардың екі өлшемдік газ Металл нанобөлшектерін алу үшін екі сатылық физикалық әдістер кеңінен қолданылады. Бірінші сатыда металды атомдық өлшемдерге дейін диперсиялап, буға айналдырады; екінші сатысында осы буды конденсациялап, нанобөлшектер алады. Бұл әдістеменің бірнеше нұсқауы бар. Молекулалық шоғырлар әдісі. Жіңішке саңылауы (диафрагмасы) бар вакуумды камераға бастапқы затты орналастырады. Қажетті жоғары температураға дейін қыздырғанда зат буланып, диафрагмадан өте келе, буланған бөлшектер шоғыр түзеді. Оны қатты бетке бағыттайды, осы бетте бу конденсацияланы, дисперстік бөлшектер немесе қалыңдығы 10 нм болатын жұқа қабыршақ түзіледі. Аэрокірнелік әдіс. Металл инертті газдың сиретілген атмосферасында буланады. Температураның төмендеуімен бу конденсацияланып, өлшемдері 1-100 нм болатын дисперстік металл бөлшектері түзіледі. Аэрокірнелік әдіс әртүрлі металдардың (темір, кобальт, мыс, никель, күміс, алтын, алюминий) және олардың қосылыстарының (оксидтер, нитридтер, сульфидтер) нанобөлшектерін алу үшін қолданылады. Тозаңдатқыш кептіру. Әдістің бірінші сатысында берілген заттың (мысалы, тұздың) ерітіндісін ыстық ауа ағысында ұсақ тамшыларға дисперсиялайды. Бірқалыпты температурады еріткіш ұшып, тұздың дисперстік бөлшектерін түзеді. Жоғары температурада еріткіштің еруімен қатар тұздың термиялық ыдырауы жүріп, оксидтің ұнтағы түзіледі. Криохимиялық синтез. Бұл әдістің негізгі ерекшелігі – алдымен металды қарқынды қыздыру арқылы инертті газ ағысында буландырады. Ары қарай металл буы субстрат бетінде аса төмен температурада газдың артық (мың еседей) мөлшерінде конденсацияланып, нанобөлшектер түзіледі. Аса төмен температурада сұйыту нанобөлшектердің субстрат бетіндегі диффузиясына кедергі жасап, кіші өлшемдерін сақтайды. Плазмалық әдіс. Инертті атмосферада электр (вольт) доғасын алып, анод ретінде буланатын материалды пайдаланады. Анодтан шығатын бу ағысына өте үлкен температура (7000К) беріліп, доға сыртындағы температура оған қарағанда аз болады. Нәтижесінде металл буы аса қанығып, нанобөлшектер түрінде конденсацияланады. Кірне-сірне әдісі. Бұл әдісті коллоидтық ерітіндіден (кірнеден) жоғары дисперстік қатты бөлшектерді (нанобөлшектерді) бөліп алу үшін қолданады. Белгілі жағдайда дисперстік бөлшектер бір-бірімен бірігіп, кеңістік құрылым – сірне түзеді. Сірнені жылдам кептірсе, жоғары дисперстік бөлшектерден тұратын ұнтақ алынады. Еріткішті алмастыру әдісі. Бұл әдісті зольдің қатты бөлшектерін алу үшін пайдаланады. Берілген заттың ерітіндісін үнемі араластыра отырып, осы зат ерімейтін сұйықтыққа құйады. Аса қанығу дисперстік бөлшектердің түзілуіне әкеледі. Аса қанығу неғұрлым үлкен болса, бөлшектер соғұрлым кіші болады. Осы әдіспен органикалық еріткіштерде жақсы еріп, суда ерімейтін күкірт, фосфор, канифоль және т.б. заттардың гидрокірнесін алады.органикалық еріткіш ретінде әдетте ацетон, этил, изопропил спирттерін қолданады. Жалпы диспергациялық әдіс бойынша денені ұнтақтағанда алғашында дене деформацияға ұшырайды, сонан соң дене бұзалады. Сондықтан ұнтақтау үшін атқарылатын жұмысты екі түрге бөлуге болады: денені деформациялауға және жаңа бет жасауға жұмсалатын жұмыстар деп. Деформациялау жұмысы дененің көлеміне тура пропорционал: Wдеф=kV. (8.1) Мұндағы k- пропорционалдық коэффициент; V- дененің көлемі. Жаңа бет жасау үшін атқарылатын жұмыс мынаған тең: Wб=𝜎∆S (8.2) Мұндағы 𝜎 – беттік керілу; ∆S – жаңадан пайда болған бөлу бетінің ауданы. Сонда денені ұнтақтау үшін атқарылатын жалпы жұмыстың шамасын мынаған тең болады: W= Wдеф + Wб = kV+ 𝜎∆S (8.3) Егерде көлем бөлшек радиусының кубына, ал беттің ауданы радиустың квадратына пропорционал екендігін ескерсек, онда жоғарыдағы теңдеуді былай жазуға болады: W= k1 r3 + k2𝜎r2. (8.4) Мұндағы k1 мен k2 – пропорционалдық коэффиценттер; r – бөлшектің радиусы. Дененің өлшемі өте үлкен болғанда k1 r3>> k2𝜎r2. Бұл кезде жаңа бет жасауға жұмсалатын жұмыстың шамасын ескермеуге болады. Олай болса денені ұнтақтау жұмысы шамамен мынаған тең болады: W ≈ k1 r3 (8.5) Демек, бұл кезде жалпы жұмыстың шамасы негізінен денені деформациялауға жұмсалатынжұмыстың мәнімен анықталады. Дененің өлшемі кіші болғанда k1 r3<< k2𝜎r2 , бұл кезде денені деформациялауға жұмсалатын жұмыстың шамасын ескермеуге болады. Олай болса денені ұнтақтау жұмысы шамамен мынаған тең болады: W ≈ k2𝜎r2. (8.6) Демек, жалпы жұмыстың шамасы негізінен жаңа бет жасауға жұмсалатын жұмыстың мәнемен анықталады.
1.1.3. Өздігінен диспергілену әдісі. Коллоидтық жүйенің меншікті Гиббс энергиясы g =G/V координатаға (х) байланысыты қалай өзгеретіні 16-шы суретте көрсетілген. 1.4 - сурет. Меншікті Гиббс энергиясының (g) координатаға (х) байланысты тәуелділігі. 1-лиофобтық, 2-лиофильдік жүйелер үшін. Дисперстік бөлшектің орталығы есептеудің басы, яғни х=0 болады. Лиофобтық жүйе үшін энергиялық тосқауыл (Δg1) өте үлкен, ендеше ондай жүйелер үшін өздігінен диспергілену үдерісінің мүмкіндігі өте аз.(16-шы сурет) Лиофильдік жүйелер үшін молекулалардың арасындағы әрекеттесу күші болғандықтан дисперстік фаза бөлшектерінің маңында дисперсиялық ортаның молекулаларымен айтарлықтай созылыңқы беттік қабат түзіледі. Сондықтан Δg2 х бойынша созылыңқырап, мәні аз болады, өйткені лиофильдік жүйелерде фазалар арасындағы τ1,2 шамасы аз болады. Бұл дисперстік фазаның дисперсиялық ортаға термодинамикалық тұрақты коллоидты жүйе түзіп, өздігінен өтуінің қажетті (бірақ жеткілікті емес) шарты. Өздігінен түзілу шарты (16-суреттегі Δg2 тосқауылын R-дің әрі азаюымен жеңуі) жүйенің “ішкі резервімен”, атап айтқанда Гиббс энергиясының энтропиялық құрамдасымен болады.
4/3πR13*N1=4/3πR23N2 N2= N1(R1/ R2)3
S=klnW Мұндағы: W- жүйенің болу ықтималдылығы. Жүйенің 1- және 2- күйіндегі болу ықтималдылығына дисперсиялық ортаның әсері бірдей және оны А деп алсақ,онда энтропияның өзгерісін дисперстік фаза бөлшектерінің орналасу санымен сипаттауға болады . Сондықтан: N1=N1!A; W2 = N2!A ΔSR1>R2=kclnN2!/N1!>0; Егер [ΔGэнтро]>[ΔGбет] шарты орындалса,онда дисперстік фаза болатын зат қатты күйінде өздігінен дисперсиялық ортада диспергіленіп,термодинамикалық тұрақты коллоидтық жүйе береді. Лиофильдік жүйелерде өздігінен диспергілеу үдерісі болатын кежетті жағдайларды (шарттарды) қарастырайық. Жүйенің Гиббс энергиясының өзгеруін былай жазуға болады: ΔG=ΔGбет+ΔGэнтроп ; ΔGбет =(4πR22*N2-4πR12*N1)𝛿1,2=4π 𝛿1,2 R12 ∙ (R1/ R2 -1) >0: ΔGэнтроп =-TΔS R1-R2>-Tkc N2!/N1!<0; ΔG=4π 𝛿1,2 R12(R1/ R2-1)-Tkc N2!/N1!≤0; Термодинамикалық тұрақты жүйе түзілу үшін оң артық беттік энергия (ΔG>0) толығымен теріс энтропиялық құрамдаспен (ΔGэнтро<0) теңгерілуі керек. Тек сонда ғана G=0 шарты орындалады. Ол егер 𝛿1,2 шамамен кризистік 𝛿1,2 шамасынан аспаған жағдайда ғана мүмкін болады,яғни: 𝛿1,2≤ 𝛿1,2кр=kTln N2!/N1!/ 4π τ1,2 R12(R1/ R2-1) Лиофильдік жүйелерде өздігінен диспергілеу үдерісі белгіленіп оңтайлы өлшемге жеткенде (Rоңт) дейін (молекулаға дейін емес) жүреді, өйткені тіке үдеріспен (радиустың азаюы) қатар, кері агрегациялану үдерісі де (радиустың артуы ) жүреді.Лиофильдік жүйелер үшін R-дің әрі қарай азаюы (дисперстік фаза бөлшектері Rоңт деңгейінде тұрақтануын) шектеуші (лимиттері) фактор бөлшектер азаюына байланысты кері және тура үдерістердің константаларының қатынасының заңды түрде артуы болып табылады. Дисперстік жүйелердің тұрақтылығының термодинамикалық шарттары Термодинамикалық шарты Лиофильдік дисперсті жүйелер,кәдімгі шын ерітінді сияқты,өздігінен түзілуі мумкін.Ол кезде жүйенің тепе-теңдік жағдайы Гиббс энергиясының ең аз (минимум)мәніне сәйкес келеді. Мұндай жүйелердің түзілу үдерісін мынадай термодинамикалық қатынаспен көрсетуге болады: ∆G= ∆H-TS (1)
Жүйенің Гиббс энертгиясының өзгеруі G нөлден кіші болуы керек,ендеше: ∆ H<T S (2) Энтальпияның өзгеруі ∆H фазааралық әрекеттесуді сипаттайды,оның нәтижесінде фазааралық керілу кемиді. Түзілетін дисперстік жүйе гетерогендік болып қалу үшін фазааралық керілу нөлге дейін кемімеуі керек,әйтпесе шын ерітінді түзіледі. Гетерогендік лиофильдік жүйедегі қандай беттік энергия энтропиялық құрамдаспен компенсацияланады. Оның болуы (∆S)бөлшектері жылулық (броундық) қозғалысын қабілетті дисперстік жүйелерде ғана мүмкін. Сонымен, еркін дисперстік жүйелердің ішіндегі термодинамикалық тұрақты жүйелер-ультрамикрогетерогендік (кірнелер, коллоидтық жүйелер) ғана бола алады. Лиофильдік коллоидтық жүйелерде берілген дисперстік күй энергетикалық тұрғыдан қарағанда ең тиімді болады. Жүйенің екі фазадан тұратын немесе шын ерітінді күйінде болатын күйлері энергетикалық тиімсіз (өйткені жалпы Гиббс энергиясы көбірек болады). Термодинамикалық тұрақты гетерогендік дисперстік жүйелердің болу мүмкіндігін Кельвиннің капиллярлық конденсация теңдеуін пайдаланып, Фольмер көрсеткен болатын. Ол бөлшектердің өлшемдері бойыншы максималды таралуы ультрамикрогетерогендік аймақта болатынын анықтады. Дисперстік жүйелердің коагуляциясы термодинамикалық тұрақты болу шартын былайша корсетуге болады:
Бұл фазааралық бет артқанда немесе бөлшектердің өлшемдері азайғанда Гиббс энергиясының өспеу керек екенін көрсетеді. Фазааралық беттер өздігінен өсуі, тек беттік энергия жүйенің энергиясының өсуімен компенсацияланғанда ғана болады. Ол болса диспергілеу (дисперстілікті арттырғанда) кезінде болады. Бұл құбылыс өздігінен диспергілеу-термодинамикалық тұрақты жүйелерді алудың негізгі әдісі. Осмостық қысым үшін жазылған Вант-Гофф теңдеуінен энтропиялық тебісу энергиясын алуға болады: ΠV=nRT (4)
мұндағы V- кірненің көлемі, n-сол көлемдегі бөлшектер саны
Осы көлемдегі кірненің беттік энергиясы, егер бөлшектер шар тәрізді болатын болса, мынаған тең: ∆GS = n4πr2𝛿 (5) мұндағы: 𝛿 - фазааралық керілу.
Жүйедегі тұрақты тепе-теңдік жағдайы 𝛿=𝛿max болғанда болады. Осыны ескеріп (5) және (6) теңдеулерді теңестіре отырып,мынадай теңдеу аламыз: nᴋT = n4πr2𝛿max (6) бұдан: 𝛿max= немесе жалпы алғанда: 𝛿max= мұндағы:
(8)-теңдеу Ребиндер мен Щукиннің теңдеуі деп аталады.Бұл теңдеу өздігінен диспергілену болатын, яғни дисперстік жүйенің термодинамикалық тұрақтылығын анықтайды. Максималдық фазааралық керілуді (7)-теңдеу бойынша есептеу ултрамикрогетерогендік жүйелерде бөлшектердің өлшемдеріне (100 - ден 1н - м-ге дейін) байланысты ол 1.4*10-7-ден 1.4*10-3 Дж/м-дейін өзгерісін көрсетеді. Лиофильдік дисперстік жүйелерде фазааралық бет үлкен болуына қарамастан, фазааралық керілудің аз болуынан беттік энергия да аз болады. Фазааралық керілудің аз болуы фазааралық әрекеттесудің көп болғанында ғана болады. Ондай әрекеттесулер дисперсиялық орта сұйықтық болғанда ғана болады. Сондықтан термодинамикалық тұрақты еркін дисперстік жүйелер дисперсиялық ортасы тек қана сұйықтық болғанда ғана болуы мүмкін. 1.1.4.Пептизациялау әдісі. Кірнелерді коагуляциялау кезінде пайда болған тұнбалардың коллоидтық күйге көшіп, дисперстік фаза бөлшектерін түзуін пептизация деп атайды. Қарапайым жағдайда пептизация тұнбаларды бірнеше рет жуумен жүзеге асуы мүмкін. Бұл кезде тұнбалардағы коагуляцияны болдырған иондар еріткішпен бірге кетеді. Пептизация пептизаторлар деп аталатын арнайы заттардың әсерінен де болуы мүмкін. Оларға БАЗ-дар, үлкен молекулалық қосылыстар, электролиттер, әсіресе көпвалентті иондары бар электролиттер жатады. Пептизаторлар дисперстік фаза бөлшектерінің бетінде адсорбцияланып, оларды қоршайды. Соның нәтижесінде қос электрлік (ҚЭҚ) немесе сольваттық(су болса гидраттық) қабаттар түзеді де, бөлшектер арасындағы тартылу күшін жояды. Дисперстік фазаның дербес бөлшектері дисперсиялық ортаның барлық көлемі бойынша таралып, нәтижесәнде коллоидтық жүйе түзеді. Пептизацияның 2 түрі – тікелей және тікелей емес пептизация – болады. Енді соларды қарастырайық. Тікелей пептизация . Тікелей пептизация мысалы ретінде Fe(OH)3, немесе FeO(OH) кірнесін алып қарастырайық. Онда тұнбада FeO(OH) болады. Оған пептизатор ретінде FeCl3-ті қарастырайық.Бұл кезде пептизатор былайша диссосацияланады. FeCl3= Fe+3+ 3Cl- Түзілген Fe+3 ионы бөлшектер бетінде адсорбцияланып, (Панет-Фаянс ережесіне сәйкес) бөлшектерді зарядтап, жүйені жүзгін күйіне көшіреді. Осылайша FeO(OH)- тан коллоидтық жүйе түзіледі. Тікелей емес пептизация. Тағы да жоғарыдағы кірнені FeO(OH) қарастырайық. Оған HCl қоссақ ол тұнбаны жүзгін күйге көшіре алмайды. Алайда кірне бөлшектерімен әрекеттесетіндіктен мынадай реакция жүреді. FeO(OH)+ HCl=FeOCl+H2O Аралық өнімнің (FeOCl) диссосациясы былай жүреді: FeOCl= FeO++ Cl- Түзілген FeO+ дисперстік фаза бөлшектеріне адсорбцияланып, зарядтап , оларды коллоидтық күйге ауыстырады. Пептизацияның заңдылықтарын екі модельдік жүйе үшін қарастырайық. Біріншісінде тұнбаның мөлшері тұрақты болғанда, пептизатордың концентрациясын өзгертіп, екіншісінен пептизатор мөлшері тұрақты болғанда тұнбаның мөлшерін өзгертейік. Дисперстік фазаның t уақытында жүзгіндік күйіненен тұнбаға түскен массасын пептизацияланған зат мөлшері деп (у) аталады. 17-ші суретте берілгендерді былай түсіндіруге болады. Алдымен тұнба бөлшектеріне пептизатор адсорбцияланады, бірақ
мөлшерінің пептизатор мөлшерінің тұнба концентрациясына концентрациясына тәуелділігі. концентрациясына тәуелділігі.
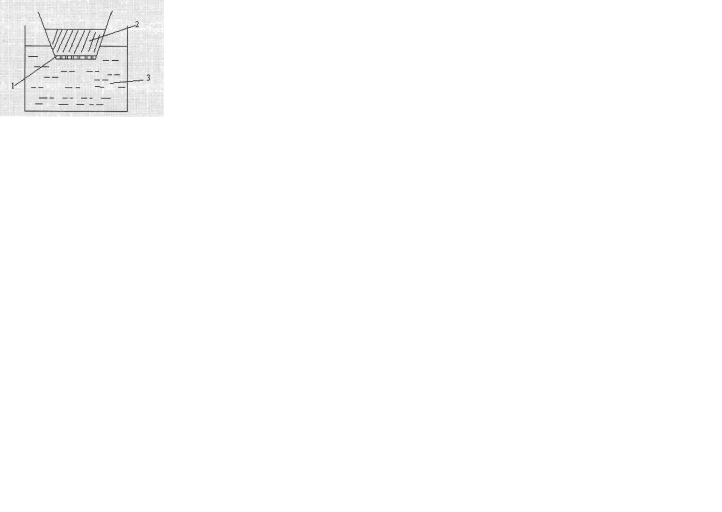
Пептизатор концентрациясы тұрақты болғанда тұнбаның бастапқы мөлшеріне байланысты коллоидтық күйге көшкен тұнба мөлшерінің тәуелділігінің сипатын түсіндіру үшін мыналарды еске алу керек.(18-ші сурет): I- аймақта ( АВ учаскесі) тұнбаның концентрациясы артқан сайын заттың жүзгін күйіне көшкен мөлшері де артады, өйткені тұнбаның алғашқы аз бөлігін ( порциясын ) қосқанда оны коллоидтық күйге айландыру үшін пептизатор мөлшері айтарлықтай жеткілікті.Одан әрі тұнба концентрациясын арттырғандаII-ші аймақта (ВС учаскесі) пептизатордың тапшылығы басталады да, тұнба жүзгіндік күйге көшпей дисперсиялық ортаға көшкен кірненің біраз бөлігі қайтадан тұнбаға көшеді. Ол пептизатордың дисперстік фаза бөлшектерінің арасында қайта таралу салдарынан болады. Пептизацияның пайдалы жағына мысал ретінде препаративтік коллоидтық химиядағы стандарттық кірнелерді (зольдерді) алуды айтуға болады. Сол себепті дисперстік фазаның барлық бөлшектері жүзгіндік күйде болуына пептизатор жетіспейтін болады. Пептизация үрдістері көп жағдайда топырақтардың құрамын және құрылымдық элементтерінің өлшемін анықтайды, ол болса ауыл шаруашылық дақылдарының өнімділігіне әсер етеді. Мысалы, егер топырақты Na+ионы бар эллектролитпен жүйелі түрде өңдесе , топырақтағы ион алмасудың нәтижесінде оның құрылымын мықтылайтын Ca+2 және Mg+2 иондары жуылады және онымен қатар топырақтың агрегаттардың белгілі-бір бөлігі пептизацияланады, олар топырақтың жууға қарсы қабілеттілігін жоғарылатады. Сабында мен синтетикалық жуғыш заттардың жуғыштық қабілеттері пептизация үдерісімен байланысты болады. Ластық бөлшектері оларға БАЗ молекулалары адсорбцияланатындықтан ұзағырақ бөлшектерге бөлінеді, олар болса өңделетін беттен су фазасына оңай ауысатын болады. Пептизация үдерістерімен байланысты болатын жағымсыз құбылыстарға шарап пен сыра өндірісінің соңғы сатыларында тұрақты жүзгіндердің түзілуін айтуға болады. 1.2 Коллоидтық жүйелерді тазарту әдістері Әдетте жоғарыда айтылған әдістермен коллоидтық жүйелерді алғанда олардың құрамында мицеллалардан басқа электролит-стабилизатор, еріткіш және кіші молекулалық ермелер (қоспалар) болады. Мысалы, күміс нитраты мен калий иодидінің әрекеттесуінен алынған күміс иодидінің золінде индиференттік электролит-калий нитратының едәуір мөлшері болады. Кейбір жағдайларда коллоидтық жүйедегі электролиттер мен кіші молекулалық ермелер бастапқы өнімдердің таза болмауынан немесе басқа да себептермен болады. Әдетте коллоидтық жүйелерді диализ, электрдиализ және ультрасүзу әдістермен тазартады. Диализ. Бұл – коллоидтық жүйелерді тазартудың ең қарапайым әдісі. Оны жүзеге асыратын құрал диализатор деп аталынады. Қарапайым диализатордың сұлбасы 1.4- суретте көрсетілген. Ол жартылай өткізгіш жарғақтан (мембранадан) 1 тұратын диализденетін ерітінді 2 құйылған қапшық. Ол қапшық суы бар ыдысқа түсіріледі.
1.4 - сурет. Диализатор сұлбасы.
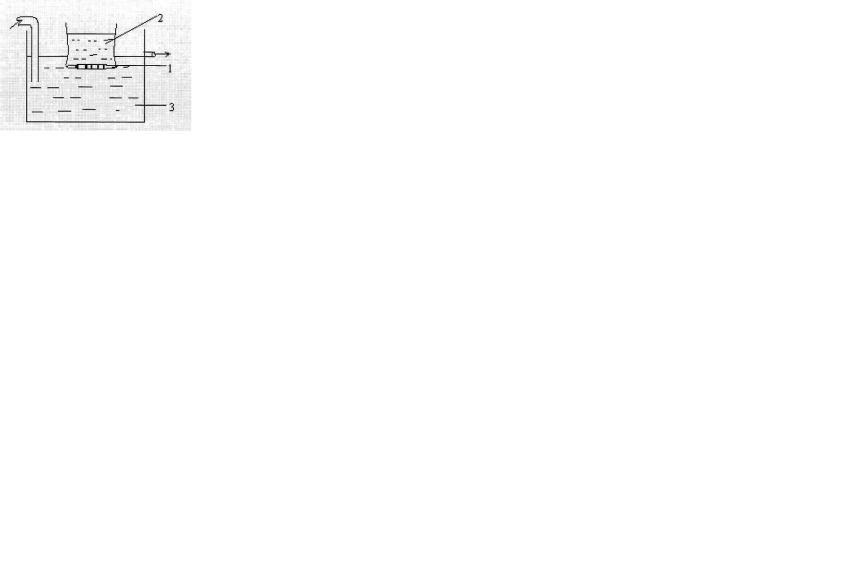
Қазіргі кезде диализатордың жетілдірілген түрлері көп. Соның бірі ағындық диализатор. Оның сұлбасы төмендегі 1.5-суретте көрсетілген.
1.5 - сурет. Ағындық диализатордың сұлбасы.
Әдетте диализатордың қарқындылығы диализ өтетін беттің артуымен, диализденетін ерітіндінің қалыңдығының азаюымен, сыртқы сұйықтықтың үздіксіз ауысуымен және диффузияны жылдамдатып және температураның артуымен күшейеді. Ағындық диализаторда сыртқы сұйықтық үздіксіз ауысып тұрады. Диализді өте ұзақ жүргізетін болсақ, ермелерден ғана тазартылмай, жүйеден стабилизаторлар да кетіп қалуы мүмкін. Ондай жағдайда жүйенің тұрақтылығы бұзылып, коагуляция болуы мүмкін. Электрдиализ. Диализдің жылдамдығын арттыру үшін араластырғыштар қолданады. Олар зольдің жақсы араласуын жеңілдетеді. Коллоидтарды, электролиттерден тазарту жылдамдығын көбейту үшін электр өрісін пайдаланып, иондардың бағытталған қозғалысын (миграциясын) арттырады. Мұндай диализді электрдиализ, ал оны жүзеге асыратын құралды электрдиализатор дейді. Электрдиализатордың сұлбасы төменгі 1.6-суретте көрсетілген.
1.6 - сурет. Электрдиализатордың сұлбасы. 1-3 — құралдың еріткіш (су) циркуляцияланатын бөлігі; 2 — коллоидтық ерітінді құйылған құралдың бөлігі; 4-араластырғыш; 5 -жарғақтар; 6 -электродтар. |
|



 немесе
немесе  >>0 (3)
>>0 (3) (7)
(7) (8)
(8) - өлшемсіз шама; а - бөлшектердің орташа өлшемі.
- өлшемсіз шама; а - бөлшектердің орташа өлшемі.
 [пептизатор] [тұңба]
[пептизатор] [тұңба]