|
|
Электролитпен коагуляциялау кинетикасы 22 глава Бұл жағдайда жүйеде седиментациялық- диффузиялық тепе-теңдік орын алады. Бұл теңдеуді интегралдап, айнымалы шамаларға бөліп, мыналарды аламыз:
Мұндағы:
Соңғы теңдеулерді Лаплас- Перреннің гипсометрлік заңы деп атайды. Бұл жағдайда жүйе седиментациялық тұрақты, бірақондағы бөлшектер бірқалыпты емес тепе- теңдік таралады. Бұл таралу Мысал ретінде дисперстік фазасы бөлшектері шар тәрізді болатын кремний диоксиді SiO2, ал дисперстеуші ортаның тығыздығы
1 кесте SiO2 –нің седиментациялық жылдамдығын бөлшектердің өлшеміне тәуелділігі
Кестеден лиофобтық кірнелерде седиментация өте баяу жүретінін байқауға болады. Сонымен, дисперстік жүйелерде седиментация тұрақтылық негізінен дисперстік фаза бөлшектерінің өлшемімен анықталады: 1. Лиофобтық кірнелер (10-7-10-5 см)-седиментациялық тұрақты жүйелер; оларға бөлшектерді жүйенің бүкіл көлемі бойынша бірқалыпты таралуды қамтамасыз ететін диффузия тән болады. 2. Микрогетерогендік жүйелерде (10-5-10-3 см) седиментациялық- диффузиялық тепе-теңдік орнығады; оларға бөлшектердің жүйенің бүкіл көлемі бойынша гипсометрлік таралуы тән болады. 3. Макрогетерогендік (дөрекі дисперстік) жүйелер (r
Коллоидтық ерітінділердің агрегаттық тұрақтылығы. Коагуляция Агрегаттық тұрақтылықдеп- дисперстік жүйелердің уақыт бойынша дисперстік дәрежелерін, яғни бөлшектердің өлшемін өзгертпей сақтап қалу қабілеттілігін айтады. Коагуляцияның екі сатысы болады:
3. Коагуляция және электролиттік коагуляцияның ережелері мен ерекшеліктері. Коагуляция деп коллоидтык бөлшектердің әртүрлі факторлардың әсерінен бірігіп іріленуін айтады. Коагуляцияны екі сатыдан тұратын процесс ретінде қарастыруға болады: 1. Жасырын коагуляция, оны көзбен көре алмаймыз, тек ультрамикроскоппен байқауға болады. 2. Айқын коагуляция, ол кезде оны қарапайым көзбен көруге болады. Лиофобтық кірнелерде жасырын коагуляция өте аз жүреді, ол өте жылдам айқын коагуляцияға ауысады. Ал ҮМЗ ерітінділерінде жасырын коагуляция өте ұзақ жүреді, тек коагуляция процессі аяқталарда ғана тоңазытпа (сірне), (кілегей массаның) пайда болғанын байқауға болады. Коагуляцияға әсер ететін факторлар: температура, механикалык әсерлер, ультрацентрафугалау, жоғарғы тиімділікті тербелістер, сәуле, электр өрісі, жүйеге басқа заттың енуі (әсіресе электролиттің) және т.б.. Олардың ең маңыздысы және көбірек зерттелген фактор-электролит. Енді электролит әсерінен болатын коагуляцияға тоқталайық. Электролиттік коагуляция.Кірнелердің тұрақтылығының электролит әсерінен өзгеруі коллоидтық жүйелерді алғашқы зерттеушілердің (Ф.Сельми, Т.Грем, М.Фарадей, Г.И.Борщев) жұмыстарынан-ақ белгілі болатын. Кейін келе Г.Шульце, У.Гарди, Г.Пиктон, О.Мендер, Г.Френдлих, В.Паули, Н.Песков, А.В.Думанский т.б зерттеушілердің жүмыстарының нәтижесінде көптеген мәліметтер жиналып және теориялық негізгі қорытындылар да жасалды. Электролиттік коагуляция теориясының дамуына В.Б.Дерягин, Г.А.Ребиндер және оның мектебі, Ю.М.Глазман т.б үлкен үлес қосты. Электролиттік коагуляцияның ережелері деп аталатын, тәжірибе жүзінде көрсетілген олардың негізгі заңдылықтарын қарастырайық. 1. Коагуляция табалдырығы. Коагуляцияны кез келген электролит тудыра алады, тек оның айқын жылдамдықта жүруі электролиттің белгілі бір концентрациясында болады. Электролиттің айқын коагуляцияны тудыратын ең аз концентрациясын "коагуляция табалдырығы" деп атайды. Оны көбінде 1 литр кірнедегі милимоль, иә милиграмм. экв.көрсетеді (
Электролиттің коагуляция тудыратын иондарды, әрқашанда таңбасы жағынан коллоидтық бөлшектердің таңбасына қарама қарсы болады, яғни оң зарядты коллоидтық бөлшектерді теріс зарядты иондар, ал теріс зарядты коллоидтық бөлшектерді оң зарядты иондар коагуляциялайды. Мысалы, Ғе(ОН)3 золі үшін аниондар, ал МпО2 үшін катиондар.
З. Валенттілік ережесі (Шульце-Гардидің І ережесі ). Электролиттің коагуляциялық қабілеттілігі коагулятордың, яғни иондардың валенттілігі артқан сайын күшейеді. Бүл заңдылықты Шульце-Гарди ережесі деп те атайды. Оны алғаш Шульце (1882ж), кейін Гарди (1910ж) күкіртті қалайыны зерттей отырып көрсеткен болатын. Мысалы, Sn2S3 үшін катиондардың (К+,Ва++, А1+++) коагуляция табалдырығы мынандай қатынаста болады:
4. Коагуляцияның лиотроптық қатары. (Шульце-Гардидің ІІ ережесі). Бірдей зарядты иондардың коагуляциялық қабілеттіліктері шамалас болғанмен, олардың размерлері мен гидратталу көрсеткіштеріне байланысты екенін байқауға болады. Бірдей иондардың коагуляциялық кабілеттіліктері өзімізге белгілі лиотроптық қатар бойынша сипатталады. Айта кететін бір жағдай органикалық иондардың валенттілігі өздерімен бірдей бейорганикалық иондарға қарағанда коагуляция қабілеттілігі әлдеқайда жоғары болады. 5. Партнер (серік) - иондардың әсері. Егер бейорганикалық иондардың каогуляциялық қабілеттілігін қарастыратын болсақ олардың партнер иондарын бірдей валентті басқа партнермен ауыстырғанда, онда ешқандай өзгеріс болмайды. Мысалы, As2S3 золі үшін KC1, иә KNO3 алсақ, олардың айырмашылығы болмайды, сол сияқты Ғе (ОН)3 золі үшін КС1 мен NaCl айырмашылығы болмайды. Бірақ тағы да бұл ережені органикалық иондарға қолдануға болмайды. Мысалы As2S3 золі үшін К+ ионының коагуляциялану қабілеттілігі хлоридтен ацетатқа ауысқанда 2 есе, ал хлоридтен цитратқа ауысқанда 5 есе артады екен. Бұл Траубе ережесіне керісінше бағынады. 6. Коагуляция мен ξ потенциалдардың байланыстылығы. Көпшілік жағдайда неғүрлым ξ потенциял мәні аз болса, соғұрлым коагуляция жылдам болады. Алайда лиофобтық кірнелердің коагуляциясы ξ – ның мәні нольге жетпей-ақ (яғни изоэлектрлік жағдайға жетпей-ақ) болады. Сол ξ потенциалының айқын коагуляция болатын ең үлкен мәнін дағдарыстық (кризистік) потенциал деп атайды. Осы кризистік потенциалдың ξ мәні аз болған сайын коагуляция жылдамдығы арта түседі, ал ең үлкен жылдамдық ξ = 0 болғанда ғана болады. Көпшілік жағдайда лиофобтық кірнелер үшін кризистік потенциал бірдей болады. Мысалы 0,03В шамасында болады. ξ потенциалмен коагуляцияның байланысын иондардың дұрыс емес қатарлар құбылысынан айқын көруге болады. Дұрыс емес қатарлар құбылысы.Көп валентті иондар (Ғе+3 , А1+3, Тһ+4) және сол сияқты
Әрине бұл құбылыс көп валентті иондардың әсерінен қайта зарядталу құбылысына негізделген. Суреттегі штрихталған аймақ коагуляция зоналары, ал олардың арасында тұрақтылық зонасы, оның ең үлкен мәні В нүктесінде болады. 7. Кірнелердің (үйреншіктену) әдеттену құбылысы. Бұл құбылыс XX ғасырдың басында байқалған болатын. Егер кірнеге электролитті аз қарқынмен (аз-аздап) қосатын болсақ, онда оның каогуляциялық қабілеттілігі азаяды (керісінше коагуляциялық табалдырығы көбейеді), әрине электролитті бірден қосқанға қарағанда. Кейбір жағдайларда керісінше коагуляция қабілеттілігі артады. Оны теріс әдеттену деп атайды. Бұл құбылыстарды әртүрлі түсіндіреді.
8. Электролиттің қоспаларының коагуляциясы. Кірнелердің екі электролиттік қоспасымен коагуляциялаған кезде мынадай үш жағдайды байқауға болады: 1. Аддитивтік құбылыс. Бұл жағдайда электролиттердің әсерлері 2. Иондардың антоганизмі. Иондардың бір-біріне қарама-қарсы әсерінен коагуляция үшін аддитивтік ережесінен де көбірек электролит жұмсалады. Көбінде электролиттердің адсорбциялық қабілеттілігі әртүрлі болып келгенде байқалады. Ол кезде электролиттер бірінің әсерін бірі жояатындықтан олардың мөлшері аддитивтік ережесінен көп болады ( 1.10 - суреттегі 2 қисық). 3. Иондардың синергизмі. Бұл кезде электролиттер бірінің әсерін күшейтіп екі электролиттің қоспасының коагуляцияға жүмсалатын мөлшері аддитивтік ережесінен аз болады. Бұл синергизм құбылысын алдын-ала қандай жағдайларда болатынын жалпы түрде айту қиын. ( 1.10 - суреттегі 3 қисық).
Сурет. 9. Кірнелердің өзара коагуляциялануы. Егер зарядтары бір-біріне қарама-қарсы екі кірнені бір-біріне қосса, онда да коагуляцияның жүргенін байқауға болады. Өйткені бірінші кірненің қарсы иондары екінші кірнеге коагулянт ретінде, және керісінше, екінші кірненің қарсы иондары бірінші кірнеге коагулянт ретінде эсер етеді. Мысалы, Ғе(ОН)3 оң зарядты кірне , ал МпО2 теріс зарядты кірне. Оларды өзара араластырғанда өзара коагуляциялану болатынын байқауға болады. 10. Коллоидтық қорғау. Алтын саны Лиофобтық кірнелердің бөліну шекарасында еркін беттік энергия болатындықтан бет адсорбциялық қабат түзуге бейім болады. Ондай қабаттарды БАЗ немесе белоктардың молекулалары түзеді. Адсорбциялық қабат бөлшектердің барлық бетін жабуы міндетті емес. Беттің 40-60% жабылғанда жүйе тұрақтануы мүмкін. Әрине максималды тұрақтылық толық мономолекулалық қабат түзілгенде болады. Мысалы, алтынның кірнесіне желатинді қоссақ, белок бөлшектеріне адсорбцияланып, олардың сыртында қорғағыш қабыршақ түзеді. Желатиннің иондық беті бөлшектерге қосымша оң да, теріс те заряд береді. Белоктың беті су молекулаларын адсорбциялап қосымша қорғауды қамтамасыз етеді. Енді алтын кірнесіне қосылған натрий хлориді коллоидтық қорғау болмаған кездегіге қарағанда әлсіздеу әсер етеді. Нәтижесінде бөлшектер тұнбайды. Р.Зигмонди «алтын саны» деген термин енгізді, ол коллоидтық қорғауды сандық түрде сипаттау үшін қажет. Жоғары дисперсті коллоидтық алтынның түсі қызыл болады, оған электролит қосқанда, алтынның дисперстілігі азайып, оның түсі көк болады. Алтын саны деп 10 мл қызыл алтынның кірнесінің түсін 1 мл 10%-дық NaCl қосқанда көк түске өзгертпейтін коллоидтық қорғаудың милиграммен өрнектелген мөлшерін айтады. Алтын саны аз болған сайын коллоидтық қорғау әсері көп болады. Әртүрлі коллоидтық қорғаулардың әсерлері де әртүрлі болады, ендеше, олардың алтын саны да әртүрлі болады. Кірнелердің табиғатына байланысты күміс саны күміс кірнелері үшін, күкірт саны күкірт кірнелері үшін, рубин саны рубин кірнелері үшін және т.б. анықталған.
4. Лиофобтық кірнелердің тұрақтылық факторлары Тұрақтылық факторы немесе баяулату коэффиценті W жылдам коагуляцияның жылдамдық константасынан Кжк баяу коагуляцияның жылдамдық константасы Кбк неше есе аз екендігін көрсететін шама:
Тұрақтылық факторларының негізгі бесеуін айтып өтейік, олардың ішінде алғашқы екеуі маңызды рөл атқарады: 1. Тұрақтылықтың электростатикалық факторы; 2. Тұрақтылықтың адсорбциялы- сольваттық факторы; 3. Тұрақтылықтың құралымды-механикалық факторы; 4. Тұрақтылықтың энтропиялық факторы; 5. Тұрақтылықтың гидродинамикалық факторы;
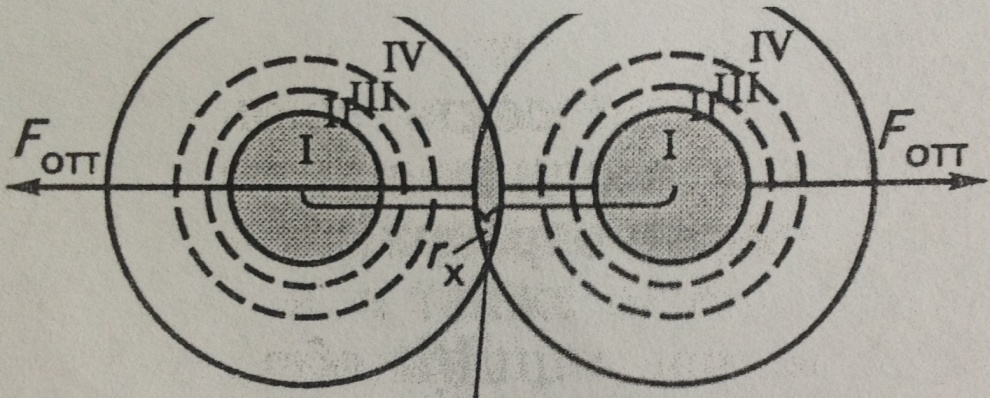
1. Тұрақтылықтың электростатикалық факторы. Оған коллоидтық жүйеде ҚЭҚ қос электрлік қабат және дисперстік фаза бөлшектерінің бетінде Бұл фактор дисперстік фазаның зарядты бөлшектеріне тұрақтандырудың негізгі факторы болып табылады. Мицелланың әртүрлі бөліктерінің қалдықтарын rI,rII,rIII,және rIV, деп алайық. I - ол мицелланың агрегаты, II - агрегатқа потенциал анықтағыш иондар адсорбцияланған бөлігі, III - ол екінші бөлікке қарсы иондардың адсорбцияланған бөлігі, ал IV - ең соңғы бөлік, яғни қарсы иондардың диффузиялық қабаты. (1-суретті қара)
Жабылу аймағы Егер дисперстік фаза бөлшектерінің орбиталарының арасындағы қашықтық rx > 2(rI+rII+rIII+ rIV) болса, онда мицеллалар өзара жанаспайды, ендеше олардың арасындағы электрстатикалық тебілу күштерінің шамасы өте аз болады. Егер мицелланың IV бөліктері өзара жабысатын болса ( яғни ... суреттегідей диффузиялық қабат өзара ...), онда жағдай өзгеше болады. Ол егер rx мынадай аралықта болғанда жүзеге асады: 2(rI+rII+rIII) < rx < 2(rI+rII+rIII+ rIV) . Мицеллалардың IV бөліктерінің өзара жабылуы дисперстік фаза бөлшектерінің арасында электрстатикалық тебілу күштерінің (Fтб) пайда болғанын білдіреді, өйткені ол бөлшектердің зарядтарының таңбалары бірдей. Әрине қосымша электрстатикалық күштердің болуы бөлшектердің бірігуіне кедергі жасайды, соның салдарынан ΔU-да, агрегаттық тұрақтылық та артады. Дисперстік фаза бөлшектерінің заряды көп болған сайын олардың артуы да көп болады.
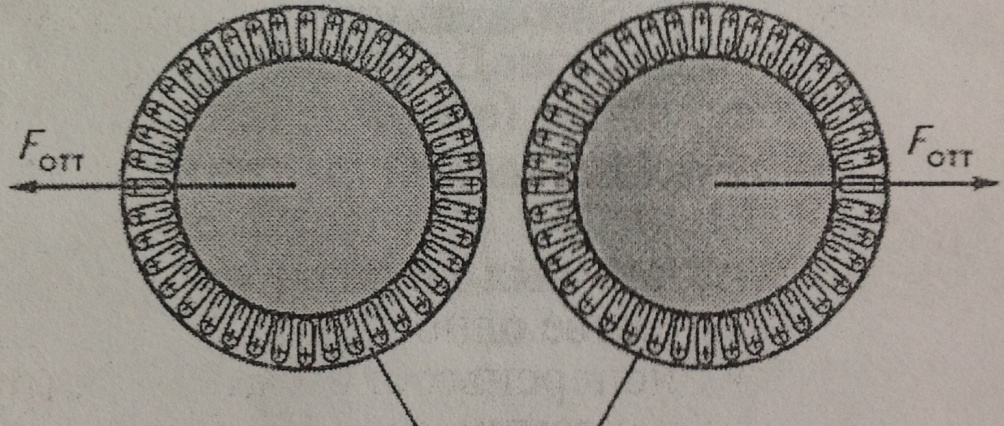
2. Тұрақтылықтың адсорбциялы-сольваттық факторы. Ол дисперстеуші ортаның дисперстік фаза бөлшектерімен әрекеттесу нәтижесінде беттік керілудің төмендеуінен болады. Бұл фактордың әсері әсіресе стабилизаторлар ретінде коллоидтық бетті активтік БАЗ затты пайдаланғанда күштірек байқалады. Дисперстік жүйенің 2 сольватталған (су болса гидратталған) бөлшектерінің өзара әрекеттесуінің қарапайым жағдайын қарастырайық (2-суретті қара). Дисперстік фаза бөлшектерінің сыртында сольваттық қабаттар түзіледі (лиофильдік жүйелер үшін олар айтарлықтай созылыңқы және тұрақты болады). Әрине оларды еріткіштің полярлы молекулалары түзеді. Дисперстік фаза бөлшектерінде Ван-дер-Ваальстік тартылу күштерінің әсерінен полярлы молекулалар 2 бөлшектерде де бетке бірдей бағыттылып (2-суреттегідей) орналасады.
Сольваттық қабаттар
Дисперстік фаза бөлшектері тығыз жанасқанда олардың арасында, яғни сольваттық қабаттағы бірдей зарядты иондарының арасында, электрстатикалық тебілу (Fтб) күштері пайда болады. Әрине осы күштердің артуымен потенциалдық тосқауыл да, агрегаттық тұрақтылық та симбатты түрде артады. Сольваттық фактордың әсері лиофильдік жүйелер үшін жақсы болады, ал лиофобтық коллоидтық үшін әлдеқайда төмен болады. 3. Тұрақтылықтың құралымды-механикалық факторы. Ол дисперстілік тұрақтылықтың фаза бөлшектерінің бетінде бұзуға уақыт пен энергия шығынын қажет ететін серпімділік пен механикалық мықтылық қасиет көрсететін қабыршықтардың пайда болуынан болады. Тұрақтылықтың бұл факторы стабилизатор ретінде үлкен моллекулалық қосылыстар (ҮМҚ) пайдаланғанда жүзеге асады. |
|
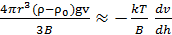



 - ыдыстың түбіндегі бөлшектер концентрациясы;
- ыдыстың түбіндегі бөлшектер концентрациясы;  ыдыс түбінен
ыдыс түбінен  биіктіктегі бөлшектер концентрациясы; А- берілген жүйе үшін тұрақты сан.
биіктіктегі бөлшектер концентрациясы; А- берілген жүйе үшін тұрақты сан.
 немесе:
немесе: 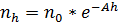 (1.8)
(1.8) см болғанда байқалады.
см болғанда байқалады. ; ал тұтқырлығы
; ал тұтқырлығы  . 1-ші кестеде дисперстік фаза бөлшектерінің радиусына байланысты седиментация туралы мәліметтер келтірілген.
. 1-ші кестеде дисперстік фаза бөлшектерінің радиусына байланысты седиментация туралы мәліметтер келтірілген. 10-3 см) седиментациялық тұрақсыз жүйелер, оларда жылдам седиментация болады.
10-3 см) седиментациялық тұрақсыз жүйелер, оларда жылдам седиментация болады. ) сәулелендіру, механикалық әсерлер, электролит қосу және т.б.
) сәулелендіру, механикалық әсерлер, электролит қосу және т.б.
 ). Коагуляция табалдырығына кері шаманы электролиттің коагуляциялық қабілеттілігі деп аталады кейде оны коагуляция күші (Р) деп те атайды). Әрине бүл айтылған шамалар бірдей электролиттер үшін әртүрлі кірнелерде әртүрлі болады.
). Коагуляция табалдырығына кері шаманы электролиттің коагуляциялық қабілеттілігі деп аталады кейде оны коагуляция күші (Р) деп те атайды). Әрине бүл айтылған шамалар бірдей электролиттер үшін әртүрлі кірнелерде әртүрлі болады. немесе
немесе 
 = 49.5 : 0.69 : 0.093 (ммоль) 1л кірнеге Егер
= 49.5 : 0.69 : 0.093 (ммоль) 1л кірнеге Егер  ионының коагуляция қабілеттігін 1 деп есептесек , онда :
ионының коагуляция қабілеттігін 1 деп есептесек , онда :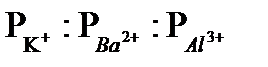
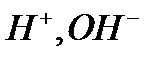 иондарын кірнеге концентрациясын арттыра отырып қосқанда мынадай құбылысты байқауға болады: алдымен олардың концентрациясы коагуляция табалдырығына жеткенде коагуляция болады да (бұны коагуляцияның бірінші зонасы деп атайды), одан әрі олардың концентрациясы өскен сайын кірненің тұрақтылығы арта түседі (тұрақтылық зонасы); Ал концентрация белгілі бір шамаға жеткенде қайтадан коагуляция басталады (коагуляцияның екінші зонасы).Осындай коагуляцияның бірде болып бірде болмауын “коагуляция зоналары” иә “дұрыс емес қатарлар құбылысы” деп атайды. Бұл құбылыс келесі суретте көрсетілген.
иондарын кірнеге концентрациясын арттыра отырып қосқанда мынадай құбылысты байқауға болады: алдымен олардың концентрациясы коагуляция табалдырығына жеткенде коагуляция болады да (бұны коагуляцияның бірінші зонасы деп атайды), одан әрі олардың концентрациясы өскен сайын кірненің тұрақтылығы арта түседі (тұрақтылық зонасы); Ал концентрация белгілі бір шамаға жеткенде қайтадан коагуляция басталады (коагуляцияның екінші зонасы).Осындай коагуляцияның бірде болып бірде болмауын “коагуляция зоналары” иә “дұрыс емес қатарлар құбылысы” деп атайды. Бұл құбылыс келесі суретте көрсетілген. 1.9 – сурет.
1.9 – сурет.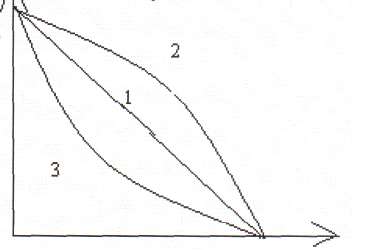
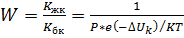
 потенциалының болуы себеп болады. Бөлшектердің әрқайсысы бірдей зарядталғандықтан, олар өзара жақындағанда электростатикалық тебілу күштерінің әсерінен бірін-бірі теуіп біріктейтіндіктен, жүйе тұрақтылыққа ие болады.
потенциалының болуы себеп болады. Бөлшектердің әрқайсысы бірдей зарядталғандықтан, олар өзара жақындағанда электростатикалық тебілу күштерінің әсерінен бірін-бірі теуіп біріктейтіндіктен, жүйе тұрақтылыққа ие болады.