|
|
Углеводы: моно-, ди- и полисахаридыФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ТАМБОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМ. Г.Р. ДЕРЖАВИНА
Романцова С.В., Панасенко А.И., Розенблюм Л.В. БиоОРГАНИЧЕСКая ХИМИя
В ВОПРОСАХ И ОТВЕТАХ В двух частях Часть 2
Допущено Редакционно-издательским советом ТГУ им. Г.Р. Державина в качестве учебно-методического пособия для студентов, обучающихся по специальности 060101 – «Лечебное дело»
Тамбов 2013
Рецензенты: доктор медицинских наук, профессор Османов Э.М.; кандидат химических наук, доцентКнязева Л.Г.
ОГЛАВЛЕНИЕ
Введение Целью курса биоорганической химии, как учебной дисциплины, является формирование системных знаний о взаимосвязи строения и химических свойств биологически важных классов органических соединений, биополимеров и их структурных компонентов в качестве основы для понимания сути жизненных процессов на современном молекулярном уровне. В преподавании биоорганической химии большое внимание уделяется самостоятельной работе студентов. В данном пособии приводятся подробные ответы на самые распространённые вопросы, возникающие у студентов в процессе освоения второй части курса, обсуждаются вопросы химической идентификации биологически важных органических соединений. Используя данные пояснения, студенты в ходе самоподготовки учатся общему подходу и логике рассуждения, что облегчает выполнение контрольных и тестовых заданий. углеводы: моно-, ди- и полисахариды Вопрос 1. Какие соединения называются углеводами? Ответ. Углеводы – класс природных органических веществ, являющихся гетерофункциональными соединениями, содержащими одновременно карбонильную и гидроксильные функциональные группы (т.е. это многоатомные альдегидо- или кето-спирты или продукты их конденсации). Термин «углеводы» воз-ник в середине XIX века в связи с тем, что в молекулах многих углеводов соотношение атомов водорода и кислорода такое же, как и в молекулах воды, т.е. на два атома водорода приходился один атом кислорода, и молекулу углевода можно представить как состоящую из углерода (угля) и воды. Например, для глюкозы (С6Н12О6) формула может иметь вид С6(Н2О)6, формулу сахарозы (С12Н22О11) можно записать как С12(Н2О)11, а в общем виде – Сn(Н2О)m. Позже стали известны природные углеводы, которые не отвечают приведённой общей формуле (Сn(Н2О)m), тем не менее, термин «углеводы» используется и в настоящее время, наряду с термином «сахариды» или просто «сахара». Вопрос 2. Какие функции выполняют углеводы? Ответ.Углеводы образуются в растениях в результате фотосинтеза из углекислого газа и воды. Животные организмы не способны синтезировать углеводы, и получают их с растительной пищей. Таким образом, углеводы входят в состав всех живых организмов и являются одними из самых распространённых органических веществ на Земле. Функции углеводов: – структурная и опорная функции (целлюлоза является основным структурным компонентом клеточных стенок растений, хитин выполняет аналогичную функцию у грибов, а также обеспечивает жёсткость экзоскелета членистоногих); – защитная роль (у некоторых растений есть защитные образования: шипы, колючки и др., состоящие из клеточных стенок мёртвых клеток; – энергетическая функция (при окислении 1 г углеводов выделяются 4,1 ккал энергии); – пластическая функция (входят в состав сложных молекул, например, рибоза и дезоксирибоза участвуют в построении АТФ, ДНК и РНК); – запасающая функция (углеводы выступают в качестве запасных питательных веществ: гликоген у животных, крахмал и инулин – у растений); – осмотическая функция (участвуют в регуляции осмотического давления в организме, в т.ч. в крови); – рецепторная функция (входят в состав воспринимающей части многих клеточных рецепторов). Многие углеводы и их производные находят применение в фармации и медицине. Углеводы служат исходными веществами для промышленного производства бумаги, искусственных волокон, взрывчатых веществ, этилового спирта и т.д. Вопрос 3. Как классифицируются углеводы?
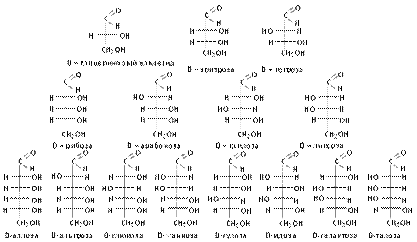
Простые углеводы, содержащие кетогруппу, называются кетозами, альдегидную группу – альдозами. В зависимости от числа атомов углерода монозы делят на триозы (три атома углерода), тетрозы (четыре атома), пентозы (пять атомов), гексозы (шесть атомов) и гептозы (семь атомов). Например, глюкоза содержит в молекуле альдегидную группу и шесть атомов углерода, её называют альдогексозой; фруктоза содержит карбонильную группу (является многоатомным кетоспиртом) и шесть атомов углерода, её называют кетогексозой. Рибоза является альдопентозой. Природные монозы, как правило, содержат неразветвлённые цепи атомов углерода.
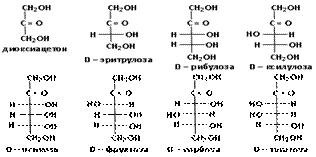
Углеводы, гидролизующиеся с образованием большого количества (до нескольких тысяч) молекул простых углеводов, называются полисахаридами. Полисахариды являются высокомолекулярными соединениями. К ним относятся, например, крахмал и целлюлоза (клетчатка). Сложные углеводы можно рассматривать, как продукты поликонденсации моносахаридов. Если полисахариды построены из остатков одного моносахарида, то их называют гомополисахаридами; если из остатков разных моносахаридов, то – гетерополисахаридами. Среди гомополисахаридов наиболее биологически важными являются крахмал, гликоген, целлюлоза, среди гетерополисахаридов – альгиновые кислоты, агар (содержащиеся в водорослях); полисахариды соединительной ткани (хондроитинсульфаты, гиалуроновая кислота, гепарин). Молекулы углеводов входят в состав смешанных биополимеров, например углевод-белковых биополимеров (гликопротеины, протеогликаны) или углевод-липидных (гликолипиды). Вопрос 4. Являются ли моносахариды оптически активными соединениями? Как изобразить энантиомеры моносахаридов? Ответ. Молекулы моносахаридов (кроме диоксиацетона) содержат центры хиральности (асимметрические атомы углерода), что является причиной существования стереоизомеров. Например, в альдогексозе имеются четыре асимметрических атома углерода и ей соответствуют 16 стереоизомеров (24 = 16), образующих 8 пар. В альдопентозе три асимметрических атома углерода и ей соответствуют 8 стереоизомеров (23 = 8), образующих 4 пары.
В формулах Фишера углеродная цепь записывается вертикально и нумеруется с того конца, к которому ближе альдегидная или кетогруппа, т.е. с верхнего углеродного атома. Асимметричные углеродные атомы символом «С» не обозначаются, подразумевается, что они находятся на пересечении вертикальных и горизонтальных линий.
Рассмотрим в качестве примера изомеры фруктозы:
В обеих формулах содержится по три асимметрических (хиральных) атома углерода. Это атомы 3, 4 и 5. Наиболее удалены от кетогруппы (С=О) хиральные атомы под номером 5. В формуле (1) конфигурация пятого атома углерода соответствует конфигурации хирального атома в молекуле D-глицеринового альдегида (ОН группа расположена справа, атом водорода – слева). Таким образом, первый изомер относится к D-ряду, это D-фруктоза. Конфигурация пятого атома углерода в формуле (2) соответствует конфигурации L-глицеринового альдегида, т.е. это L-фруктоза. Подавляющее большинство природных моносахаридов принадлежит к D-ряду. Вопрос 5. Встречаются ли моносахариды в природе в свободном виде? Ответ. Самым распространённым природным моносахаридом является D-глюкоза – виноградный сахар или декстроза от лат. dextrus – правый, т.к. обычная природная D-глюкоза имеет удельное вращение + 52,5о, т.е. вращает плоскость поляризации плоскополяризованного света на 52,5о вправо. В свободном виде содержится в крови, являясь основным энергетическим субстратом для мозга. Постоянный уровень глюкозы поддерживается с помощью гормона инсулина, уменьшающего концентрацию глюкозы в крови, а также глюкагона, адреналина и других гормонов, увеличивающих её концентрацию. При сахарном диабете инсулин вырабатывается поджелудочной железой в недостаточном количестве, что приводит к увеличению её концентрация в крови. Интересно, что L-глюкоза, являясь энантиомером обычной природной D-глюкозы, также является сладкой, но не усваивается организмом, поэтому она может быть использована как заменитель сахара. В свободном виде глюкоза содержится также в зелёных частях растений, в различных фруктах и мёде. Входит в состав крахмала, гликогена, целлюлозы, гемицеллюлоз, декстранов, сахарозы, мальтозы и многих гликозидов. D-фруктоза – плодовый сахар или левулёза от лат. laevus – левый, т.к. водные растворы D-фруктозы имеют удельное вращение - 92,4o. Фруктоза содержится в зелёных частях растений, в нектаре цветов, в плодах, в мёде. Входит в состав сахарозы, а также многих полисахаридов. D-галактоза. В свободном кристаллическом виде выделяется на плодах плюща. Встречается в качестве составной части некоторых дисахаридов (лактоза) и полисахаридов (хондроитин, агар-агар, гемицеллюлозы) Вопрос 6. Как написать формулу L-изомера галактозы, если известна формула D-изомера? Ответ.Для того, чтобы написать формулуэнантиомера, необходимо изобразить в зеркальном отражении заместители у всех асимметрических атомов углерода. Запишем формулу D-галактозы, выбрав из схемы, приведённой ниже и поменяем расположение заместителей (–Н и –ОН) у 2, 3, 4 и 5 атомов углерода:
В результате получаем формулу энантиомера D-галактозы
Название энантиомера: L-галактоза.
Вопрос 7. В чём состоит различие между диастеромерами, эпимерами и энантиомерами? Ответ.Стереоизомеры углеводов, отличающиеся конфигурацией одного или нескольких асимметрических атомов углерода, называются диастереомерами, например: D-аллоза и D-манноза; D-фруктоза и L-тагатоза и т.д. Эпимеры и энантиомеры – частные случаи диастереомеров. Диастереомеры, относящиеся друг к другу как предмет к своему зеркальному изображению, называются энантиомерами. Энантиомеры имеют одинаковые физические и химические свойства, отличаются эти изомеры только направлением вращения плоскости поляризации плоскополяризованного света. Различается также биологическая активность энантиомеров. Если диастереомеры различаются конфигурацией только одного асимметрического атома углерода, то их называют эпимерами. Если различается конфигурация второго атома углерода, то такие диастереомеры называют просто эпимерами; если других атомов углерода, то к названию добавляется номер этого атома. Например, D-рибоза и D-арабиноза отличаются конфигурацией только второго атома углерода и являются эпимерами. D-аллоза и D-глюкоза отличаются конфигурацией только третьего атома углерода и являются 3-эпимерами, а D-аллоза и D-гулоза – 4-эпимерами. Эпимеры имеют различные физические и оптические свойства, а также биологическую активность. Вопрос 8. Как определить, являются ли диастереомерами D-аллоза и L-идоза? Ответ.Дляэтого надо написать формулы этих альдоз. Формула D-аллозы приведена на схеме (см. вопрос 6). L-идоза являются энантомером D-идозы, т.е. их молекулы относятся друг к другу как предмет и его зеркальное изображение и, зная формулу D-идозы легко записать формулу L-идозы (см. вопрос 6): Диастереомеры, по определению, должны отличаться конфигурацией одного или нескольких асимметрических атомов углерода. Из рассмотрения формул D-аллозы и L-идозы следует, что конфигурации второго и четвёртого атомов углерода у них одинаковы (и в молекуле D-аллозы и в молекуле L-идозы ОН группы у этих атомов расположены справа, а атомы водорода – слева).
Конфигурации третьего и пятого атомов углерода отличаются (в молекуле D-аллозы ОН группы находятся справа от углеродной цепи, а в молекуле L-идозы – слева). Таким образом, D-аллоза и L-идоза отличаются конфигурацией двух асимметрических атомов углерода: третьего и пятого, и, следовательно, являются диастереомерами. Вопрос 9. Как определить, являются ли эпимерами D-глюкоза и D -манноза?
Эпимеры являются частным случаем диастереомеров и, по определению, должны отличаться конфигурацией только одного асимметрического атома углерода. Из рассмотрения формул D-глюкозы и D-маннозы следует, что у третьего атома углерода в обеих молекулах атом водорода расположен справа, а гидроксильная группа – слева; у четвёртого и пятого атомов углерода в обеих молекулах атом водорода расположен слева, а гидроксильная группа – справа; т.е. конфигурации третьего, четвёртого и пятого асимметрических атомов углерода у D-глюкозы и D-маннозы одинаковы. Конфигурация второго атома углерода отличается (в молекуле D-глюкозы ОН группа находится справа от углеродной цепи, а в молекуле D-маннозы – слева). Таким образом, D-глюкоза и D-манноза отличаются конфигурацией только одного (второго) асимметрического атома углерода и, следовательно, являются эпимерами. Вопрос 10. Как образуются циклические формы моносахаридов? Ответ.Циклические формы моносахаридов образуются в результате внутримолекулярного взаимодействия между карбоксильной и гидроксильной группами. Эти формы термодинамически более устойчивы, чем открытые формы молекул углеводов. Обычно возникают пятичленные (фуранозные) и шестичленные (пиранозные) циклы. В пространстве оказываются сближенными альдегидные (или кетонные) группы и гидроксильная группа при четвёртом или пятом (для альдоз) и пятом и шестом (для кетоз) атоме углерода. За счёт их взаимодействия и происходит замыкание циклов в молекулах моносахаридов. Шестичленный пиранозный цикл образуется при взаимодействии альдегидной группы с пятым атомом альдопентоз или альдогексоз; а также при взаимодействии кетогруппы с шестым атомом кетогексоз.
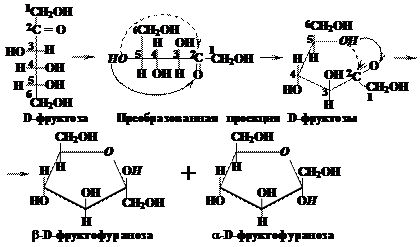
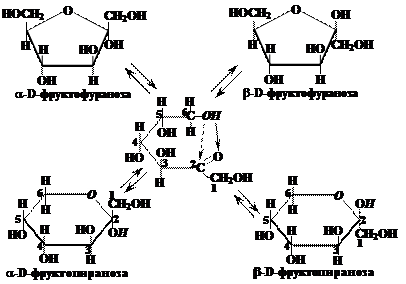
Пятичленный фуранозный цикл образуется при взаимодействии альдегидной группы с четвёртым атомом альдотетроз, альдопентоз и альдогексоз; а также при взаимодействии кетогруппы с пятым атомом кетопентоз и кетогексоз.
В результате образования цикла в молекуле альдогексозы у первого атома углерода вместо альдегидной группы появляется гидроксильная группа (у кетогексоз у второго атома углерода). Эта гидроксильная группа получила название гликозидной (полуацетальной) гидроксильной группы (гликозидный гидроксил). В названиях циклических форм к обозначению углевода добавляется окончание «пираноза» для шестичленного цикла или «фураноза» для пятичленного цикла. В циклической молекуле моносахарида увеличивается число асимметрических атомов углерода, т.к. асимметрическим становится атом углерода, который ранее входил в состав альдегидной или кетонной группы. В случае галактозы это первый, а в случае фруктозы – второй атом углерода. Этот атом получил название аномерного углерода. Появление дополнительного асимметрического атома приводит к увеличению числа оптических изомеров, соответствующих циклической форме, в два раза по сравнению с открытой формой. Так, для альдогексозы это уже не 16, а 32 изомера. Каждому изомеру открытой формы отвечают два изомера циклической формы (аномеры). У α-аномера конфигурация аномерного центра одинакова с конфигурацией асимметрического атома углерода, определяющего принадлежность к D- или L-ряду, а у β-аномера она противоположна. В проекционных формулах Фишера у моносахаридов D-ряда в α-аномере гликозидная гидроксильная группа находится справа, а в β-аномере – слева от углеродной цепи; для L-изомеров наоборот, в α-аномере гликозидная гидроксильная группа находится слева, а в β-аномере – справа от углеродной цепи. Аномеры являются диастереомерами и отличаются по своим свойствам (например, по температурам плавления). Аномеры можно рассматривать как частный случай эпимеров. Вопрос 11. Как изображаются циклические формы моносахаридов в виде перспективных формул Хеуорса?
Далее замыкают цепь и получают проекцию Фишера:
В названии циклической формы указывается: тип аномера (a или b), затем принадлежность к стереохимическому ряду: D- или L-; затем название моносахарида, производным которого является данная циклическая форма, без окончания «–за», то есть оставляем глюко-, манно-, фрукто- и т.д., в заключение указывается тип циклической формы (пираноза или фураноза). У альдогексоз D-ряда в пиранозной форме (и у альдопентоз и кетогексоз D-ряда в фуранозной форме) группа СН2ОН всегда располагается над плоскостью цикла, что служит формальным признаком D-ряда. Для L-ряда эта группа располагается под плоскостью цикла. Гликозидная группа –ОН у a-аномеров альдоз D-ряда оказывается под плоскостью, а у b-аномеров – над плоскостью цикла. Для соединений L-ряда гликозидный гидроксил у a-аномеров L-ряда оказывается над плоскостью, а у b-аномеров – под плоскостью цикла. Следуя приведённым выше правилам, можно написать формулы Хеуорса для фуранозных и пиранозных форм кетоз, например для фруктозы:
Вопрос 12. В каких формах (открытых или циклических) преимущественно находятся моносахариды в твёрдом состоянии и в растворе? Ответ.В твёрдом состоянии моносахариды находятся в циклической форме (преимущественно пиранозной). В растворах устанавливается равновесие между открытой формой и двумя парами циклических аномеров (цикло-оксо-таутомерное равновесие или цикло-цепная таутомерия). Различные формы молекул, находящихся в состоянии такого равновесия называются таутомерами. В смесях таутомеров преобладают пиранозные формы. Открытые формы и фуранозные циклы содержатся в малых количествах. Преобладание a- или b-аномера зависит от природы монозы, растворителя, концентрации и других внешних условий. Таутомерные формы углеводов могут переходить друг в друга, что приводит к пополнению количества той или иной формы по мере её расходования в каком-либо процессе. Равновесие между всеми формами является, таким образом, динамическим. Так, если какой-либо аномер глюкозы растворить в воде, он постепенно превращается в другой аномер, пока не образуется равновесная смесь двух аномеров, в которой также содержится очень небольшое количество открытой формы. Этот переход сопровождается изменением оптического вращения раствора, т.к. для каждого таутомера характерен свой угол вращения плоскости поляризации плоскополяризованного света. Такое явление называют мутаротацией моносахаридов.
Вопрос 13. Напишите a-фуранозную и b-пиранозную формы L-арабинозы. Изобразите их аномеры в виде проекций Фишера. Ответ. За исходное соединение необходимо взять D-арабинозу. Записываем её формулу и строим формулу её энантиомера (см. вопрос 6). L-арабиноза – альдопентоза. Её фуранозная форма образуется за счет взаимодействия альдегидной группы с гидроксилом четвертого углеродного атома; а пиранозная форма – за счет взаимодействия альдегидной группы с гидроксилом пятого атома углерода. При циклизации водород гидроксильной группы (С5 или С4) присоединяется к кислороду альдегидной группы за счет разрыва p-связи С–О, образуя полуацетальный, или гликозидный, гидроксил (заключен в рамку). Кислород гидроксильной группы у атома С4 или С5 после отщепления от него водорода соединяется с углеродом альдегидной группы у атома С1. Возникает кислородный мостик, связывающий атомы С1–С4 и замыкающий пятичленный цикл, или С1–С5 и замыкающий шестичленный цикл.
СН2ОН 5СН2ОН СН2ОН СН2ОН D-арабиноза L-арабиноза a-L-арабинофураноза b-L-арабинофураноза
D-арабиноза L-арабиноза a-L-арабинопираноза b-L-арабинопираноза
В полуацетальной форме первый атом углерода превратился в асимметрический. В результате этого при замыкании цикла из одной открытой альдегидной формы (оксоформы) получаются две циклические полуацетальные формы, отличающиеся одна от другой положением полуацетального гидроксила. Циклическая форма, у которой полуацетальный гидроксил расположен по одну сторону (в циc-положении) с гидроксилом, определяющим конфигурацию (принадлежность к D- или L-ряду) монозы, называется a-формой. Циклическая форма, у которой полуацетальный гидроксил находится в транс-положении с гидроксилом, определяющим конфигурацию, называется b-формой. a и b-Формы представляют собой диастереомеры, называющиеся аномерами. Вопрос 14. Какие соединения получаются при восстановлении D-глюкозы и D-фруктозы?
D-глюцит, как и D-глюкоза является оптически активным соединением, т.к. в его молекуле присутствует 4 асимметрических атома углерода (2, 3, 4, 5) и отсутствуют элементы симметрии.
При восстановлении кетоз получается смесь двух полиолов, т.к. атом углерода, входивший в состав кетогруппы, после восстановления становится асимметрическим и для него возможно двоякое расположение ОН группы и атома водорода в пространстве (как слева, так и справа от углеродной цепи). Например, для D-фруктозы имеем:
D-глюцит и D-маннит обладают оптической активностью. Многоатомные спирты, получающиеся при восстановлении моносахаридов, - кристаллические вещества, хорошо растворимые в воде; обладают сладким вкусом и могут использоваться, как заменители сахара при сахарном диабете (ксилит, сорбит).
Вопрос 15. При восстановлении каких альдогексоз образуются оптически неактивные шестиатомные спирты?
Вопрос 16. Какие соединения могут получаться при окислении L-галактозы? Будут ли эти соединения оптически активны? Ответ.Реакции окисления используются при биохимических анализах (например, анализ крови и мочи на сахар). Состав и строение продуктов окисления моносахаридов зависит от природы монозы и условий окисления (прежде всего от силы окислителя). Альдозы окисляются легче кетоз. Под действием мягких окислителей (аммиачный раствор оксида серебра, гидроксид меди, бромная вода) альдозы превращаются в альдоновые кислоты (альдегидная группа окисляется до кислотной карбонильной группы).
Внешний признак протекания реакции – образование на стенках пробирки слоя металлического серебра.
Внешний признак протекания реакции – превращение голубого осадка гидроксида меди (II) в красный осадок оксида меди (I). В) окисление бромной водой (внешний признак протекания реакции – обесцвечивание раствора брома):
Эта реакция может быть использована для обнаружения галактозы, т.к. слизевая кислота трудно растворяется в воде. Следует обратить внимание на тот факт, что, хотя в молекуле слизевой кислоты имеется четыре асимметрических атома углерода (2, 3, 4, 5), она не проявляет оптической активности, т.к. обладает плоскостью симметрии.
В организме уроновые кислоты выполняют очень важную функцию: они образуют с лекарственными веществами и продуктами их превращений (метаболитами), токсичными веществами водорастворимые гликозиды и выводят их из организма с мочой, отсюда происходит название уроновых кислот (лат. urina – моча). D-глюкуроновая и L-идуроновая кислоты и их производные являются структурными элементами различных полисахаридов (пектиновые вещества, гепарин, гиалуроновая кислота, хондроитин, гепарин и т.д.). В ходе метаболизма уроновых кислот синтезируется аскорбиновая кислота (у человека не синтезируется). Вопрос 17. Какие соединения могут получаться при окислении D-фруктозы? Будут ли эти соединения оптически активны? Ответ.Окисление кетоз происходит под действием сильных окислителей и сопровождается деструкцией углеродного скелета. Разрыв связи может происходить двумя способами: между первым и вторым, а также вторым и третьим атомами углерода. При этом все концевые атомы углерода окисляются с образованием карбоксильных групп. Так, при окислении D-фруктозы образуется четыре продукта реакции. При разрыве связи между первым и вторым атомами углерода образуются муравьиная и D-арабинаровая кислоты. При разрыве связи между вторым и третьим атомами углерода образуются щавелевая и мезовинная кислоты.
|
|

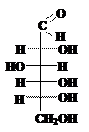 Ответ. Углеводы подразделяются на два класса: простые и сложные. Простые углеводы (моносахариды, монозы) не гидролизуются с образованием более простых углеводов. Примерами простых углеводов могут служить: глюкоза (С6Н12О6), рибоза (С5Н10О5), фруктоза (С6Н12О6).
Ответ. Углеводы подразделяются на два класса: простые и сложные. Простые углеводы (моносахариды, монозы) не гидролизуются с образованием более простых углеводов. Примерами простых углеводов могут служить: глюкоза (С6Н12О6), рибоза (С5Н10О5), фруктоза (С6Н12О6).
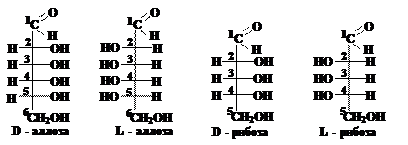 Члены одной пары являются антиподами или энантиомерами (их молекулы относятся друг к другу как предмет к своему зеркальному изображению). Энантиомеры имеют одно и то же название, но один из них относится к D-ряду, а другой – к L-ряду. Энантиомеры можно изобразить в виде незамкнутых проекционных формул Фишера, например:
Члены одной пары являются антиподами или энантиомерами (их молекулы относятся друг к другу как предмет к своему зеркальному изображению). Энантиомеры имеют одно и то же название, но один из них относится к D-ряду, а другой – к L-ряду. Энантиомеры можно изобразить в виде незамкнутых проекционных формул Фишера, например: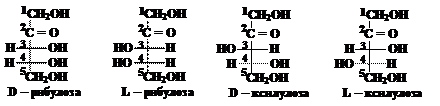 Молекула кетопентозы содержит 2 асимметрических атома углерода (третий и четвёртый) и образует 2 пары энантиомеров:
Молекула кетопентозы содержит 2 асимметрических атома углерода (третий и четвёртый) и образует 2 пары энантиомеров: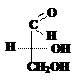
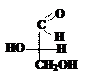 Принадлежность изомера к D- или L-ряду определяется сравнением конфигурации наиболее удалённого от карбонильной группы асимметрического атома углерода с конфигурацией изомеров глицеринового альдегида, который принят в качестве стандарта. Глицериновый альдегид содержит в молекуле один асимметрический атом углерода и имеет два энантиомера:
Принадлежность изомера к D- или L-ряду определяется сравнением конфигурации наиболее удалённого от карбонильной группы асимметрического атома углерода с конфигурацией изомеров глицеринового альдегида, который принят в качестве стандарта. Глицериновый альдегид содержит в молекуле один асимметрический атом углерода и имеет два энантиомера: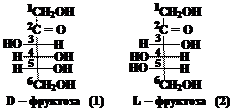
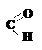
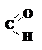 :
: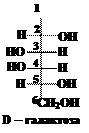
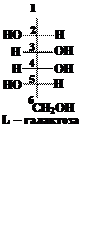
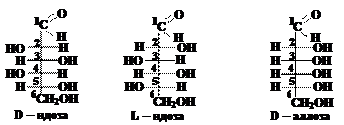
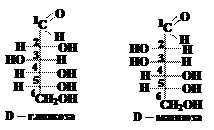 Ответ. Дляэтого надо написать формулы этих альдоз. Формула приведены на схеме (см. вопрос 6).
Ответ. Дляэтого надо написать формулы этих альдоз. Формула приведены на схеме (см. вопрос 6).

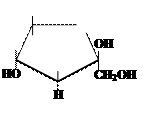
 Ответ.В системе Хеуорса циклы изображают в виде плоских пяти- или шестиугльников, расположенных перпендикулярно плоскости рисунка, поэтому линии, соответствующие передней части кольца выделяют более жирным шрифтом. Атом кислорода располагается в пиранозном цикле в дальнем правом углу, в фуранозном – также в дальнем правом углу или в середине задней части кольца. Гидроксильные группы и атомы водорода располагают перпендикулярно плоскости цикла. Символы атомов углерода в циклах обычно не пишутся.
Ответ.В системе Хеуорса циклы изображают в виде плоских пяти- или шестиугльников, расположенных перпендикулярно плоскости рисунка, поэтому линии, соответствующие передней части кольца выделяют более жирным шрифтом. Атом кислорода располагается в пиранозном цикле в дальнем правом углу, в фуранозном – также в дальнем правом углу или в середине задней части кольца. Гидроксильные группы и атомы водорода располагают перпендикулярно плоскости цикла. Символы атомов углерода в циклах обычно не пишутся.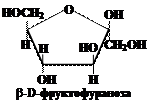
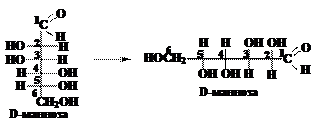 Чтобы написать формулу Хеуорса вначале изображают формулу Фишера и поворачивают её на 90о вправо (по часовой стрелке:
Чтобы написать формулу Хеуорса вначале изображают формулу Фишера и поворачивают её на 90о вправо (по часовой стрелке: Поворачивают на 90о атом углерода, связанный с гидроксильной группой, вступающей в реакцию циклизации. При построении маннофуранозы это будет четвёртый атом углерода, при построении маннопиранозы – пятый. В результате поворота группа –ОН должна расположиться в одну линию с основной углеродной цепью. Поэтому для D-изомера группа –СН2ОН окажется вверху, а для L-изомера – внизу:
Поворачивают на 90о атом углерода, связанный с гидроксильной группой, вступающей в реакцию циклизации. При построении маннофуранозы это будет четвёртый атом углерода, при построении маннопиранозы – пятый. В результате поворота группа –ОН должна расположиться в одну линию с основной углеродной цепью. Поэтому для D-изомера группа –СН2ОН окажется вверху, а для L-изомера – внизу: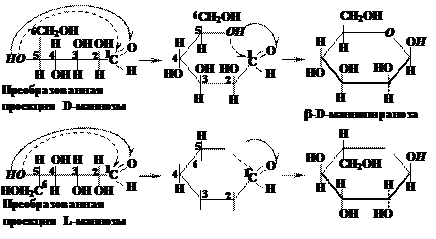





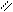
 О О НО Н Н ОН
О О НО Н Н ОН
 С – Н 1С – Н C С
С – Н 1С – Н C С НО Н Н 2 ОН H ОН H ОН
НО Н Н 2 ОН H ОН H ОН Н ОН НО 3 Н HO Н HO Н
Н ОН НО 3 Н HO Н HO Н Н ОН НО 4 Н О Н О Н
Н ОН НО 4 Н О Н О Н









 НО Н Н 2 ОН H ОН H ОН
НО Н Н 2 ОН H ОН H ОН Н ОН НО 3 Н HO Н HO Н
Н ОН НО 3 Н HO Н HO Н


 СН2ОН 5СН2ОН О СН2 О СН2
СН2ОН 5СН2ОН О СН2 О СН2 Ответ. При восстановлении моносахаридов образуются многоатомные спирты (полиолы), называемые альдитами. Восстановление обычно проводят водородом в присутствии металлических катализаторов (палладий, никель) или боргидридом натрия. Водород присоединяется по месту разрыва двойной связи углерод – кислород карбонильной группы. При восстановлении альдоз получается лишь один продукт (полиол), например при восстановлении D-глюкозы образуется шестиатомный спирт D-глюцит (L-сорбит):
Ответ. При восстановлении моносахаридов образуются многоатомные спирты (полиолы), называемые альдитами. Восстановление обычно проводят водородом в присутствии металлических катализаторов (палладий, никель) или боргидридом натрия. Водород присоединяется по месту разрыва двойной связи углерод – кислород карбонильной группы. При восстановлении альдоз получается лишь один продукт (полиол), например при восстановлении D-глюкозы образуется шестиатомный спирт D-глюцит (L-сорбит):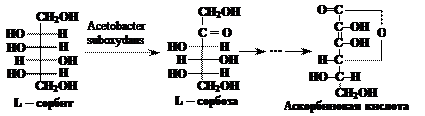 Восстановление глюкозы в сорбит является первой стадией химического синтеза аскорбиновой кислоты. Сорбит окисляют микробиологически, используя микроорганизм Acetobacter suboxydans; образующуюся L-сорбозу в несколько стадий превращают в аскорбиновую кислоту.
Восстановление глюкозы в сорбит является первой стадией химического синтеза аскорбиновой кислоты. Сорбит окисляют микробиологически, используя микроорганизм Acetobacter suboxydans; образующуюся L-сорбозу в несколько стадий превращают в аскорбиновую кислоту.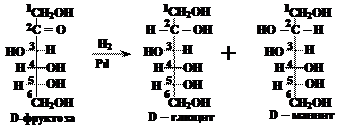
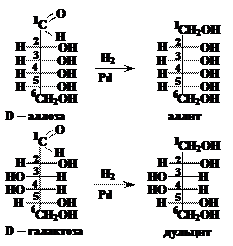 Ответ. При восстановлении D-галактозы и D-аллозы получаются шестиатомные спирты дульцит и аллит соответственно. Молекулы этих спиртов имеют плоскость симметрии, проходящую между третьим и четвёртым атомати углерода, следовательно, эти полиолы оптической активностью не обладают.
Ответ. При восстановлении D-галактозы и D-аллозы получаются шестиатомные спирты дульцит и аллит соответственно. Молекулы этих спиртов имеют плоскость симметрии, проходящую между третьим и четвёртым атомати углерода, следовательно, эти полиолы оптической активностью не обладают. А) реакция «серебряного зеркала» (реакция Толленса):
А) реакция «серебряного зеркала» (реакция Толленса):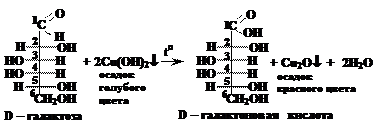 Б) реакция с гидроксидом меди (II):
Б) реакция с гидроксидом меди (II):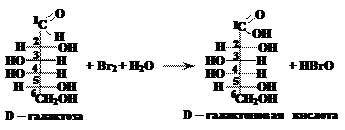
 С помощью сильного окислителя – разбавленной азотной кислоты – концевые группы альдоз (альдегидная и первичная спиртовая) одновременно окисляются в карбоксильные группы, образуя альдаровые (сахарные) кислоты, например:
С помощью сильного окислителя – разбавленной азотной кислоты – концевые группы альдоз (альдегидная и первичная спиртовая) одновременно окисляются в карбоксильные группы, образуя альдаровые (сахарные) кислоты, например: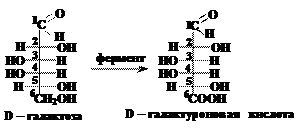 В организме при участии ферментов может окислиться первичная спиртовая группа, в то время, как альдегидная группа в результате остаётся не окисленной. Продукты таких реакций называют уроновыми кислотами:
В организме при участии ферментов может окислиться первичная спиртовая группа, в то время, как альдегидная группа в результате остаётся не окисленной. Продукты таких реакций называют уроновыми кислотами: