|
|
реакция типтеріне байланыст)Титрлеу тәсіліне байланысты титриметриялық әдістің жіктелуі Титрлеудің орындалу тәсілі бойынша титриметриялық анализ келесi әдістерге бөлінедi: 1. тура титрлеу, 2. керi титрлеу 3. орынбасу титрлеу (жанама). Анализденетін заттың агрегаттық күйіне қарай титриметриялық әдістің жіктелуі Титриметриялық анықтау операциясын жүргізуге алынған заттардың агрегаттық күйіне байланысты титриметриялық талдау әдісі екіге бөлінеді: · түтікпен алу · жеке өлшенді алу. ТИТРИМЕТРИЯЛЫҚ ЕСЕПТЕУЛЕР. Химиялық реакциялардағы әрекеттесуші заттардың Эквиваленттігі 1. Элементтің эквиваленті 2. Қышқылдың немесе негiздiң эквивалентi Тотығу - тотықсыздану реакцияларындағы заттардың эквивалентi Эквиваленттік фактор (fэкв) Титриметриялық анализде ерітінділердің концентрациясын өрнектеу Ерітінділердің концентрациясын өрнектеу әртүрлі. Мольдік концентрация. См – деп белгілейді.
Мұндағы, m – х заттың массасы (г), М – мольдік масса. Эквиваленттің мольдік концентрациясы (СН немесе Сfэкв(Х), өлшем бірлігі мольэкв/л) - 1 л ерітіндіде еріген заттың моль эквивалент мөлшері.
Мұндағы, m –заттың массасы (г), Мf – эквиваленттің мольдік массасы. Заттар өзара эквиваленттi мөлшерде әрекеттесетiндiктен, онда стехиометриялық әрекеттесетiн екi зат үшiн келесi катынас орындалады: Анықталынатын ерітіндінің белгілі бір көлемін VХ титрлеу барысында эквиваленттік нүктені анықтауға кеткен титрант көлемін VТ өлшейді. СХVХ = СТVТ; Титранттың эквивалентінің мольдік концетрациясын біле отырып, анықталынатын ерітіндінің эквивалентінің мольдік концентрациясын келесі формуламен есептейді:
мұнда с — эквиваленттің мольдiк концентрациясы, V — ерiтiндi көлемi. Концентрация мен эквиваленттің мольдік массасын қолдана отырып заттың массасы мына формуламен өрнектеледі:
Мұндағы, mх –заттың массасы (г), Мf – эквиваленттің мольдік массасы, Сн(х) эквиваленттің мольдік массасы. Стандартты ерітіндінің титрі (Т, г/мл) – 1мл ерітіндіде еріген заттың грамм массасы. Мұндағы ТА - ерітіндінің титрі, mA – алынған заттың массасы, VА – ерітінді көлемі. Ерітіндінің эквивалентінің мольдік концентрациясымен байланысты өрнектелген титр:
бұдан титрді өрнектеу:
Анықталынатын компонент бойынша алынған титр ТА/В (г/мл) – 1 мл А стандартты ерітіндісіменәрекеттесетін В анықталынатын компоненттіңграмм массасы.
Мұндағы ТА/В – стандартты ерітіндінің анықталынатын компонент бойынша титрі, СН(А) А стандартты ерітіндісі эквивалентінің мольдiк концентрациясы, МfВ – анықталынатын компоненттің эквиваленттік мольдік массасы.
Титрлеу операциясын жүргізу жолдарына байланысты есептеулер формулалары
Қышқыл-негізді титрлеу, әдістің мәні, қолданылуы Қышқыл-негіздік титрлеу - қышқыл мен негіздің әсерлесуіне негізделген: НА + МОН =МА+Н2О не Н+ + ОН- = Н2О Титрант ретінде күшті қышқыл не күшті негіз қолданылады. Егер қышқылмен титрлесе, онда ацидиметрия деп, ал негізбен титрленсе – алкалиметрия деп аталады. Тура титрлеу әдісі арқылы қышқыл мен негіздің, не олардың құрамына кіретін элементтердің мөлшерін анықтайды. Кері титрлеу әдісі арқылы кей тұздардың (М, кальций не аммоний тұздарының) мөлшерін анықтайды. Қышқыл-негіздік титрлеу арқылы заттың 0,10% массасын анықтайды, бұл әдіс 0,5% салыстырмалы қате жібереді. Бұл әдісте қышқыл-негізді индикаторлар қолданылады: 1.Күшті қышқылды күшті негізбен титрлеу; 2. Әлсіз қышқылды күшті негізбен титрлеу; 3. Күшті негізді күшті қышқылмен титрлеу; 4. Әлсіз негізді күшті қышқылмен титрлеу; 5. Әлсіз қышқылды әлсіз негізбен(не керісінше)титрлеу. Бұл әдісті қолданып, тамақтық қышқылдардың (сірке қышқылының, лимон қышқылының, сүт қышқылы және алма қышқылдарының) мөлшерін анықтауға болады. Заттың мөлшерін анықтау үшін бюреткадағы титранттан (қышқылдың, не негіздің стандартты ерітіндісі) анықталатын затқа индикатор түрі өзгергенше тамшылатылады. Күшті қышқыл мен күшті негіз әрекеттескенде эквивалент нүктеде рН=7, әлсіз қышқылды күшті негізмен титрлегенде эквивалент нүкте рН>7(неге?), әлсіз негізді күшті қышқылмен титрлегенде э.н. рН<7 болады (неге?). CH3COOH+NaOH= CH3COONa +H2O әлсіз қышқыл CH3COO- + H2O↔ CH3COOH+ОН- рН>7 NH4OH + HCl= NH4Cl + H2O әлсіз негіз NH4+ + H2O↔NH4OH + H+ рН<7 HCl+NaOH=NaCl + H2O рН=7 Қышқыл-негізді титрлеу кезінде индикаторды дұрыс таңдап алу қажет, себебі олар түстерін әртүрлі рН-да өзгертеді. Ол үшін титрлеу қисығын құру керек. Титрлеу қисығын құру үшін оны 4 бөлікке бөледі: а) титрлеуге дейінгі; б) титрлеу секірісінің басталуына дейінгі; в) титрлеудің секірісі және эквивалент нүктесін қосып; г) титрлеудің секірісінен кейінгі. а) титрлеуге дейінгі бөлік үшін рН-ты титрленуге тиісті заттың (қышқылдың, негіздің) концентрациясы арқылы ( күшті электролиттер үшін) не диссоциация константасы (әлсіз электролиттер үшін) арқылы табады. рН = -lg[H+] = -lgС НА күшті қышқыл үшін рОН = -lg[ОH-] = -lgС МОН күшті негіз үшін, рН=14- рОН [H+]=Ксу/ С МОН әлсіз қышқыл [H+] = √КНА/ СНА (7) әлсіз негіз [H+] = Ксу/√К МОН ×С МОН (8) Титрлеудің осы 4 түріндегі рН-ты есептеуді қарастырайық: I,II - күшті қышқылды күшті негізбен титрлеу және күшті негізді күшті қышқылмен титрлеу (титрлеу қисықтары бір-біріне қарама-қарсы болады). а) титрлеуге дейінгі рН-ты: рН = -lg[H+] = -lgС НА ; рОН = -lg[ОH-] = -lgСМОН рН =14- рОН 2. Эквивалент нүктесіне дейін рН мына формулалармен есептеледі: [H+] = (VНА-VМОН)/VНА+ VМОН (9); [ОH-] = (VМОН- VНА)× СМОН / VМОН + VНА (10) 3. Эквивалент нүктеде рН=7 4. Эквивалент нүктеден кейін рН мына формулалармен есептеледі: [H+] = Ксу (V НА + V МОН)/ V МОН (артық мөлшері)× СМОН(11) [ОH-]= Ксу (V МОН + V НА)/ V НА (артық мөлшері)× С НА(12) III, IY - әлсіз қышқылды күшті негізбен ( не керісінше) титрлегендегі титрлеу қисығын құру үшін рН есептеу: рН-ты есептегенде Н+- концентрациясын ерітіндідегі қышқылдың жалпы концентрациясына теңестіруге болмайды, себебі оның негізгі массасы иондалмаған молекула күйінде болады да тек аз бөлігі ғана Н+ ионы күйінде жүреді. Титрлеу қисығын құру үшін 3 формула қолданылады: а) титрлеуге дейінгі рН –ты есептеу, яғни әлсіз қышқыл ерітіндісіндегі; б) титрлеу процесі кезіндегі рН есептеу, яғни ерітіндіде әлсіз қышқыл мен оның тұзы болғанда; в) эквивалент нүктедегі рН-ты есептеу, яғни ерітіндіде тек әлсіз қышқыл мен күшті негіздің тұзы болғанда. Сонымен: а)қышқыл да ерітіндіде аздап диссоциацияға түсетіндіктен, оның диссоциация константасы – Кd . Н+ және An- концентрациялары өзара тең , ал HAn концентрациясы ерітіндідігі қышқылдың жалпы концентрациясына тең , яғни CHАn . (7) формуладан H+ - концентрациясын есептеп, рН табады: pH = 1/2 pKHAn – 1/2 lg CHAn (13), мұндағы pKHАn = - lgKHAn . б) тұз толық диссоциацияға түсетіндіктен, CAn- = CMeAn , олай болса, pH = pKHAn – lg CHAn/CAn- (14). Осы формула арқылы титрлеу қисығының ортадағы нүктелерін есептейді. в) MeAn әлсіз қышқыл мен күшті негіз тұзы гидролизге ұшырайтындықтан, эквивалент нүктедегі рН-ты, гидролиз реакциясының константасын жазып, Ксу арқылы pOH = 7 – 1/2 pKHAn + 1/2lgCAn- (15) есептеп, рН = 14- рОН табады, Кгидр. = КН2О / КНan . Эквивалент нүктедегі рН мәнін былай да есептеуге болады: рН = 7 + 1/2 pKHAn + 1/2 lgCAn- (16) Эквивалент нүктеге дейін титрлеу кезіндегі ерітінді буферлі қоспа болады, яғни қышқыл + қышқылдың тұзы, сондықтан титрлеу процесінде рН ақырын және біртіндеп өзгереді. Титрлеу қисығының секіріс облысының ерекше практикалық маңызы бар. Ол облыс 0,1мл титрленбеген әлсіз қышқыл қалған және 0,1 мл сілті ерітіндісінің артық мөлшері құйылған аралықтағы рН мәндерін қамтиды. Сонда секіріс басталатын нүктеде рН = 4.76 – lg 0.1/99.9 = 4.76 – (-3) = 7.76; pKHAc =4.76 Егер 0,1 н. сірке қышқылын (НАс) 0,1н. натрий гидроксидімен титрлесе, эквивалент нүктедегі рН = 7+4,76/2+1/2lg0,1=8,88 болады. Енді NaOH-тың артық мөлшері құйылғанда рН мәні ОН- концентрациясы арқылы анықталады, яғни секіріс аяғында 0,1н. сілтінің 0,1мл –де 10-4 моль/л ОН- болады, онда рН = 10. Келесі нүктелер де сілтінің артық мөлшерімен анықталады. Сонымен секіріс нүктесі рН 7,76-10 аралығында, сондықтан индикатор ретінде тек фенолфталеин алынады, оның рТ=9. Сонымен, қышқыл әлсізірек болған сайын титрлеу қисығындағы рН-тың секіріс мәні де аз болады. Сол сияқты әлсіз негізді күшті қышқылмен титрлегенде де титрлеу қисығындағы секіріс мәні аз болады, бұл жағдайлар индикатор таңдауының мүмкіндігін азайтады. V - әлсіз қышқылды әлсіз негізбен(не керісінше) титрлеу кезінде тирлеу қисығын құрғанда қышқылдық бөлігі әлсіз қышқылды күшті негізбен титрлеуге, сілтілік бөлігі титрлеу қисығының әлсіз негізді күшті қышқылмен титрлеген бөлігіне сәйкес келеді. Ал эквивалент нүктедегі рН мәні тұз гидролизінің константасы арқылы анықталады: Кгидр.= Ксу/Кнег.Кқышқ. ; Кгидр.= Снег.× С қышқ. /Стұз . Осы 2 формуланы пайдаланып, рН = 7 + 1/2 pKқышқ.- 1/2 рКнег.. Егер титрлеу қисығын сызса, рН секіріс мәні жоқ деуге болады, яғни индикатор таңдау өте қиын, сондықтан қышқыл-негіз титрлеу әдісінде ең болмаса бір электролит күшті болуы керек. Титрлеу әдісінде ерітінділердің нормальды концентрациясы қолданылады. Сонымен, титрлеу қисығына қарап мынандай қорытындылар жасауға болады: 1. Түсін тек рН=7 де өзгертетін индикаторды ғана таңдамауға болады. (HCl+NaOH – үшін э.н. рН=7 де болады). 2. Тым концентрациясы жоғары, не тым концентрациясы төмен ерітінділерді титрант ретінде алуға болмайды. Концентрациясы көп болса, титрлеу әдісінің қатесі көбейеді, концентрациясы аз болса, титрлеудің секірісі аз болады, сондықтан ерітінді концентрациясы 0,1н оптимальды деп есептеледі. Қышқыл-негіздік индикаторлар Қышқыл-негіздік индикаторлар- әлсіз органикалық қышқылдар не негіздер. Олардың иондары мен молекулалары әр түрлі түсті болады(боялады). Егер қышқыл индикаторды HInd деп, негіз индикаторды IndOH деп белгілесек: HInd↔ H+ + Ind- - лакмус NaOH қосса → қызыл түс көкке; HCl қосса,көк түс қызылға ауысады, сондықтан лакмустің судағы ерітіндісі күлгін түсті (қызыл+көк). Егер индикатордың ионы да, молекуласы да боялатын болса, ондай индикаторларды екі түсті деп атайды, егер не молекуласы, не ионы ғана боялатын болса, ондай индикаторлар бір түсті деп аталады. Сонымен, индикаторлардың молекуласы мен иондарының әр түсті болғандығы, олардың түсінің ерітіндінің рН-на байланысты өзгеретіндігін түсіндіреді Сонымен, қышқылдық индикатор үшін HInd↔ H+ + Ind- , негіздік индикатор үшін IndOH« Ind+ + OH- тепе-тендіктерін жазуға болады. Бұл тепе-теңдіктер үшін әрекеттесуші массалар заңын қолданса, Кдисс =[ H+][ Ind-]/[ HInd], Кдисс =[ Ind+][ OH- ]/ [ IndOH- ] Қышқылдық индикаторлардың молекулалары қышқыл ортада, ал сілтілік ортада ион күйінде Ind- жүретіндіктен [ Ind-] – сілтілік түрі (Сс.т) [ HInd] – қышқылдық түрі (Сқ.т) деп белгілесе: Кдисс =[ H+] Сс.т / Сқ.т , одан [ H+]= Сқ.т/ Сс.т рН = рК - lg Сқ.т/ Сс.т (1) рК = - lgК – индикатор көрсеткіші. Әр индикатор үшін рК – тұрақты шама, тек температураға байланысты ғана өзгереді. Олай болса, ерітіндінің рН-ның өзгерісі Сқ.т/ Сс.т қатынасы өзгеруіне әкеледі, яғни индикатор түсі өзгереді, себебі оның молекуласы мен ионының түсі әр түрлі. Адамның көзі индикатордың түсінің өзгергенін Сқ.т мен Сс.т екеуінің концентрациялары бір-бірінен тек он есеге айырмашылығы болса ғана, ажырата алады. рН1 = рК- lg10/1 = рК-1; рН2 = рК- lg1/10 = рК+1 Сонымен, индикатор түсі кез-келген ерітіндінің рН-ның өзгерісіне байланысты өзгермейді, тек индикатордың өзгеру интервалында ғана түсін өзгертеді, яғни мынандай формула қолданылады рН = рК±1 . Мысалы, фенолфталеиннің Кдисс =10-9 , яғни рК=9. Олай болса, оның түсі рН = 9+1 не рН = 9 – 1, яғни 8-10-да арасында, яғни рН = 8-10-да өзгереді. Практикада индикатордың көрсеткіші деген түсінік қолданылады. Ол индикатор түсі өзгеретін интервал ортасына сәйкес келеді, мысалы ол фенолфталеин үшін рТ = 9. Неге индикаторлардың молекуласы және ионы әр түрлі түске боялады? Оған индикаторлардың хромофорлық теориясы жауап береді. Бұл теория бойынша органикалық қосылыстар, яғни индикаторлардың түсінің өзгеруі – олардың молекуласының құрылысына байланысты, яғни олардың молекулаларында хромофорлар деген ерекше атомдық топтар болады, солардың молекула ішінде құрылыстарының өзгертуіне байланысты индикатор түсі де өзгереді. Мысалы, метилоранж (м.о.) формуласы: (СН3)2 N - N=N- SO3- (Ind-) +H2O pH>7 сары (СН3)2 N+ = N-NH-SO3- (HInd ) +OH- pH<7 қызыл Титриметриялық әдістің нәтижесінің дұрыс болуы индикаторды дұрыс таңдағанда көп байланысты. Ол үшін: 1) индикатордың рТ-сы эквивалент нүкте болатын рН-тың мәніне жақын болуы керек; 2) индикатордың түсі өзгеретін интервал шамасы титрлеу шегіне өте жақын болуы керек не соның мәніне кіруі керек; 3) индикаторлардың өздеріде қышқыл не негіз болғандықтан қышқыл-негіздік титрлеу кезінде оның көп мөлшерін алуға болмайды, себебі титранттың артық мөлшері жұмсалуы мүмкін, сондықтан 1-2 тамшы ғана тамызу керек және параллель жүргізілген тәжірибелерде әрқашан индикатордың бірдей мөлшерін алу керек; 4)индикатор концентрациясы да оның түсіне әсер етеді. Егер осы талаптар орындалмаса, анализ нәтижесінде қате кетуі мүмкін, ондай қателерді индикаторлық қате деп атайды. Оны анықтау үшін мынандай формулалар қолданылады: ∆Н+ =10-рТ V2 /Cн V1 ×100% - титрлеудің сутектік қатесі, егер күшті қышқыл аяғына дейін титрленбесе, не әлсіз не күшті негіздерді күшті қышқылмен артық титрлесе. ∆ОН- =10-(14- рТ) V2 / Cн V1×100% - титрлеудің гидроксильдік қатесе, егер күшті негіз аяғына дейін титрленбесе не күшті не әлсіз қышқыл күшті негізбен артық титрленсе. ∆НА =10рК – рТ /1+10рК – рТ ×100% -қышқылдық қате, егер әлсіз қышқыл НА молекуласы аяғына дейін титрленбесе. ∆МОН = 10рК + рТ-14/ 1+10 рК + рТ-14100% -сілтілік қате, егер әлсіз негіз МОН молекуласы аяғына дейін титрленбесе. V1 – титрлеуге алынған анализге түсетін заттың көлемі ,мл; V2 –титрлеудің аяғындағы ерітінді көлемі,мл; Сн – анализге түсетін заттың нормальды концентрациясы; рК – әлсіз электролиттің диссоциация константасы; рТ – индикатор көрсеткіші. Мысалы: 1) 0,1 н құмырсқа қышқылын 0,1 н NaOH титрлегенде м.о. индикаторын қолданған. Оның рТ=4 болса, рН = 8,22 эквивалент нүктеде (э.н.), олай болса, титрлеу рН=4-те бітеді, сондықтан титрленбеген НСООН ерітіндіде қалады. Сонда қышқылдық қате ∆НА =103,75-4 /1+103,75-4 ×100=64% ,рК = 3,75. 2) Ал егер индикатор ретінде фенолфталеин қолданылса, рТ=9, онда э.н. үшін рН=8,22 болғандықтан әлсіз қышқыл аяғына дейін титрленбеді, олай болса, гидроксильдік қате кетеді, ол 0,022% болады. Қышқылдық-негіздік титрлеу қисықтары. Индикаторлары. Қышқылдық-негіздік титрлеудегі индикаторлық қателер. Қышқылдық-негіздік титрлеудің фармацевтикалық талдауда қолданылуы. Қышқылдық-негіздік титрлеу сутек немесе гидроксоний иондарының гидроксил тобымен әрекеттесуіне негізделген: Н+ + ОН- ↔ Н2О немесе Н3О+ + ОН- ↔ 2Н2О (су ерітінділерінде), В + Н3О+ ↔ ВН+ + Н2О (органикалық ерітінділерде). Титрлеуде пайдаланылатын титранттың табиғатына байланысты қышқылдық-негіздік титрлеу әдісі екіге бөлінеді. Ацидиметрия – негіздерді сандық анықтау тәсілі. Титрант ретінде қышқылдар пайдаланады: HCl, H2SO4 т.б. Титранттарын стандарттау үшін бастапқы заттар ретінде Na2CO3, Na2B4O7·Н2О т.б. пайдаланады. Бұл тәсілмен күшті және әлсіз негіздерді, негіздік тұздарды, әлсіз қышқылдардың тұздарын, тұз қоспаларын және органикалық аминдерді анықтайды. Алкалиметрия - қышқылдарды сандық анықтау тәсілі. Титрант ретінде сілтілер пайдаланады: NaOH, KOH т.б. Титранттарын стандарттау үшін бастапқы заттар ретінде Н2С2О4·2Н2О, янтарь қышқылы НООС-(СН2)2-СООН, бензой қышқылы С6Н5СООН, калийдің гидротартраты КНС4Н4О6 т.б. пайдаланылады. Бұл тәсілмен әлсіз және күшті қышқылдарды, қышқыл тұздарды, әлсіз негіздердің тұздарын, органикалық қышқылдарды, фенолды т.б анықтайды. Қышқылдық-негіздік титрлеуді су және су емес (органикалық) ерітінділерде орындауға болады. Қышқылдық-негіздік титрлеуде тепе-теңдік канстантасының мәні К ≥ 108 тең болу тиіс. Бұл жағдайда титрленбей қалған қышқылдың немесе негіздердің массалық үлесі 0,01 %-ға тең болады. Бейтараптау тәсілінде индикаторларды Іnd дұрыс таңдау үшін сапалық көрсеткіштерімен қатар, сандақ сипаттамаларды (титрлеу қисықтарын, индикаторлық қателерді) есептей білу қажет. Титрлеу қисықтары қосылған титранттың көлеміне байланысты ерітінді рН-ының өзгеруін көрсетеді. Титрлеу қисығын тұрғызу үшін әртүрлі нүктедегі рН мәндерін есептейді: 1) бастапқы нүкте; 2) эквиваленттік нүктеге дейін; 3) эквиваленттік нүкте; 4) эквиваленттік нүктеден кейін. Күшті қышқылды күшті негізбен титрлеу қисығы. 100 мл 0,1н HCl ерітіндісін 0,1н NaOH ерітіндісімен титрлеу. Химиялық реакция теңдеуі: HCl + NaOH = NaCl + H2O. Бастапқы нүкте:1) 100 мл 0,1н HCl ерітіндісі бар. HCl - күшті қышқыл, сондықтан С(HCl) = Эквиваленттік нүктеге дейін:2) 100 мл 0,1н HCl ерітіндісі 50 мл 0,1н NaOH ерітіндісімен титрленгенде жалпы ерітіндінің құрамында қалған HCl концентрациясы келесі қатынаспен анықталады. С(HCl) =
3) 100 мл 0,1н HCl ертіндісі 90 мл 0,1н NaOH ертіндісімен титрленген, бұл жағдайда ерітіндінің құрамында қалған HCl концентрациясы:
4) 100 мл 0,1н HCl ерітіндісі 99 мл 0,1н NaOH еретіндісімен титрленген бұл жағдайда ерітіндінің құрамында қалған HCl концентрациясы:
5) 100 мл 0,1н HCl ерітіндісі 99,9 мл 0,1н NaOH ерітіндісімен титрленген, демек бұл нүктеде титрленбей қалған HCl ерітіндісінің концентрациясы 0,1%.
3. Эквиваленттік нүкте:6) 100 мл 0,1н HCl ерітіндісі 100 мл 0,1н NaOH ерітіндісімен титрленген, бұл жағдайда HCl ерітіндісіне NaOH ерітіндісінің эквиваленттік мөлшері қосылған, бұл нүктені эквиваленттік нүкте деп атайды. Реакция нәтижесінде түзілген тұз NaCl гидролизденбейді. HCl + NaOH = NaCl + H2O, Н+ + ОН- = H2O ерітіндіде
Эквиваленттік нүктеден кейін:7) Эквиваленттік нүктеден кейін ерітіндіде NaOH ерітіндісінің артық мөлшері болады, сондықтан ортаның рН осы NaOH ерітіндісінің артық мөлшерімен анықталады. рН секіру ауданын байқау үшін NaOH ерітіндісінің 0,1% артық мөлшерін қосу қажет. Сондықтан титрленетін ерітіндіге 100,1 мл 0,1н NaOH ерітіндісін қосады. NaOH күшті электролит болғандықтан,
рОН = -lg 8) 100 мл 0,1н HCl ерітіндісі 101 мл 0,1н NaOH ерітіндісімен титрленген кезде.
рОН = -lg 9) 100 мл 0,1н HCl ерітіндісі 110 мл 0,1н NaOH ерітіндісімен титрленген кезде.
рОН = -lg Осы алынған нүктелер бойынша титрлеу қисығын тұрғызып, талдауға болады. Абсцисса өсіне қосылған NaOH ерітіндісінің көлемін, ал ордината өсіне ерітіндінің рН-ын белгілейді.
Күшті қышқылды күшті негізбен титрлеу қисығын талдау. Титрлеудің бастапқы нүктелерінде ерітіндінің рН баяу өзгереді. Эквиваленттік нүктеге жақындағанда рН шұғыл өзгереді. Эквиваленттік нүктеден кейін ерітіндінің рН қайтадан баяу өзгереді. рН-тың күрт өзгеруі титрленбеген 0,1% HCl қалғанда және 0,1% артық титрленгенде, яғни 0,1% NaOH артық қосынғанда байқалады. Эквиваленті нүкте маңындағы рН-тың шұғыл өзгерісі байқалатын аралықты титрлеу секірмесі деп атайды. Бұл қисықта рН 4,3-тен 9,7-ге дейін шұғыл өзгеріп тұр. Неғұрлым рН-тыңтитрлеу секірмесі жоғары болса, соғұрлым титрлеу дәлдігі жоғары болады. Бұл титрлеу қисығының (күшті қышқылды күшті негізбен титрлеу қисығының) бірнеше ерекшеліктері бар. 1) Эквиваленттік нүкте бейтараптау сызығында орналасқан (ерітінділердің концентратциясы 0,1моль/л-ге тең болғанда). 2) Титрлеу қисығында рН-тың титрлеу секірмесінің интервалы жоғары (≈5,3). 3) Эквиваленттік нүктеде 1-2 т NaOH ерітіндісін қосқан кезде ерітіндінің рН-ынын күрт өзгеруімен қатар индикатор да өзінің түсін өзгертуі қажет. Индикатордың титрлеу көрсеткіші - рТ рН-тың титрлеу секірмесінде орналасуы тиіс. Титрлеу үшін көптеген индикаторлар пайдаланылады (ф-ф, м-о, ламус, метилқызыл т.б). 4) Титрлеу қисығына қышқыл мен негіздің де концентрациялары әсер етеді. Концентрациялары неғұрлым төмен болса, соғұрлым рН-тың титрлеу секірмесінің интервалы да төмен болады.
Концентрациялары 1 моль/л тең болғанда титрлеу секірмесі ≈ 7,4. Концентрациялары 0,1 моль/л тең болғанда титрлеу секірмесі ≈ 5,4. Концентрациялары 0,01 моль/л тең болғанда титрлеу секірмесі ≈ 3,7. Бұл кестеден рН-тың титрлеу секірмелерінің ерітінділердің коцнетратциясына тәуелді екендігін байқауға болады. 5) Титрлеу процесінде рН-тың өзгеруіне температурада әсер етеді, температура жоғарылаған сайын К(Н2О) мәні артады, бұған сәйкес рН титрлеу секірмесінің интервалы кемиді. Әлсіз қышқылды әлсіз негізбен титрлеу қисығы. Бұл тәсілді аналитикалық химияда пайдалануы тиімсіз, себебі рH секіру интервалы (титрлеу секірмесі) титрлеу қисығында пайда болмайды. Сондықтан, әлсіз қышқылды немесе әлсіз негізді титрлеу үшін күшті қышқылды немесе күшті негізді пайдалану қажет. Әлсіз қышқылды күшті негізбен титрлеу қисығы. Әлсіз қышқылдардың рН-ын есептеу үшін иондану константасын пайдаланады. Себебі, бұл ерітінділерде сутек иондарының концентрациясы қышқылдың жалпы концентрациясына тең емес. Сондықтан, ерітінділердің рН-ын есептеу үшін иондану константасын пайдаланады. Титрлеу қисығын тұрғызу үшін әртүрлі нүктелердегі рН мәндерін есептейді. Мысал ретінде 100 мл 0,1н СН3СООН ерітіндісін 0,1н NaOH ерітіндісімен титрлеуді қарастырайық. К(СН3СООН)=1,74·10-5; pK=4,76 Бастапқы нүкте:1) 100 мл 0,1н СН3СООН + 0,1н 0 мл NaOH. СН3СООН әлсіз қышқыл, сондықтан рН = -lg[H+] =-lg
Эквиваленттік нүктеге дейін:Титрлеу кезінде келесі реакция жүреді: СН3СООН + NaOH = СН3СООNa + H2O. Яғни эквиваленттік нүктеге дейін ерітіндіде буфер жүйесі түзіледі (әлсіз қышқыл және оның күшті сілтімен түзілген тұзы - СН3СООН + СН3СООNa). Сондықтан бұл ерітіндінің рН-ы осы екі қосылыстың өзара қатынасымен анықталады 2) 100 мл 0,1н СН3СООН ертіндісін 50 мл NaOH ерітіндісімен титрлегенде, ерітіндіде титрленбей қалған қышқылдың концентрациясы.
Түзілген тұздың концентрациясы қосылған NaOH мөлшеріне эквиваленттік , демек
Ерітіндінің рН: 3) 100 мл 0,1н СН3СООН ертіндісі 90 мл NaOH ерітіндісімен титрленген.
Ерітіндінің рН:
4) 100 мл 0,1н СН3СООН ертіндісі 99 мл NaOH ерітіндісімен титрленген.
Ерітіндінің рН:
5) 100 мл 0,1н СН3СООН ертіндісі 99,9 мл NaOH ерітіндісімен титрленген (титрленбей қалған қышқылдың концентрациясы 0,1%).
Ерітіндінің рН:
Эквиваленттік нүкте:6) 100 мл 0,1н СН3СООН ертіндісі 100 мл NaOH ерітіндісімен титрленген. Эквиваленттік нүктеде қышқылдың эквивалент саны негіздің эквивалент санына тең болады, ерітіндіде әлсіз қышқыл мен күшті негіздің тұзы түзіледі - СН3СООNa, бұл тұз су ерітіндісінде гидролизденеді, яғни рН гидролиздену константасына тәуелді. СН3СООNa + H2O ↔ СН3СООН + NaOH СН3СОО- + H2O ↔ СН3СООН + OH-
|
|

 ;
; ;
; ; (мольэкв/л)
; (мольэкв/л) ; (г)
; (г) г/мл
г/мл ; моль экв/л,
; моль экв/л, г/мл
г/мл
 ;
; СХVХ = СТVТ
СХVХ = СТVТ 




 )
) 












 ,
,  , VЖ = VHCl + VNaOH
, VЖ = VHCl + VNaOH
 , рН=-lg
, рН=-lg 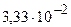 =-0,5224 + 2 = 1,4726 = 1,5
=-0,5224 + 2 = 1,4726 = 1,5
 , рН =-lg
, рН =-lg  = -0,7210 + 3 = 2,279 = 2,3
= -0,7210 + 3 = 2,279 = 2,3
 , рН =-lg
, рН =-lg  =-0,7007 + 4 = 3,299 = 3,3
=-0,7007 + 4 = 3,299 = 3,3
 , рН =-lg
, рН =-lg  =-0,6990+5 = 4,301 = 4,3
=-0,6990+5 = 4,301 = 4,3 немесе рН = рОН = 7. Реакция ортасы бейтарап болады.
немесе рН = рОН = 7. Реакция ортасы бейтарап болады.

 = -0,6981 + 5 = 4,3019 = 4,3 рН = 14 – 4,3 = 9,7
= -0,6981 + 5 = 4,3019 = 4,3 рН = 14 – 4,3 = 9,7

 = -0,6964 + 4 = 3,3036 = 3,3 рН = 14 – 3,3 = 10,7
= -0,6964 + 4 = 3,3036 = 3,3 рН = 14 – 3,3 = 10,7

 = -0,6776 + 3 = 2,3224 = 2,3 рН = 14 – 2,3 = 11,7
= -0,6776 + 3 = 2,3224 = 2,3 рН = 14 – 2,3 = 11,7
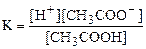 ерітіндіде [H+]=[CH3COO-], онда
ерітіндіде [H+]=[CH3COO-], онда 
 . [СН3СООН]=C(СН3СООН)-[H+] ерітіндідегі иондардың концентрациясы ([H+]) өте аз болғандықтан, ескермеуге болады, онда сірке қышқылының тепе-теңдік концентрациясы жалпы концентрациясына тең болады.
. [СН3СООН]=C(СН3СООН)-[H+] ерітіндідегі иондардың концентрациясы ([H+]) өте аз болғандықтан, ескермеуге болады, онда сірке қышқылының тепе-теңдік концентрациясы жалпы концентрациясына тең болады. ;
; 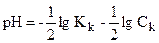 ;
; 

 . СН3СООН әлсіз қышқыл болғандықтан [СН3СООН] = C(СН3СООН) =Сқ. Ал [СН3СОО-] реакция нәтижесінде түзілген тұздың концентрациясына тең болады Ст, түзілген тұздың мөлшері қосылған сілтінің мөлшеріне эквивалент. Сонымен, иондану константасын келесі теңдеумен көрсетуге болады.
. СН3СООН әлсіз қышқыл болғандықтан [СН3СООН] = C(СН3СООН) =Сқ. Ал [СН3СОО-] реакция нәтижесінде түзілген тұздың концентрациясына тең болады Ст, түзілген тұздың мөлшері қосылған сілтінің мөлшеріне эквивалент. Сонымен, иондану константасын келесі теңдеумен көрсетуге болады. 

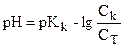
 =
= 

 =
=  ,
, 
 ;
; 


 ;
; 


 ;
;  =
= 


 ;
;  ;
; 