|
|
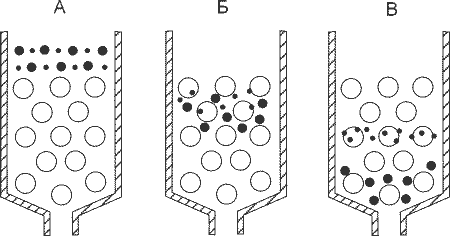
Колончатая гель-фильтрация смеси.Принцип метода:Разделение смесей этим способом основано с одной стороны, на различиях в размерах их молекул, а с другой - на соизмеримости разделяемых молекул с размерами пор гранул гелей (рис. 5). Поэтому крупные макромолекулы в поры геля не проникают и элюируются с колонок первыми. Напротив, чем мельче размеры молекул других компонентов смеси, тем чаще они попадают через поры в гранулы и, задерживаясь в колонке, выходят из нее позже, то есть в больших объемах элюата. Отсюда синонимы метода: гель-фильтрация или метод молекулярных сит.
Рис. 5. Схема гель-фильтрации двухкомпонентной смеси (по http://www2.usu.ru/biology/plant_phys/posob_bio_cont.htm)
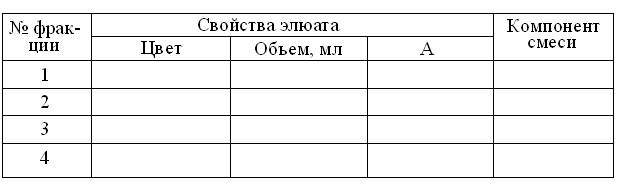
Свойства молекулярных сит имеют многие пористые материалы, начиная с природных или искусственных цеолитов, полиакриламида и пористого стекла, несжимаемых при гидростатическом давлении. Напротив, трехмерные гели агарозы и декстрана (коммерческие названия Сефадекс – Pharmacia, Швеция; Молселект – Reanal, Венгрия), благодаря высокому содержанию гидроксильных групп легко набухают, но и сжимаются при избытке давления или скорости истечения элюата, что нежелательно, во избежание регенерации колонки! Как правило, большие марки препаратов, идущих за их названием, отражают большую степень набухаемости и более крупный размер гранул, при меньшей степени их поперечной сшитости, позволяющих разделять вещества в широком диапазоне молекулярных масс. Ход работы: 1. На входе в колонку 0,9 x 15 см, заполненную гелем Сефадекса G – 50 (Pharmacia, Швеция) удалить пробку и, контролируя положение колонки в штативе с двух взаимно перпендикулярных позиций, довести его зажимами штатива до строго вертикального. 2. Убедившись, что поверхность геля строго горизонтальна и прикрыта фильтром, отрегулировать винтовым зажимом скорость истечения элюата в стакан-приемник до 10 – 15 капель/мин. 3. Дождавшись впитывания элюента на входе в колонку, не допуская подсыхания и взмучивания носителя, пипеткой по каплям, осторожно нанести на гель 0,5 мл смеси (1:1) 0,5 % раствора декстрана голубого (M = 2000 кДа) и насыщенного раствора рибофлавина (M = 376 Да). 4. Параллельно, заменить на выходе из колонки стакан-приемник, штативом с мерной центрифужной пробиркой № 1. 5. Как только делимая смесь впитается в гель, осторожно наслоить на него 5 мл физиологического раствора (0,85 % хлорид натрия) и повторять эту процедуру в течение всего опыта (30 – 40 мл). 6. Ориентируясь на изменения цвета элюата, продвигать под колонкой штатив, собирая тем самым в центрифужные пробирки №№ 1-4, его бесцветную, голубую, бесцветную и жёлтую фракции. 7. В соответствии с Инструкцией по эксплуатации фотоэлектроколориметра модели КФК-2. (п. 4.3.1. данного пособия), включить прогрев ФЭКа. 8. Убедившись, что колонка достигла исходного состояния, снова заменить штатив стаканом-приемником и, дополнительно промыть ее 10-15 мл физраствора. 9. Перекрыть зажимом выход колонки, оставив над поверхностью геля 1,5-2 мл элюента и закрыть вход в нее пробкой. 10. Определить объёмы полученных фракций элюата и занести результаты в таблицу протокола: Результаты гель-фильтрации смеси на колонке 0,9 х 15 см Сефадекса G-50
11. В соответствии с вышеупомянутой (п. 7) инструкцией, измерить против воды абсорбцию полученных фракций элюата при зеленом светофильтре (λ=540 нм) в кювете толщиной 5 мм, занося результаты в таблицу. 12. Построить график элюции с колонки, отложив по оси абсцисс объёмы элюата в мл, а по оси ординат – найденные величины А. 13. На основании данных эксперимента – идентифицировать компоненты исходной смеси. Контрольные вопросы 1. Что такое хроматография, где и зачем ее применяют? 2. Объясните термины: сорбция, носитель, подвижная и неподвижная фазы, элюент, элюат. 3. Укажите сходство и основные различия между хроматографией в тонких слоях и колонках. 4. Объясните термины хроматограмма, детектор, коллектор фракций. 5. Объясните, чем различаются газо-жидкостная и жидкостная хроматография? 6. Какие варианты жидкостной хроматографии вам известны? 7. Какие принципы лежат в основе бумажной хроматографии и, чем хроматографическая бумага отличается от обычной фильтровальной? 8. Объясните преимущества и недостатки бумажной хроматографии по сравнению с другими видами ТСХ? 9. Объясните, на каких принципах основано разделение аминокислот и пептидов в трехкомпонентных системах растворителей? 10. Объясните понятия «индикация», «идентификация», «свидетели», Rf , «коэффициент подвижности»? 11. Объясните принципы гель-хроматографии и укажите ее синонимы. 12. Какие материалы имеют свойства молекулярных сит? 13. По каким признакам можно идентифицировать компоненты фракций, элюируемых с колонки? 14. Молекулярная масса бычьего сывороточного альбумина = БСА, по данным гель-хроматографии составляет 70 кД. Рассчитайте, сколько остатков триптофана содержит молекула БСА, если молекулярная масса триптофана - 204 Да, а его содержание в этом белке составляет 0,68 %. 15. Что такое электрокинетические явления, где они встречаются и чем измерить их интенсивность? 16. Какие типы электрокинетических явлений Вам известны и какова их роль в биологии и технике? 17. Определите понятие «электрофорез» и перечислите основные факторы деления смесей при свободном электрофорезе. 18. Определите направление миграции аспарагиновой кислоты при pH 1 и pH 7; дипептида Глу-Гис при pH 1 и pH 10. 19. При каких значениях pH легче разделить с помощью электрофореза дипептиды Гли-Лиз, Асп-Вал и Ала-Гис? 20. Учитывая, что изоэлектрические точки тропомиозина, гемоглобина и рибонуклеазы, соответственно лежат при значениях pH 5,1, 6,8 и 9,45, укажите направление их смещения и относительную подвижность при электрофорезе в буферах с pH 4,2; 4,8; 5,1; 9,5 и 11,8. 21. Какую электрофоретическую подвижность имеют белки плазмы при рН 8,6? 22. В чем преимущества зонного электрофореза перед свободным и как их можно использовать в условиях лабораторий? 23. Какими электрическими величинами характеризуют процесс зонного электрофореза? 24. Какие разновидности электрофореза в зоне Вам известны и в чем заключаются их преимущества и недостатки? 25. Что вы знаете об устройстве приборов для электрофореза? 26. Что вы знаете о денситометрии электрофореграмм? 27. Как фиксируют и выявляют белковые фракции на электрофореграммах? 28. Как рассчитать относительную подвижность белковых фракций на электрофореграммах? 29. В чём состоит суть процесса диализа?
12 |
|