|
|
ТЕМА ЭЛЕКТРОЛИЗ, ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.ТЕМА ОСНОВНЫЕ ЗАКОНЫ ХИМИИ 1. Рассчитайте объём, который занимают 150 г CO2, SO2, NH3, H2 при нормальных условиях. 2. Рассчитайте, какой объём газа (н.у.) выделится при разложении 45 г NaNO3. 3. Плотность некоторого газа составляет 2,5 г/л (н.у.). Определите молярную массу газа и сколько молекул содержится в порции газа массой 50 г? 4. Рассчитайте, какой объем 20 %-ной соляной кислоты с плотностью 1.1 г/мл потребуется для реакции со 150 г оксида магния. 5. Какой объем водорода (при 500 ºС и 88 кПа) необходим для полного восстановления 400 г Fe3O4. 6. Рассчитайте массу оксида железа (III), который образуется при прокаливании Fe(NO3)3 массой 62 г. Какой объем газов при н.у выделится при этом? 7. 0,604 г двухвалентного металла вытеснили из кислоты 581 мл водорода, собранного над водой при 18 оС и давлении 105,6 кПа. Давление насыщенного пара воды при 18 оС составляет 2,1 кПа. Найти относительную атомную массу металла. Задачу решите, не прибегая к написанию уравнения реакции. 8. При 17 °С и давлении 780 мм. рт. ст. масса 624 мл газа равна 1,56 г. Вычислить молярную массу газа. 9. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислить 10. При сгорании 5 г алюминия образуется 9,0 г окиси алюминия. Определить 11. Вычислить массу 0,5 литра кислорода при нормальных условиях. 12. Сколько миллилитров 96 %-ного (по массе) раствора H2SO4 13. Определите молярную концентрацию раствора, содержащего 6,8 г 14. Сколько граммов растворенного вещества содержит 1 литр 0,015н раствора 15. К 4 литрам 15 %-ного раствора 16. Какой объем 0,15н раствора 17. На нейтрализацию 20 18. Какой объем 0,15н раствора ТЕМА ТЕРМОДИНАМИКА 1. Запишите формулировку и математическое выражение первого закона термодинамики. 2. Дайте определение для теплового эффекта химической реакции. 3. Запишите выражение, отражающее связь между тепловым эффектом при постоянном давлении и постоянном объеме. 4. Сформулируйте закон Гесса. 5. Сформулируйте первое следствие из закона Гесса и запишите его математическое выражение. 6. Сформулируйте второе следствие из закона Гесса и запишите его математическое выражение. 7. Запишите формулировку и математическое выражение второго закона термодинамики. 8. Какие из приведенных формул не соответствуют математическому выражению II закона термодинамики: а) DG=DH+TDS; b) dQ 9. Какие из приведенных формул соответствуют изменению энергии Гиббса: а) G=H-pV; b) DG=DH+TDS; c) DG=DH–TDS; d) G=H+TS.
С6Н12О6(к)+6О2(г)=6СО2(г)+6Н2О(ж). Для решения использовать справочные данные:
PCl5: PCl5(г)= PCl3(г)+Cl2(г), DrН=92,6 кДж. Для решения использовать справочные данные:
Для решения использовать справочные данные:
В каком направлении она может протекать самопроизвольно при 25°С.
Для решения использовать справочные данные:
В каком направлении она может протекать самопроизвольно при 25°С.
2РН3(т)+4О2(г)=Р2О5(т)+3Н2О(ж), DrН=–2360 кДж. Для решения использовать справочные данные:
Для решения использовать справочные данные:
В каком направлении она может протекать самопроизвольно при 25°С.
А)2NH3(г)=N2(г)+3H2(г);b)CO2(к)=СО2(г); Б)2H2S(г)+3O2(г)=2H2O(ж)+2SO2(г). С)2NО(г)+О2(г)=2NO2(г); Д)Fe2O3(т)+3CO(г)=2Fe(т)+3СО2(г); Е) 2H2(г)+O2(г)=2H2O(ж). К)NH4NO2(к)=2H2О(г)+N2O(г); Л)Fe2O3(т)+3C(т)=2Fe(т)+3СО(г); М) H2S(г)+J2(г)=2HJ(г)+S(т).
ТЕМА КИНЕТИКА, РАВНОВЕСИЕ
1. Дайте определение энергии активации и запишите математическое выражение уравнения Аррениуса. 2. Дайте определение и запишите формулу для скорости гомогенной реакции. 3. Дайте определение и запишите формулу для скорости гетерогенной реакции 4. Сформулируйте закон действующих масс и запишите его математическое выражение. 5. Сформулируйте правило Вант-Гоффа и запишите его математическое выражение. 6. Запишите выражение, отражающее связь константы химического равновесия с термодинамическими функциями (с энтропией и энтальпией). 7. В чем заключается физический смысл константы скорости химической реакции. 8. В чем заключается физический смысл температурного коэффициента химической реакции. 9. Сформулируйте правило смещения химического равновесия Ле-Шателье. Укажите, как влияет увеличение давления на смещение равновесия реакции 10. Сформулируйте правило смещения химического равновесия Ле-Шателье. Укажите, как влияет увеличение температуры на смещение равновесия экзотермических реакций. 11. Сформулируйте правило смещения химического равновесия Ле-Шателье. Укажите, как влияет увеличение температуры на смещение равновесия эндотермических реакций. 12. Сформулируйте правило смещения химического равновесия Ле-Шателье. Укажите, как влияет увеличение давления на смещение равновесия реакции 13. Сформулируйте правило смещения химического равновесия Ле-Шателье. Укажите, как влияет увеличение давления на смещение равновесия реакции 14. В каком направлении сместится равновесие при повышении температуры: – 2СО(г)+О2(г)=2СО2(г), – N2(г)+O2(г)=2NO(г), – СаСО3(т)=СО2(г)+СаО(т), –2Н2(г)+O2(г)=2Н2O(г), – СО2(г)+СаО(т)=СаСО3(т)), –N2(г)+O2(г)=2NO(г),
15. В какую сторону сместится равновесие в системе при понижении давления: – NH4NO3(тв)=N2O(г)+H2O(ж); – 2NО(г)+O2(г)=2NO2(г), – MgO(тв)+H2(г)=Mg(тв)+H2O(ж); –N2(г)+O2(г)=2NO(г). – 4Ag(тв)+O2(г)=2Ag2O(тв); –2Н2(г)+O2(г)=2Н2O(г). – As2O3(тв)+O2(г)=As2O5(тв); – 2Cl2(г)+O2(г)=2Cl2O(г).
18. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 50 °С скорость реакции возросла в 15,8 раза? 19. Во сколько раз изменится скорость реакции 2NО(г)+Br2(г)=2NOBr(г), если концентрацию NO уменьшить в 4 раза, а концентрацию Br2 –увеличить в 2 раза? 20. При температуре 100 °С скорость одной реакции в 2 раза больше скорости второй. Температурный коэффициент скорости первой реакции равен 2, второй –4. При какой температуре скорости обеих реакций выравняются?
24. При температуре 100 °С скорость одной реакции в 2 раза больше скорости второй. Температурный коэффициент скорости первой реакции равен 2, второй –4. При какой температуре скорости обеих реакций выравняются? 25. Температурный коэффициент скорости некоторой реакции равен 3. Как изменится скорость этой реакции при повышении температуры от 80 °С до 150 °С? 26. Во сколько изменится скорость реакции NО(г)+O2(г)=2NO2(г), если увеличить концентрацию NO в два раза, а концентрацию О2 – уменьшить в два раза?
ТЕМА КОНЦЕНТРАЦИЯ РАСТВОРОВ
1. Дайте определения молярной концентрации раствора и запишите формулу для ее расчета, укажите единицы измерения. 2. Дайте определения моляльной концентрации раствора и запишите формулу для ее расчета, укажите единицы измерения. 3. Дайте определения эквивалентной (нормальной) концентрации раствора и запишите формулу для ее расчета, укажите единицы измерения. 4. Дайте определения массовой доли растворенного вещества и запишите формулу для ее расчета, укажите единицы измерения. 5. Дайте определения мольной доли растворенного вещества и запишите формулу для ее расчета, укажите единицы измерения.
ТЕМА ЭЛЕКТРОЛИЗ, ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. 1.Составить уравнение процессов, протекающих при электролизе расплава:
2.Составить схему электролиза водного раствора:
3.Составить схемы электролиза водного раствора: – сульфата меди, если: а) анод медный; б) анод угольный. –нитрата серебра, если: а) анод серебряный; б) анод угольный. – хлорида меди, если: а) анод медный; б) анод угольный. – хлорида железа, если: а) анод железный; б) анод угольный. – сульфата никеля, если: а) анод из никеля; б) анод угольный.
4.Подберите коэффициенты в схемах следующих окислительно-восстановительных реакций методом электронного баланса:
5.Ток силой 2,5 А выделил в течение 15 мин 0,72 г меди из раствора 6.Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин. 7.Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А? 8.При электролизе водного раствора 9.За 10 мин из раствора платиновой соли ток силой 5 А выделил 1,517 г 10.Для выделения 1,75 г некоторого металла из раствора его соли потребовалось пропускать ток силой 1,8 А в течение 1,5 ч. Вычислить эквивалент металла. 11.При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла. 12.При электролизе водного раствора сульфата никеля (II) на катоде получили никель массой 177 г, выход которого составил 75%. Какой объем кислорода выделится при этом на аноде? Выход кислорода считать количественным. 13.При электролизе водного раствора 14.При электролизе водного раствора хлорида цинка на аноде выделился хлор объемом 26,88 л (нормальные условия), а на катоде – цинк массой 62,4 г. Считая выход хлора количественным, определите выход цинка. 15.При электролизе водного раствора 16.При электролизе водного раствора гидроксида калия с инертными электродами на катоде выделился молекулярный водород, объем которого при нормальных условиях равен 11,2 л. Какой объем кислорода выделится при этом на аноде? 17.При электролизе раствора 18.При электролизе водного раствора 19.Один из способов промышленного получения кальция - электролиз расплавленного хлорида кальция. Какая масса металла будет получена, если известно, что в результате электролиза выделился хлор объемом 896 л (нормальные условия)? 20.При электролизе воды на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде? 21.При электролизе расплава хлорида калия на катоде получили калий массой 7,8 г. Определите объем хлора, который выделился на аноде. Объем рассчитайте при нормальных условиях. 22.При электролизе водного раствора 23.Какая масса натрия выделится на катоде при электролизе расплава иодида натрия, если на аноде выделился иод массой 762 г? 24.При электролизе растворов 25.Ток силой 2,5 А выделил в течение 15 мин 0,72 г меди из раствора 26.При электролизе водного раствора 27.При электролизе раствора
28.Гальванический элемент состоит из: – металлического цинка, погруженного в 0,3М раствор нитрата цинка, и металлического олова, погруженного в 0,05М раствор нитрата олова. – металлического алюминия, погруженного в 0,1М раствор нитрата алюминия, и металлического олова, погруженного в 0,04М раствор нитрата олова – металлического цинка, погруженного в 0,5М раствор нитрата цинка, и металлического олова, погруженного в 0,25М раствор нитрата олова. – металлического железа, погруженного в 0,1М раствор нитрата железа, и металлического никеля, погруженного в 0,02М раствор нитрата никеля. – металлического железа, погруженного в 0,3М раствор нитрата железа, и металлического никеля, погруженного в 0,15М раствор нитрата никеля. – металлического железа, погруженного в 0,4М раствор нитрата железа, и металлического серебра, погруженного в 0,02М раствор нитрата серебра. – металлического железа, погруженного в 0,1М раствор нитрата железа, и металлического серебра, погруженного в 0,04М раствор нитрата серебра. – металлического железа, погруженного в 0,2М раствор нитрата железа, и металлического серебра, погруженного в 0,2М раствор нитрата серебра. – металлического кобальта, погруженного в 0,4М раствор нитрата кобальта, и металлической меди, погруженной в 0,02М раствор нитрата меди. – металлического цинка, погруженного в 0,1М раствор нитрата цинка, и металлического олова, погруженного в 0,02М раствор нитрата олова. – металлического цинка, погруженного в 0,3М раствор нитрата цинка, и металлического олова, погруженного в 0,05М раствор нитрата олова. Вычислить ЭДС элемента, написать уравнения электродных процессов и окислительно-восстановительной реакции, протекающей в данном гальваническом элементе, составить схему элемента.
ТЕМА КОРРОЗИЯ
ТЕМА ПЕРИОДИЧЕСКАЯ СИСТЕМА 1. Из перечисленных ниже характеристик атомов элементов периодически изменяются: а) заряд ядра атома; б) относительная атомная масса; в) число энергетических уровней в атоме; г) число электронов на внешнем энергетическом уровне. 2. Внутри периода увеличение порядкового номера элемента обычно сопровождается: а) уменьшением атомного радиуса и возрастанием электроотрицательности; б) возрастанием атомного радиуса и уменьшением электроотрицательности; в) уменьшением атомного радиуса и уменьшением электроотрицательности; г) возрастанием атомного радиуса и возрастанием электроотрицательности. 3. 4. Металлический характер свойств элементов в ряду Mq-Ca-Sr-Ba: а) уменьшается; б) возрастает; в) не изменяется; г) уменьшается, а затем возрастает. 5. Неметаллические свойства элементов, расположенных в главных подгруппах периодической системы Д.И. Менделеева, наиболее ярко выражены у тех элементов, которые находятся: а) в верхней части подгруппы; б) в нижней части подгруппы; в) в середине подгруппы; г) у всех элементов подгруппы выражены примерно в одинаковой степени. 6. Из перечисленных обозначений орбиталей неверными являются: а) 2s, 4f; б) 2p, 3d; в) 1p, 2d; г) 1s, 2p. 7. Запишите конфигурации внешних электронных слоев для следующих ионов: а) Mn4+; б) Cl-; в) S2-; г) Pb2+. 8. Наибольшее значение энергии ионизации имеет: а) Li; б) F; в) Fe; г) J. 9. 10. Гипотетический элемент Z образует хлорид состава ZCl5. Наиболее вероятная формула его высшего оксида; а) ZО2; б) ZО5; в) Z2O5; г) Z5O2. 11. Укажите число протонов, нейтронов и электронов для атомов следующих элементов: а) 13С; б) 55Mn; в) 97Мо. 12. Электронная конфигурация иона Zn2+ соответствует формуле: а) 1s22s22p4; б) 1s22s22p63s23p6; в) 1s22s22p63s23p63d10; г) 1s22s22p63s23p63d104s24p6. 13. Направление электронного облака в пространстве характеризует квантовое число: а) n; б) ml; в) l; г) ms. 14. Следующие химические элементы: H, O, F, S, Cl –располагаются в порядке возрастания их электроотрицательности в ряд: а) Cl,O,F,S,Н; б) H,O,S,F,Cl; в) S,H,Cl,O,F; г) H,S,Cl O,F. 15. В порядке возрастания атомного радиуса составлен ряд; а) O, S, Se, Te;б) C, N, O, F; в) Na, Mq, Al, Si; г) J, Br, Cl, F. 16. На 3d –подуровне максимально может находится: а) 2e; б) 6e; в) 15e; г) 10e. 17. Атомам каких элементов соответствует представленные ниже электронные конфигурации: а) 1s22s22p1; б) 1s22s22p63s23p64s13d10; в) 1s22s22p5; г) 1s22s22p63s1. 18. Магнитное квантовое число для орбиталей d –подуровня принимает значения: а) 1,2,3; б) –2,-1,0,1,2; в) –1,0,1; г) –1,0,1,2,3. 19. Энергия, которая указана в уравнении 20. Распределите элементы по возрастанию числа электронов в наружном слое атомов: Ar, Ca, Na, Cl, S, N. 21. Из приведенных ниже элементов третьего периода наиболее ярко выраженными неметаллическими свойствами обладает: а) Al; б) Si; в) S; г) Cl. 22. Электронную конфигурацию 1s22s22p63s23p64s1 в невозбужденном состоянии имеет атом элемента: а) Na; б) K; в) Ca; г) Ba. 23. На каком энергетическом уровне и на каком энергетическом подуровне находится электрон, для которго n =4 и l=1? Какую форму имеет облако этого электрона? ТЕМА ВЯЖУЩИЕ ВЕЩЕСТВА 1. Дайте определение «вяжущиематериалы» 2. Дайте определение «минеральные вяжущиематериалы» 3. Классификация МВМ. 4. Дайте определение «органические вяжущиематериалы» 5. Вяжущий материал – цемент (определение, состав, применение) 6. Вяжущий материал – гипс (определение, состав, применение) 7. Вяжущий материал – бетон (определение, состав, классификация по назначению) 8. Вяжущий материал – битум (определение, состав, применение) 9. Вяжущий материал – известь (определение, состав, виды, применение)
|
|
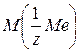 и атомную массу металла.
и атомную массу металла. и его оксида.
и его оксида. в 250 мл.
в 250 мл.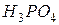 ?
? , плотность которого 1,062
, плотность которого 1,062  , прибавили 2 литра 7,5 %-ного раствора той же кислоты с плотностью 1,012
, прибавили 2 литра 7,5 %-ного раствора той же кислоты с плотностью 1,012  потребуется для взаимодействия с 400 мл 0,24н раствора
потребуется для взаимодействия с 400 мл 0,24н раствора  0,10н раствора щелочи требуется 145
0,10н раствора щелочи требуется 145  . Чему равна нормальность раствора
. Чему равна нормальность раствора  TdS; c) Qp= –DH; d) dS
TdS; c) Qp= –DH; d) dS  dQ/T.
dQ/T. , кДж/моль
, кДж/моль
 .
. .
. .
.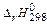 <0;
<0; с инертными электродами.
с инертными электродами.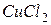 , КОН,
, КОН,  ,
,  ,
,  ,
, 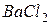 с платиновыми электродами.
с платиновыми электродами.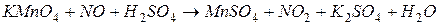
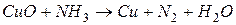
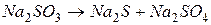
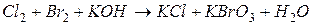
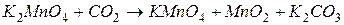
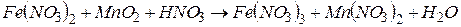
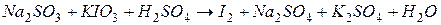
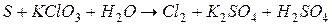
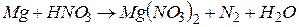
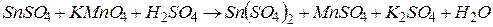
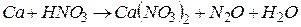
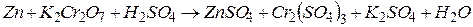
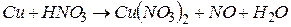
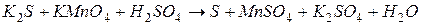
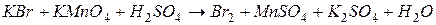
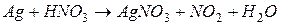
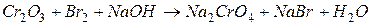

 . Вычислить коэффициент полезного действия тока.
. Вычислить коэффициент полезного действия тока. на аноде выделилось 3,8 л кислорода, измеренного при 27°С и 100 кПа. Сколько граммов
на аноде выделилось 3,8 л кислорода, измеренного при 27°С и 100 кПа. Сколько граммов 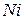 выделилось на катоде?
выделилось на катоде? . Определить эквивалентную массу платины.
. Определить эквивалентную массу платины. на аноде выделилось 5,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде?
на аноде выделилось 5,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде? на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде?
на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде? в течение 50 мин при силе тока 3 А на катоде выделилось 9,6 г серебра. Определить выход серебра в процентах от теоретического.
в течение 50 мин при силе тока 3 А на катоде выделилось 9,6 г серебра. Определить выход серебра в процентах от теоретического. на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде?
на аноде выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось на катоде? кДж, является для атома хлора: а) энергией химической связи; б) энергией ионизации; в) электроотрицательностью; г) сродством к электрону.
кДж, является для атома хлора: а) энергией химической связи; б) энергией ионизации; в) электроотрицательностью; г) сродством к электрону.