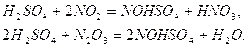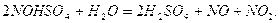|
|
Очистка газов от оксидов азотаАбсорбция водой При абсорбции диоксида азота водой в газовую фазу выделяется часть оксида азота, скорость окисления которого при низких концентрациях мала:
Для утилизации оксидов можно использовать разбавленные растворы пероксида водорода с получением азотной кислоты:
Основным фактором, определяющим экономику процесса, является расход пероксида водорода. Он приблизительно равен 6 кг на 1 т кислоты в сутки. Разработан процесс очистки газов водой и циркулирующей Абсорбция щелочами Для очистки газов применяют различные растворы щелочей и солей. Хемосорбция диоксида азота раствором соды протекает по уравнению:
Уравнения для хемосорбции
При абсорбции
0,84 > 0,80 > 0,78 > 0,63 > 0,56 > 0,51 > 0,44 > 0,43 > 0,41 >
> 0,40 > 0,39 > 0,35
Цифры под каждым из щелочных растворов показывают их активность относительно раствора При абсорбции растворами аммиака образуются соединения с низкой температурой разложения. Например, образующийся нитрит аммония
Селективные абсорбенты Для очистки газов от
При нагреве до 95 - 1000С комплекс Раствор Использование растворов
Таким же образом При температуре выше 2000С
Серная кислота используется для поглощения
При нагревании нитрозилсерной кислоты или при разбавлении ее водой происходит выделение оксидов азота:
Взаимодействие оксидов азота с жидкими сорбентами наиболее эффективно протекает при 20 - 400С.
Абсорбционные системы
Абсорбционные системы разделяют на водные и неводные. Во втором случае применяют обычно малолетучие органические жидкости. Жидкость используют для абсорбции только один раз или же проводят ее регенерацию, выделяя загрязнитель в чистом виде. Схемы с однократным использованием поглотителя применяют в тех случаях, когда абсорбция приводит непосредственно к получению готового продукта или полупродукта. В качестве примеров можно назвать: · получение минеральных кислот: § абсорбция серного ангидрида (SO3) (производство серной кислоты - H2SO4); § абсорбция хлористого водорода (HCl) (получение соляной кислоты); § абсорбция оксидов азота (NOx) водой (производство азотной кислоты - HNO3); § абсорбция оксидов азота (NOx) щелочными растворами (получение нитратов); § др. · получение солей (абсорбция оксидов азота щелочными растворами с получением нитрит-нитратных щелоков, абсорбция водными растворами извести или известняка с получением сульфата кальция); · других веществ (абсорбция NH3 водой для получения аммиачной воды и др.). Схемы с многократным использованием поглотителя (циклические процессы) распространены шире. Их применяют для улавливания углеводородов, очистки от SO2 дымовых газов ТЭС, очистки вентгазов от сероводорода железно-содовым методом с получением элементарной серы , моноэтаноламиновой очистки газов от CO2 в азотной промышленности. В зависимости от способа создания поверхности соприкосновения фаз различают поверхностные, барботажные и распыливающие абсорбционные аппараты. В первой группе аппаратов поверхностью контакта между фазами является зеркало жидкости или поверхность текучей пленки жидкости. Сюда же относят насадочные абсорбенты, в которых жидкость стекает по поверхности загруженной в них насадки из тел различной формы. Во второй группе абсорбентов поверхность контакта увеличивается благодаря распределению потоков газа в жидкость в виде пузырьков и струй. Барботаж осуществляют путем пропускания газа через заполненный жидкостью аппарат либо в аппаратах колонного типа с тарелками различной формы. В третьей группе поверхность контакта создается путем распыления жидкости в массе газа. Поверхность контакта и эффективность процесса в целом определяется дисперсностью распыленной жидкости. Для эффективного применения водных абсорбционных сред удаляемый компонент должен хорошо растворяться в абсорбционной среде и часто химически взаимодействовать с водой, как, например, при очистке газов от HCl, HF, NH3, NO2. Для абсорбции газов с меньшей растворимостью (SO2, Cl2, H2S) используют щелочные растворы на основе NaOH или Ca(OH)2. Добавки химических реагентов во многих случаях увеличивают эффективность абсорбции благодаря протеканию химических реакций в пленке. Для очистки газов от углеводородов этот метод на практике используют значительно реже, что обусловлено, прежде всего, высокой стоимостью абсорбентов. Общими недостатками абсорбционных методов является образование жидких стоков и громоздкость аппаратурного оформления. абсорбционный очистка газ
Заключение
В данной работе были рассмотрены абсорбционные методы очистки отходящих газов от примесей. Данный метод очистки газов не свободен от определенных недостатков, связанных, прежде всего, с громоздкостью оборудования. Этот метод достаточно капризен в эксплуатации и связан с большими затратами. К недостаткам абсорбционного метода следует отнести также образование твердых осадков, что затрудняет работу оборудования, и коррозионную активность многих жидких сред. Однако, не смотря на эти недостатки, абсорбционный метод еще широко применяется в практике газоочистки, так как он позволяет улавливать наряду с газами и твердые частицы, отличается простотой оборудования и открывает возможности для утилизации улавливаемых примесей.
Список используемой литературы
1. Ветошкин А.Г., Таранцева К.Р. Технология защиты окружающей среды (теоретические основы). Учебное пособие. /Под ред. доктора технических наук, профессора, академика МАНЭБ и АТП РФ А.Г.Ветошкина - Пенза: Изд-во Пенз. технол. ин-та, 2004. - с.: ил., библиогр. 2. Страус В. Промышленная очистка газов / Пер. с англ. М.: Химия, 1981. 3. Дытнерский, Ю. И. Основные процессы и аппараты химической технологии: Пособие по проектированию / Г. С. Борисов, В. П. Брыков, Ю. И. Дытнерский - Изд. 3-е, стереотипное. - М.: ООО ИД «Альянс», 2007. 4. <http://filepo27.narod.ru/teor/63.htm> Абсорбционные методы очистки газов(SO(2), N(x)O(y), H(2)S). 5. <http://splitsystem-rostov.ru> Методы очистки воздуха. Описание существующих методов очистки воздуха от вредных газообразных примесей. 6. <http://www.gazochist.ru/cba/proceses.html> Очистка газов от примесей.
Доклад
|
|
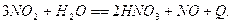
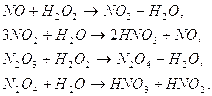
 . Физическая абсорбция оксидов азота в азотной кислоте увеличивается с ростом концентрации кислоты и парциального давления
. Физическая абсорбция оксидов азота в азотной кислоте увеличивается с ростом концентрации кислоты и парциального давления  . Увеличение поверхности контакта способствует протеканию процесса, так как на границе раздела фаз идет реакция окисления NO в NO2. Для интенсификации процесса используют катализатор. Степень очистки может достигать 97%.
. Увеличение поверхности контакта способствует протеканию процесса, так как на границе раздела фаз идет реакция окисления NO в NO2. Для интенсификации процесса используют катализатор. Степень очистки может достигать 97%.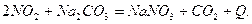
 различными щелочными растворами или суспензиями представлены ниже:
различными щелочными растворами или суспензиями представлены ниже:
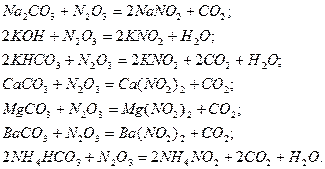
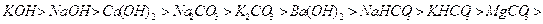

 , активность которого условно принята за единицу. Данные приведены для начальной концентрации растворов 100 г/л и времени проскока газа 10 мин. Активность щелочных растворов определяется начальным рН раствора. Активность тем выше, чем выше этот показатель.
, активность которого условно принята за единицу. Данные приведены для начальной концентрации растворов 100 г/л и времени проскока газа 10 мин. Активность щелочных растворов определяется начальным рН раствора. Активность тем выше, чем выше этот показатель. при 560С полностью распадается:
при 560С полностью распадается: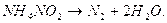
 при отсутствии в газовой фазе кислорода могут быть использованы растворы
при отсутствии в газовой фазе кислорода могут быть использованы растворы 


 для первых растворов протекают реакции с образованием комплексов:
для первых растворов протекают реакции с образованием комплексов: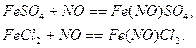
 распадается и
распадается и 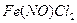 .
. является наиболее доступным и эффективным поглотителем. В качестве абсорбента могут быть использованы и травильные растворы, содержащие
является наиболее доступным и эффективным поглотителем. В качестве абсорбента могут быть использованы и травильные растворы, содержащие 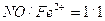 . Присутствие в растворе серной и азотной кислот, солей и органических веществ снижает его поглотительную способность. Однако наличие в растворе 0,5 - 1,5% (об.) серной кислоты предохраняет
. Присутствие в растворе серной и азотной кислот, солей и органических веществ снижает его поглотительную способность. Однако наличие в растворе 0,5 - 1,5% (об.) серной кислоты предохраняет  .
. ,
,  ,
,  приводит к дефиксации азота:
приводит к дефиксации азота: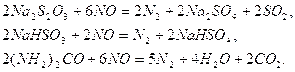
 ,
,  ,
,  .
. .
. и
и