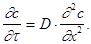|
|
Характеристика основных фаз в сплавахЧистые металлы обычно имеют низкую прочность и невысокие технологические свойства. В технике применяют сплавы. Сплавами называют сложные материалы, полученные сплавлением нескольких компонентов. Компонентами сплавов могут быть металлы, неметаллы и химические соединения. В зависимости от числа компонентов сплавы могут быть двойные, тройные и т. д. При физико-химическом взаимодействии компоненты образуют фазы, число и тип которых характеризуют состояние сплава. Фаза – однородная часть сплава, характеризующаяся определенным составом, типом кристаллической решетки и отделенная от других частей поверхностью раздела. В зависимости от количества фаз сплавы могут одно- двух- и многофазными. В жидком состоянии компоненты сплава обычно не ограничено растворяются друг в друге, образуя жидкие растворы. В твердом состоянии компоненты могут образовывать: твердые растворы, механические смеси, химические соединения. Механические смеси. Если элементы, входящие в состав сплава, при затвердевании из жидкого состояния не растворяются друг в друге и не взаимодействуют, то образуется механическая смесь ( олово – свинец, алюминий – медь). В механических смесях существуют два типа кристаллических решеток. Химические соединения по структуре представляют однородные твердые тела, свойства их отличаются от свойств элементов их образующих, имеют постоянную температуру плавления, их состав выражается стехиометрической пропорцией в виде простой формулы АmВn. Различают химические соединения двух типов: металл – неметалл и металл – металл. К химическим соединениям металлов с неметаллами относят фазы с ионным типом связи: сульфиды, оксиды, фосфиды, и фазы внедрения: карбиды, нитриды, бориды и гидриды. К системе металл – металл относятся электронные соединения. Электронные соединения образуются между одновалентными металлами (медь, серебро, литий) или металлами переходных групп ( железо, марганец, кобальт), с одной стороны, и металлами с валентностью от 2 до 5 ( алюминий, бериллий, магний, цинк ) с другой стороны. Электронные соединения являются фазами переменного состава. Соединения этого типа имеют определенную электронную концентрацию, т. е. определенное соотношение числа валентных электронов к числу атомов: 3/2 – обычно имеют ОЦК решетку, относятся CuZn, CuBe, Cu3Al; 21/13 – имеют сложную кубическую решетку Cu5Zn8, Co5Zn21, Fe5Zn21; 7/4 – с гексагональной решеткой CuZn3, Cu3Sn2, Cu3Si. Электронные соединения характерны для медных сплавов (латуней и бронз). Твердые растворы – один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы других (растворяемых) компонентов располагаются в его решетке искажая ее. Твердые растворы могут быть двух типов: замещения и внедрения. Твердые растворы замещения имеют более упорядоченную структуру и по своим свойствам ближе к химическим соединениям; могут быть неограниченной растворимости. В твердых растворах внедрения растворимость ограничена. Правило фаз Гиббса. Закономерности существования устойчивых фаз в условиях равновесия определяются правилом фаз Гиббса. Правило фаз, устанавливая количественную зависимость между числом фаз Ф, количеством компонентов К и числом степеней свободы С, дает возможность предсказать процессы, проходящие в сплавах при нагреве и охлаждении, и определить число фаз в системе при данных условиях. Правило фаз выражается следующим уравнением: С = К + Р – Ф. Под числом степеней свободы, или вариантностью системы, понимают число внешних Р ( температура, давление) и внутренних (концентрация) факторов, которые можно изменять без изменения числа фаз, находящихся в равновесии. Для металлических сплавов внешним фактором является только температура, поэтому правило фаз: С = К + 1 – Ф. Вариантность не может быть отрицательной, поэтому для равновесия металлических сплавов необходимо, чтобы в их структуре число фаз не превышало число компонентов более, чем на 1. В случае кристаллизации чистого металла, когда имеются две фазы (жидкая и твердая), число степеней свободы равно 0, т.е. система инвариантна и обе фазы находятся в равновесии при строго определенной температуре. Чистый металл в жидком состоянии имеет число степеней свободы 1 (моновариантная система) т.е. имеется возможность изменять в определенных пределах температуру без изменения числа фаз. Из правила фаз следует, что в двойных системах число одновременно существующих фаз не может быть более 3. При большем сплав не будет находится в равновесном состоянии. 2.2. Процессы диффузии в металлах и сплавах Многие процессы, протекающие в металлах и сплавах, особенно при повышенных температурах, связаны с самодиффузией или диффузией. Самодиффузия - переход атома металла из узла кристаллической решетки в соседний или в междоузлие под действием теплового возбуждения. Диффузия - перенос разнородных атомов, который сопровождается изменением концентрации компонентов в отдельных зонах сплава. Для описания процессов диффузии и самодиффузии предложено несколько механизмов : обменный, циклический, межузельный, вакансионный и др. Однако реализуется тот механизм, при котором окажется наименьшей величина энергетического барьера (энергия активации), преодолеваемого перемещающимися атомами. Энергия активации зависит от сил межатомной связи и дефектов кристаллической решетки, которые облегчают диффузионные переходы (энергия активации по границам зерен в 2 раза меньше, чем в объеме зерна). Для металлических атомов более вероятен вакансионный механизм. Классическими законами диффузии считаются законы Фика, которые справедливы для систем с малым градиентом концентрации - Первый закон Фика:
При постоянной температуре количество диффундирующего вещества dm в единицу времени через единицу поверхности dS пропорционально градиенту концентрации Когда градиент концентрации изменяется во времени, а коэффициент диффузии не зависит от концентрации, процесс диффузии описывается вторым законом Фика:
Коэффициент диффузии определяет скорость диффузии при перепаде концентрации, равном единице, зависит от состава сплава, размеров зерен и температуры процесса. Для определения диапазона температур Аррениус установил экспоненциальную зависимость коэффициента диффузии от температуры:
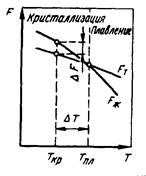
где D0 - предэкспоненциальный множитель, зависящий от сил связи между атомами кристаллической решетки: Q - энергия активации процесса диффузии; R - газовая постоянная. Диффузионные процессы лежат в основе кристаллизации и рекристаллизации, фазовых превращений и насыщения поверхности сплавов другими элементами. 2.3. Энергетические условия кристаллизации. Энергетическое состояние любой системы характеризуется определенным запасом внутренней энергии, которая складывается из энергии движения молекул, атомов, внутриядерной энергии, энергии упругих искажений кристаллической решетки и др. Свободной энергией является такая составляющая внутренней энергии, которая в изотермических условиях может быть превращена в работу. Величина свободной энергии изменяется при изменении температуры, изменении фазового состояния, при полиморфных превращениях и т.д.: F = U – TS. F – свободная энергия; U - полная внутренняя энергия системы; S – энтропия. Металл затвердевает, если меньшей свободной энергией обладает твердое состояние, и плавится, если меньшей энергией обладает жидкое состояние. С повышением температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии различен для жидкого и твердого состояния. Изменение свободной энергии жидкого и твердого состояния при изменении температуры показано на рис.7. С повышением температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии различен для жидкого и твердого состояния вещества.
Рис.7 Различают теоретическую или равновесную температуру кристаллизации, при которой Fж = Fтв. При этой температуре равновероятно существование металла как в жидком так и в твердом состоянии. Реальная же кристаллизация начнется только тогда, когда этот процесс будет термодинамически выгоден системе при условии: ΔF = Fж - Fтв, для чего необходимо некоторое переохлаждение. Температура, при которой практически идет кристаллизация Ткр. Разность между теоретической и фактической температурами кристаллизации называется степенью переохлаждения: ΔТ = Тпл – Ткр. Температурные кривые, характеризующие процесс охлаждения с различными скоростями, приведены на рис.8.
Рис.8 При медленном охлаждении, соответствующем кривой V1, степень переохлаждения невелика и кристаллизация протекает при температуре, близкой к равновесной. Горизонтальная площадка на температурной кривой объясняется выделением скрытой теплоты кристаллизации, которая компенсирует отвод тепла. С ростом скорости охлаждения (кривые V2, V3) степень переохлаждения растет, и процесс кристаллизации протекает при все более понижающейся температуре. Подобно тому, как при кристаллизации необходимо переохлаждение до фактической температуры кристаллизации, так и при плавлении необходим перегрев для достижения реальной температуры плавления. Процесс кристаллизации состоит из двух элементарных процессов: 1) зарождения центров кристаллизации; 2) роста кристаллов из этих центров. Суммарная скорость кристаллизации зависит от скорости обоих элементарных процессов: скорости зарождения центров кристаллизации (СЗ) и скорости роста кристалла из этих центров (СР). Величины СЗ и СР зависят от степени переохлаждения ΔТ (рис.9).
Рис.9 С увеличением ΔТ растет разность свободных энергий ΔF =Fж - Fтв, и при хорошей подвижности атомов СЗ и СР растут и достигают максимума. Последующее уменьшение СЗ и СР объясняется снижением подвижности атомов при снижении температуры. При очень сильном переохлаждении СЗ и СР равны нулю и жидкость не кристаллизуется, а образуется аморфное вещество. Аморфное состояние металлов достигается при скоростях охлаждения более 106 0С/с.
3. ДИАГРАММЫ СОСТОЯНИЯ (ФАЗОВОГО РАВНОВЕСИЯ) СПЛАВОВ 3.1. Методика построения диаграмм фазового состояния сплавов Элементы образующие сплав называют компонентами. Свойства сплава определяются составом компонент и их количественным соотношением. Наглядное представление дают диаграммы состояния сплава. Зная диаграмму состояния, можно представить полную картину формирования структуры любого сплава, определить оптимальную температуру заливки, оценить жидкотекучесть и возможность получения химической неоднородности, определить режим термической обработки, необходимый для данного сплава. Любое фазовое превращение сплава отмечается изменением физикомеханических свойств (электросопротивления, удельного объема и т.д.) либо тепловым эффектом. Переход сплава из жидкого состояния в твердое сопровождается значительным выделением теплоты, поэтому, измеряя температуру при нагреве или охлаждении в функции времени, можно по перегибам или остановкам на кривых охлаждения определить критические температуры, при которых происходят фазовые превращения. Диаграммы состояния строят в координатах температура - химический состав сплава. Для экспериментального построения диаграммы состояния сплавов, образованных компонентами А и В, необходимо изготовить серию сплавов с различным содержанием компонентов А и В. Для каждого сплава экспериментально определяют критические точки, т.е. температуры фазовых превращений. Полученные значения температуры откладывают на вертикальных линиях в соответствии с химическим составом сплавов. Соединяя критические точки, получают линии диаграммы состояния. |
|
 .
. .
.