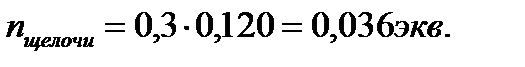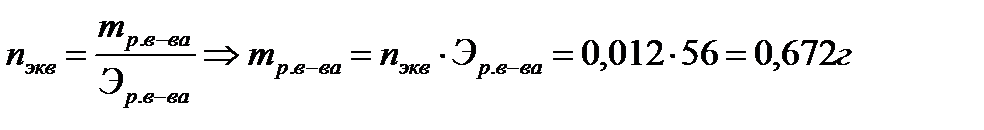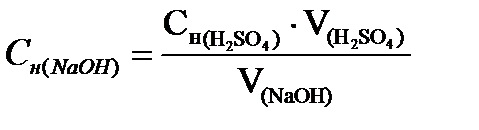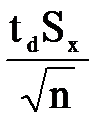|
|
ТИТРИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗАЦель работы:приобретение навыков в применении одного из методов количественного анализа – титриметрического, и обучение элементарным приемам статистической обработки результатов измерений.
Теоретическая часть Титриметрический анализ - это метод количественного химического анализа, основанный на измерении объема раствора реактива с точно известной концентрацией, расходуемого для реакции с определяемым веществом. Титриметрическое определение вещества проводится титрованием - добавлением одного из растворов к другому небольшими порциями и отдельными каплями при постоянном фиксировании (контроле) результата. Один их двух растворов содержит вещество в неизвестной концентрации и представляет собой анализируемый раствор. Второй раствор содержит реагент с точно известной концентрацией и называется рабочим раствором, стандартным раствором или титрантом. Требования к реакциям, применяемым при титриметрическом анализе: 1. Возможность фиксировать точку эквивалентности, наиболее широко используют наблюдение за его окраской, которая может меняться при следующих условиях: - одно из реагирующих веществ окрашено, и окрашенный реагент в процессе реакции изменяет свой цвет; - применяемые вещества – индикаторы - изменяют окраску в зависимости от свойств раствора (например, в зависимости от реакции среды). 2. Количественное течение реакции, вплоть до равновесия, характеризуемого соответствующей величиной константы равновесия 3. Достаточная скорость химической реакции, т.к. фиксировать точку эквивалентности при медленно текущих реакциях крайне трудно. 4. Отсутствие побочных реакций, при которых точные вычисления невозможны.
Методы титриметрического анализа можно классифицировать по характеру химической реакции, лежащей в основе определения веществ: кислотно-основного титрования (нейтрализации), осаждения, комплексообразования, окисления-восстановления. Работа с растворами. Мерные колбы предназначены для измерения точного объема жидкости. Они представляют собой круглые плоскодонные сосуды с узким длинным горлом, на котором имеется метка, до которой следует наполнять колбу (рис. 1).
Рис.1 Мерные колбы Техника приготовления растворов в мерных колбах из фиксаналов. Для приготовления раствора из фиксанала ампулу разбивают над воронкой, вставленной в мерную колбу, содержимое ампулы смывают дистиллированной водой; затем растворяют его в мерной колбе. Раствор, находящийся в мерной колбе, доводят до метки. После доведения уровня жидкости до метки раствор в колбе хорошо перемешивают. Бюретки представляют собой тонкие стеклянные трубки, градуированные в миллилитрах (рис. 2). К нижнему, слегка суженному концу бюретки припаян стеклянный кран или присоединен резиновый шланг с шариковым затвором и стеклянным носиком. Для работы выбирают бюретку в зависимости от объема раствора, применяемого в анализе.
Рис.2. Бюретки Порядок работы с бюреткой 1. Бюретку промывают дистиллированной водой. 2. Подготовленную к работе бюретку закрепляют вертикально в штативе, с помощью воронки наливают в бюретку раствор так, чтобы его уровень был выше нулевой отметки. 3. Из нижнего оттянутого конца бюретки удаляют пузырьки воздуха. Для этого отгибают его кверху и выпускают жидкость до тех пор, пока весь воздух не будет удален. Затем опускают капилляр вниз. 4. Уровень жидкости в бюретке устанавливают на нулевое деление. 5. При проведении титрования нажимают на резиновую трубку сбоку от шарика и сливают жидкость из бюретки в колбу, вращая последнюю. Сначала титрант, находящийся в бюретке, сливают тонкой струйкой. Когда же окраска индикатора в месте падения капель титранта начнет изменяться, раствор приливают осторожно, по каплям. Титрование прекращают, когда наступает резкое изменение окраски индикатора от приливания одной капли титранта, и записывают объем израсходованного раствора. 6. По окончании работы титрант из бюретки сливают, бюретку промывают дистиллированной водой. Метод кислотно-основного титрования (нейтрализации) Метод кислотно-основного титрования основан на реакции взаимодействия кислот и оснований, т.е. на реакции нейтрализации: H+ + OH¯ = H2O При выполнении данного задания используется метод кислотно-основного титрования, основанный на применении реакции нейтрализации: 2NaOH + H2SO4 = Na2SO4 + 2H2O Метод заключается в том, что к раствору определяемого вещества - гидроксида натрия – постепенно прибавляют раствор серной кислоты известной концентрации. Добавление раствора кислоты продолжают до тех пор, пока его количество не станет эквивалентным количеству реагируемого с ним гидроксида натрия, т.е. до нейтрализации щёлочи. Момент нейтрализации устанавливают по изменению окраски индикатора, прибавляемого в титруемый раствор. По закону эквивалентов в соответствии с уравнением:
Сн(к-ты)· V(к-ты)= Cн (щелочи)· V(щелочи)
Сн(к-ты)и Cн (щелочи) – молярные концентрации эквивалентов реагирующих растворов, моль/л; V(к-ты)и V(щелочи)– объёмы реагирующих растворов, л (мл).
С(NaOH) и V(NaOH) и Примеры решения задач. 1. На нейтрализацию 0,05 л раствора кислоты израсходовано 20 см3 0,5н раствора щелочи. Чему равна нормальность кислоты?
2. Сколько и какого вещества останется в избытке, если к 60см3 0,4н раствора серной кислоты прибавить 120см3 0,3н раствора гидроксида калия?
Решение задач по определению рН раствора, концентраций различного типа представлено в методическом пособии [2].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Получите у лаборанта колбу с раствором щёлочи неизвестной концентрации. Пробы анализируемого раствора отмерьте мерным цилиндром по 10 мл в три конические колбы для титрований. В каждую из них добавьте 2-3 капли индикатора метилового оранжевого. Раствор приобретёт жёлтую окраску (метилоранж жёлтый в щелочной среде и оранжево-красный в кислой).
Приготовьте к работе установку для титрований (рис.3) Бюретку ополосните дистиллированной водой, а затем заполните раствором серной кислоты точно известной концентрации (молярная концентрация эквивалента H2SO4 указана на склянке) выше нулевого деления. Каучуковую трубку со стеклянным наконечником отогните вверх и, оттягивая резину от стеклянной оливы, закрывающей выход из бюретки, медленно выпускайте жидкость так, чтобы после заполнения наконечника в нём не осталось пузырьков воздуха. Избыток раствора кислоты выпустите из бюретки в подставленный стакан, при этом нижний мениск жидкости в бюретке должен установиться на нулевом делении. Одну из колб раствора щёлочи подставьте под наконечник бюретки на лист белой бумаги и приступайте непосредственно к титрованию: одной рукой медленно подавайте кислоту из бюретки, а другой непрерывно перемешивайте раствор круговым движением колбы в горизонтальной плоскости. В конце титрования раствор кислоты из бюретки следует подавать по каплям до тех пор, пока от одной капли раствор примет неисчезающую оранжевую окраску. Определите объём кислоты, израсходованный на титрование, с точностью до 0,01мл. Отсчёт делений бюретки производите по нижнему мениску, при этом глаз должен находиться на уровне мениска. Повторите титрование ещё 2 раза, начиная каждый раз с нулевого деления бюретки. Результаты титрований запишите в таблицу 1. Концентрацию раствора щёлочи вычислите по формуле:
Таблица 1 Результаты титрования раствора гидроксида натрия
Проведите статистическую обработку результатов титрований по методике, описанной в приложении. Результаты статистической обработки экспериментальных данных сведите в таблицу 2. Таблица 2 Результаты статистической обработки экспериментальных данных титрования раствора гидроксида натрия. Доверительная вероятность α = 0,95.
Запишите результат определения молярной концентрации эквивалента NaOH в анализируемом растворе в виде доверительного интервала. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Раствор гидроксида калия имеет рН =12. Концентрация основания в растворе при 100% диссоциации равна … моль/л. 1) 0,005; 2) 0,01; 3) 0,001; 4) 1·10-12 ; 5) 0,05.
2. На нейтрализацию 0,05 л раствора кислоты израсходовано 20 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты? 1) 0,2 н; 2) 0,5 н; 3) 1,0 н; 4) 0,02 н; 5) 1,25 н. 3. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н раствора серной кислоты прибавить 125 см3 0,2 н раствора гидроксида калия? 1) 0,0025 г щелочи; 2) 0,0025 г кислоты ; 3) 0,28 г щелочи; 4) 0,14 г щелочи; 5) 0,28 г кислоты.
4. Метод анализа, основанный на определении повышения температуры кипения, называется… 1) спектрофотометрический; 2) потенциометрический; 3) эбулиоскопический; 4) радиометрический; 5) кондуктометрический.
5. Определить процентную концентрацию, молярность и нормальность раствора серной кислоты, полученного при растворении 36 г кислоты в 114 г воды, если плотность раствора 1,031 г/см3. 1) 31,6 ; 3,77; 7,54 ; 2) 31,6; 0,00377; 0,00377 ; 3) 24,0 ; 2,87; 2,87 ; 4) 24,0 ; 0,00287; 0,00287; 5) 24,0; 2,87; 5,74. ПРИЛОЖЕНИЕ |
|
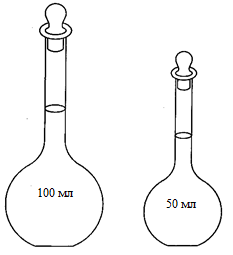


 - молярные концентрации эквивалента NaOH и H2SO4 в реагирующих растворах, моль/л;
- молярные концентрации эквивалента NaOH и H2SO4 в реагирующих растворах, моль/л;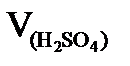 ) - объёмы реагирующих растворов щёлочи и кислоты, мл.
) - объёмы реагирующих растворов щёлочи и кислоты, мл.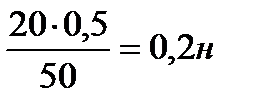

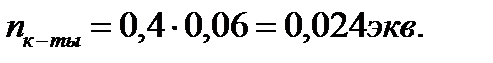 ;
;