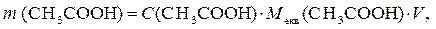|
|
Визначення масової частки оцтової кислотиТитрування Актуальність теми Діагностика багатьох захворювань, першза все, базується на даних клінічних, біохімічних, фізико-хімічних методів аналізу. Одним з основних методів хімічного аналізу є титриметричний аналіз. Він охоплює й метод нейтралізації в двох його варіантах: алкаліметрія та ацидиметрія. Метод нейтралізації застосовується для визначення кислотності шлункового соку,сечі,інших біологічних рідин, вмісту хлоридів у сироватці крові. У санітарно-гігієнічному аналізі метод нейтралізації застосовується для дослідження питної води, визначення кислотності харчових продуктів. Основні поняття про теорію та методи титриметричного аналізу, і метод нейтралізації зокрема, необхідні студенту для вивчення біохімії, фармакології, гігієни. Конкретні цілі 1. Аналізувати принципи титриметричних методів дослідження. 2. Аналізувати кількісний вміст у розчині кислот та основ за допомогою методів кислотно-основного титрування. Базові знання, вміння, навички, необхідні для вивчення теми Знати суть реакції нейтралізації. Мати навички використання індикаторів. Вміти використовувати формули масової частки, молярної концентрації та молярної концентрації еквівалента для проведення розрахунків. 4.Завдання для самостійної роботи під час підготовки до заняття 4.1. Теоретичні питання до заняття: 1. Основи титриметричного аналізу. 2. Методи кислотно-основного титрування. 3. Кислотно-основні індикатори та принципи їх підбору.
4.2. Практична робота (завдання), що виконується студентами на занятті Ознайомлення з методикою виконання об’ємного аналізу Для одержання правильних результатів всі операції в об’ємному аналізі слід виконувати дуже ретельно. Перед початком роботи потрібно переконатися в наявності необхідного посуду та його готовності до роботи, уважно ознайомитися з методикою аналізу, приготувати зошит для запису результатів. Наповнення бюретки робочим розчином Бюретку обполіскують спочатку дистильованою водою, а потім розчином, яким будуть її заповнювати. Після цього робочий розчин наливають у бюретку трохи вище нульової поділки. Пухирець повітря із носика бюретки виганяють, відігнувши злегка носик догори й надавлюючи при цьому на затискач (чи кульку) бюретки. Після того, як носик повністю заповнений розчином та вийнята лійка, через яку наливали розчин, встановлюють рівень розчину на нульовій поділці. Натискуючи на затискач, по краплях випускають розчин із бюретки доти, доки нижня частина меніску безбарвного розчину або верхня частина меніску забарвленого розчину не буде на рівні нульової поділки. Проводити відлік слід завжди так, щоб око знаходилося на одному рівні з меніском. Відмірювання розчинів піпетками Хімічні піпетки використовують, щоб відібрати точний об’єм потрібного розчину. Спочатку піпетку обполіскують, набираючи цей розчин приблизно до половини. При цьому занурюють піпетку в розчин майже до дна. Набирають розчин трохи вище мітки. Верхній кінець піпетки швидко затискують пальцем, піпетку виймаютьіз розчину. Послаблюючи тиск пальця, дають надлишку розчину витекти по краплях, щоб меніск встановився точно проти мітки. Обережно, слідкуючи, щоб розчин не капав, підносять піпетку до колби, в яку потрібно перенести відмірений об’єм розчину. Тримаючи піпетку вертикально, відкривають верхній її кінець і дають розчину витекти (носик піпетки при цьому повинен торкатися до внутрішньої стінки горла колби). Залишок розчину не видувають і не витрушують. Розчин, що підлягає титруванню, часто повинен містити й додаткові компоненти, які створюють певне середовище, або реагують з певною речовиною, перетворюючи її в форму, необхідну для титрування. Розчини цих компонентів відмірюють мірними циліндрами або піпетками. Проведення титрування Конічну колбу з розчином, підготовленим для титрування, розміщують на білому папері під носиком бюретки. Кінчик носика повинен знаходитися на рівні горла колби. Натискуючи великим і вказівним пальцями лівої руки на затискач (або кульку), вилучають розчин у колбочку невеликими порціями. Правою рукою обережно струшують колбу для швидкого перемішування розчину. Про наближення кінця титрування свідчить те, що в місці падіння краплі робочого розчину в колбі розчин набуває характерного для кінця титрування забарвлення. Тоді робочий розчин починають додавати по одній краплі. Після стійкої зміни забарвлення титрування припиняють і визначають об’єм робочого розчину, витраченого на титрування. Титрування проводять не менше трьох разів. Визначення масової частки оцтової кислоти За допомогою піпетки відібрати 10,0 мл розчину оцтової кислоти й перенести в конічну колбу ємністю 50 ̶ 100 мл, додати 2 ̶ 3 краплі фенолфталеїну й титрувати з бюретки робочим розчином натрій гідроксиду до появи блідо-рожевого забарвлення. Визначити (за шкалою бюретки) об'єм робочого розчину лугу, витраченого на титрування. Повторити титрування ще двічі та з одержаних результатів вирахувати середнє арифметичне значення об’єму NaOH Vсер (NaOH):
де V1, V2, V3 – об’єми розчину NaOH у паралельних титруваннях, мл.
Розрахунок масової частки оцтової кислоти:
1) знайти молярну концентрацію еквівалента оцтової кислоти в розчині:
де С(NaOH) – молярна концентрація розчину NaOH, моль/л, V (СН3СООН) – об’єм розчину оцтової кислоти, що був узятий для титрування, мл;
2) знайти масу оцтової кислоти в одному літрі розчину:
де Мекв(СН3СООН) – молярна маса еквівалента СН3СООН, г/моль, V = 1л – об’єм розчину кислоти;
3) знайти масову частку оцтової кислоти в наважці (наважка – це певна маса концентрованої оцтової кислоти, з якої готувався 1 л розчину, що до-сліджувався):
|
|