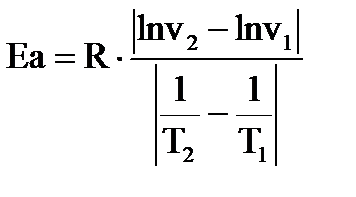|
|
Энергия активации: 38 кДж/мольКинетика химических реакций Цель работы. Изучение кинетики реакции: H2SO4 + Na2S2O3 ® Na2SO4 + SO2 + H2O +S¯ 1.Выявление зависимости скорости реакции взаимодействия раствора серной кислоты постоянной концентрации и раствора соли [тиосульфат натрия (Na2S2O3)] переменной концентрации от концентрации соли. Определение кинетического порядка реакции по соли. 2.Установление зависимости скорости реакции от температуры. Определение энергии активации (Еа) и температурного коэффициента (g ) реакции. Для выполнения и защиты лабораторной работы студент должен знать: Зависимость скорости реакции от концентрации реагирующих веществ при постоянной температуре (ЗДМ – закон действующих масс): v = k(T)×Cкx×Ccy , где v -скорость реакции;k(T) – константа скорости реакции (постоянная величина при Т= const); Cки Cc – концентрация кислоты и соли [
Зависимость константы скорости реакции от температуры (уравнение Аррениуса):
Еа – энергия активации реакции [ Температурный коэффициент (Вант-Гоффа) реакции g : g= Выполнение работы Измерение скорости реакции v: v = 1 / t (с-1)- скорость реакции;v ~ ∆С / ∆ t t (с) – время протекания реакции - время между моментом сливания растворов кислоты и соли, и моментом визуальной регистрации образования осадка серы (помутнение раствора). Измеряется секундомером с точностью ±0.5 с. Поскольку скорость исследуемой реакции является функцией трех параметров (температура, концентрации реагентов - соли и кислоты), то, изучая кинетику реакции, определяют влияние на скорость реакции только одного параметра, два других не меняют, оставляя их постоянными. 1. Экспериментальное определение зависимости скорости реакции от концентрации соли (Ск–const; Т–const). - Расчет объемов реагентов. Суммарный объем растворов реагентов во всех опытах равен 25 см3. Объем раствора кислоты во всех опытах равен Vк = 5 см3 (Ск–const). Для приготовления различных значений концентрации водных растворов соли, остальной объем (20 см3) будут составлять раствор соли Vс, с концентрацией С0= 0.5 - Выполнение измерений. При помощи бюреток с водой, раствором соли и кислоты помещают: - в измерительный стакан соответствующие объемы воды и раствора соли (Vс + Vв = 20 см3) - в пробирку раствор кислоты (Vк = 5 см3) - приливают раствор кислоты из пробирки в измерительный стакан и по секундомеру определяют время протекания реакции. - результаты измерений и расчетов вносят в таблицу 1 - по экспериментальным точкам строят график v=f(Cc) - по виду графика определяют кинетический порядок реакции по соли (y) Таблица 1
Пример заполнения табл.1
Пример построения графика по данным табл.1
2. Экспериментальное определение зависимости скорости реакции от температуры (Ск–const; Сс –const). - Выполнение измерений. Измерение скорости реакции определяют так же, как и в первой части работы, при выполнении следующих условий: - определение скорости реакции проводят при различных температурах, для чего перед измерением стакан с раствором соли и пробирку с раствором кислоты помещают в водяной термостат (10°C - 60°C) на 3-5 мин. Температура растворов контролируется по термометру; -после стабилизации температуры растворов их сливают и по секундомеру определяют время протекания реакции. - результаты измерений и расчетов заносят в таблицу 2; - по экспериментальным точкам строят график v=f(Т), из которого определяют температурный коэффициент реакции g; - по экспериментальным точкам строят график lnv=f(1/Т), из которого определяют энергию активации реакции Еа Таблица 2
Пример заполнения табл.2
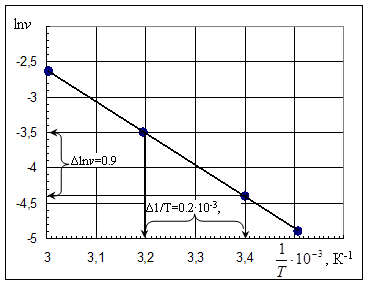
Пример построения графиков по данным табл.2
Пример нахождения температурного коэффициента реакции γ:(среднее из 3-х значений γi). Из графика v=f(Т)для V40и V30 Пример нахождения энергии активации Еа : Из графика lnv=f(1/Т) lnv2 = - 4,4, lnv1 = - 3,5; 1/Т2 = 3,4∙10-3, 1/Т1 = 3,2∙10-3 Еа =8,314 ∙│-4,4 – (-3,5)│/│3.4 – 3,2│∙10-3 =8,314 ∙ 0.9/0.2∙10-3 = 37900 Дж/моль ≈ 38кДж/моль Энергия активации: 38 кДж/моль |
|
 ]; x, y – кинетический порядок реакции по кислоте и соли (стехиометрические коэффициенты в молекулярном уравнении); (x + y)- суммарный кинетический порядок реакции
]; x, y – кинетический порядок реакции по кислоте и соли (стехиометрические коэффициенты в молекулярном уравнении); (x + y)- суммарный кинетический порядок реакции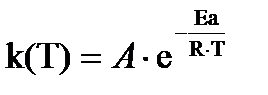 , где
, где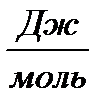 ]; Т– температура [К]; R = 8,314 [
]; Т– температура [К]; R = 8,314 [ 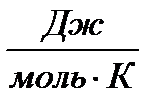 ] - универсальная газовая постоянная, А – частотный фактор
] - универсальная газовая постоянная, А – частотный фактор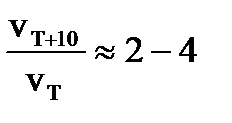
 Порядок реакции по соли равен 1.
Порядок реакции по соли равен 1.
 . Также находятγ для V30 / V20 и V50 / V40,а затемγ,как среднее из 3-х найденных значений.
. Также находятγ для V30 / V20 и V50 / V40,а затемγ,как среднее из 3-х найденных значений.