|
|
IV. Талдау жолында кездесетін реакцияларC) AgJ D) AgCNS E) AgF 7. Калий ионын Na3[Co(NO2)6] қосылысымен ашу кезінде кедергі келтіретін реагент: A) CH3COOH B) CaCl2 C) NH4Cl D) NaCl E) BaCl2 8. Күміс хлориді тұнбасы еритін реагент: А) HCl сұй. В) KJ С) HNO3 конц. D) NH3·H2O Е) NaOH 9. Күміс хлориді еритін қосылыс: А) KCN В) H2SO4 С) NaOH D) HNO3 Е) HCl 10. Ерігіштігін төмендету үшін этил спиртін қосатын тұнба: А) SrSO4 В) PbSO4 С) CaSO4 D) Ag2SO4 Е) BaSO4 11. Ba2+, Pb2+, Ca2+ катиондарының тұздарына аммоний сульфатының артық мөлшерін қосқанда түзілетін тұнба: A) PbSO4, BaSO4, CaSO4 B) BaSO4 C) PbSO4, BaSO4 D) BaSO4, CaSO4 E) PbSO4 12. Каломель тұнбасын ерітетін қосылыс: A) Концентрлі аммиак ерітіндісі. B) Концентрлі аммоний ацетаты ерітіндісі. C) Патша сұйығы. D) Сұйытылған сірке қышқылы. E) Сұйытылған күкірт қышқылы. 13. Қорғасын мен барий сульфаттарын бөлу үшін қолданылатын реагент: A) HCl B) NH4Cl C) CH3COONH4 D) NH4OH E) NaOH 14. Sr2+- ионын Ca2+- ионынан бөлу үшін қолданылатын реагент: А) H2SO4 В) NH3 С) NaOH D) (NH4)2SO4 Е) CH3COONH4 15. ІІ топ катиондарының хлоридтерін ыстық сумен өңдегенде ерітіндіге көшетін катион: A) Ag+ B) Pb2+ C) Sr2+ D) Ca2+ E) Ba2+ 16. Ерімейтін ІІІ аналитикалық топ катиондары сульфаттарын оңай еритін қосылыстырға айналдырады: A) HCl + HNO3 қоспасымен өңдеу арқылы. B) NH4OH қатысында қыздыру арқылы. C) HNO3 қатысында қыздыру арқылы. D) Қыздыру арқылы. E) Na2CO3 қаныққан ерітіндісімен өңдеп, қышқылдарда еріту арқылы. 17. Стронций ионын анықтайтын реагент: A) Na3[Co(NO2)6] B) H2SO4 сұй. C) HCl сұй. D) K3[Sb(OH)6] E) Na2Pb[Cu(NO2)6] 18. Күміс иодиді тұнбасының түсі: A) Сары. B) Ақ. C) Қызғылт-сары. D) Қара. E) Жасыл. 19. Қорғасын ионын анықтайтын спецификалық реакция: A) NaOH B) SnCl2 C) KJ D) Na3[Co(NO2)6] E) СН3СООН 20. Жоғары температурада аммоний тұздарынан аммиакты ығыстырып шығаратын реагент: А) KCl В) NaNO3 С) HCl D) CH3COOH Е) KOH 21. Калий ионын NaHC4H4O6 реагентімен ашу кезінде кедергі келтіретін ион: A) Na+ B) NH4+ C) Mg2+ D) Ba2+ E) Ca2+ 22. Ag+ ионын K2CrO4 ерітіндісімен анықтауға кедергі жасайтын катион: A) Ca2+ B) Al3+ C) NH4+ D) Zn2+ E) Ba2+ 23. CrO42- ионымен нашар еритін тұз түзбейтін катион: A) Ag+ B) Ba2+ C) Pb2+ D) Ca2+ E) Sr2+ 24. Ақ түсті тұнба: A) NH4HC4H4O6 B) K2Na[Co(NO2)6] C) [NH2Hg2O]J D) NaZn(UO2)3(CH3COO)9·9H2O E) K2Pb[Cu(NO2)6] 25. (NH4)2S әсер еткенде сульфид түрінде тұнба түзбейтін тұз: A) Mn(NO3)2 B) FeSO4 C) AlCl3 D) ZnCl2 E) CoCl2 26. CaSO4 еритін реагент: А) CH3COOH В) NaOH С) HClсұй. D) (NH4)2SO4 Е) H2SO4 артық мөлшері. 27. Аммиактың артық мөлшерінде комплекс түзетін қосылыс: А) Pb(OH)2 В) SnCl2 С) PbJ2 D) Ag2O Е) H2O 28. Аммиакатты комплексті қосылыстарды бұзуға пайдаланады: А) Сұйылтуды. В) Қыздыруды. С) Қышқылдандыруды. D) Тотықтыруды. Е) Тотықсыздандыруды. 29. Калий ионын анықтау үшін қолданылатын комплексті қосылыс: A) K2[HgJ4] + KOH B) Na3[Co(NO2)6] C) K4[Fe(CN)6] D) [Ag(NH3)2]Cl E) [Cu(NH3)4]SO4 30. Аммоний ионын анықтау үшін қолданылатын комплексті қосылыс: A) K2[HgJ4] + KOH B) Na3[Co(NO2)6] C) K4[Fe(CN)6] D) [Ag(NH3)2]Cl E) [Cu(NH3)4]SO4
6.1. Тақырыбы: №10. IV-VI аналитикалық топтар катионына тән реакциялар. IV-VI аналитикалық топтар қоспаларының анализі. 6.2. Мақсаты Студенттерді IV-VIаналитикалық топ катиондарына тән сапалық реакциялармен таныстыру. 6.3. Дәріс тезисі Тақырыптың негізгі сұрақтары
IV-ші аналитикалық топ катиондарына тән сапалық реакциялар Қышқылдық-негіздік жіктеу бойынша бұл топтың топ реагенті NaOH + H2O2. Натрий немесе калий гидроксидімен әрекеттесіп, олардың артық мөлшерінде еритін гидроксидтер түрінде тұнбаға түседі. Топ реагенті NaOH-тың эквивалентті мөлшерінің әсері: AlCl3 + 3NaOH ® Al(OH)3¯ + 3NaCl CrCl3 + 3NaOH ® Cr(OH)3¯ + 3NaCl ZnCl2 + 2NaOH ® Zn(OH)2¯ + 2NaCl SnCl2 + 2NaOH ® Sn(OH)2¯ + 2NaCl SnCl4 + 4NaOH ® Sn(OH)4¯ + 4NaCl Na3AsO3 + NaOH ® әсер етпейді Na3AsO4 + NaOH ® әсер етпейді Түзілген Al(OH)3, Zn(OH)2, Sn(OH)2, Sn(OH)4 тұнбалары ақ, ал Cr(OH)3 тұнбасы сұр-жасыл түсті. NaOH-нің артық мөлшерінің әсері: Al(OH)3¯ + NaOH ® NaAlO2 + 2H2O Cr(OH)3¯ + NaOH ® NaCrO2 + 2H2O Zn(OH)2¯ + 2NaOH ® Na2ZnO2 + 2H2O Sn(OH)2¯ + 2NaOH ® Na2SnO2 + 2H2O Sn(OH)4¯ + 2NaOH ®Na2SnO3 + 3H2O Na3AsO3 + NaOH ® әсер етпейді Na3AsO4 + NaOH ® әсер етпейді NaOH артық мөлшері және H2O2 қатысында (t ˚C): 2CrCl3 + 10NaOH + 3H2O2 = 2Na2CrO4 + 6NaCl + 8H2O
SnCl2 + 4NaOH + H2O2 = Na2SnO3 + 2NaCl + 3H2O
H3AsO3 + 3NaOH + H2O2 = Na3AsO4 + 4H2O
Сутек пероксидінің әсерінен As(III) → As(V), Cr(III) → Cr(VI), Sn(II) → Sn(IV) дейін тотығады, яғни тотығу дәрежелерін арттырады. ІV-ші аналитикалық топ катиондары қоспасын талдау. ІV-ші аналитикалық топ катиондары Al3+, Cr3+, Zn2+, Sn2+, Sn4+, As3+, As+5. Зерттелетін ерітіндіні жақсылап араластырып екіге бөледі. Бірінші бөлігінен ІV-ші аналитикалық топ катиондарын ашады, ал екінші бөлігін талдауды қайталау қажет болған жағдайға қалдырады. І. Алғашқы байқау ü ерітінді түсі; ü тұнбаның бар-жоғы және оның түсі; ü ортаның рН (универсал индикаторымен анықталады). ІІ. Бөлшектік талдау - хромды ерітіндідегі өзіне тән түсі және оның хром қышқылына дейін тотығып, көк түске боялуы бойынша; - мышьякты(ІІІ, V) AsH3↑ дейін тотықсыздануы бойынша; - қалайыны(ІІ) сілтілік ортада висмут(ІІІ) тұзының әсерінен қара түсті Bi↓ пайда болуы бойынша; - алюминийді ализарин көмегіменмен анықтауға болады. ІІІ Жүйелік талдау ІV-ші аналитикалық топ катиондары гидроксидтерін алу және оларды еріту. Зерттелетін ерітіндінің 8-10 тамшысына 5-7 тамшы 3% H2O2 және 6н NaOH ерітіндісін түзілген тұнба ерігенше қосады. Шыны таяқшамен жақсылап араластырып, 5 минуттай су моншасында қыздыру қажет. Ерітіндіде ІV-ші аналитикалық топ катиондары AlO2-, CrO42-, ZnO22-, SnO32-, AsO43- аниондар түрінде болады. Ерітінді AlO2-, CrO42-, ZnO22-, SnO32-, AsO43-. ІV-ші аналитикалық топ иондарының амфотерлік қасиетіне сүйеніп, алынған ерітіндіге HCl қосу арқылы аниондарды катиондарға айналдырады (бұл кезде CrO42- ионы қышқылдық ортада Cr2O72- ионына өтеді, түсі қызыл-сары; AsO43- ионы өзгеріссіз қалады). Ерітіндіде Al3+, Cr2O72-, Zn2+, Sn4+, AsO43- иондары. Қалайы және алюминий иондарын гидроксидтер түрінде тұнбаға түсіру. Алюминий және қалайы иондарының гидролиздену қабілетін пайдаланып, оларды басқа иондардан бөледі. Ерітіндіге Al3+, Cr2O72-, Zn2+, Sn4+, AsO43- араластыра отырып, тамшылатып аммиактың иісі сезілгенше немесе фенолфталеин қағазында қызғылт түс пайда болғанша NH4OH қосып, қыздырады. Егер ерітіндіде алюминий және қалайы тұздары бар болса, олар гидроксидтер түрінде Al(OH)3, Sn(OH)4 тұнбаға түседі. Центрифугамен тұнбаны ерітіндіден бөледі. Ерітіндіде CrO42-, AsO43-, [Zn(NH3)4]2+ иондары болуы мүмкін. Қалайы және алюминий гидроксидтері тұнбасын еріту және Al3+, Sn4+ иондарын ашу. Қалайы және алюминий гидроксидтері тұнбасын 1-2 рет дистилденген сумен жуады, содан кейін 2н HCl ерітіндісінде ерітеді. Ерітіндіні екіге бөліп, біріншісінен Al3+ , екіншісінен [SnCl6]2- иондарын арнайы реакцияларымен ашады. Al3+ ионын ашу. Al3+ ионын ализаринмен анықтайды. [SnCl6]2- ионын ашу. Ерітіндіге аздаған темір ұнтағын салып, 5 минут қайнатады (бұл кезде Sn4+®Sn2+ айналады). Қоспаны суытады, ұнтақты сүзіп бөледі. Ерітіндіге тамшылатып артық мөлшерде NaOH (рН > 10) қосады, центрифугамен түзілген Fe(OH)2 тұнбасын бөледі. Ерітіндіден Hg2+ немесе Ві3+ тұздары көмегімен Sn2+ ионын анықтайды. Мырыш иондарын оксикарбонат күйінде бөлу және ашу. CrO42-, AsO43-, [Zn(NH3)4]2+ иондары бар ерітіндіге CH3COOH ерітіндісін қосады (бұл кезде [Zn(NH3)4]2+®Zn2+, CrO42-®Cr2O72- айналады, AsO43- ионы өзгеріссіз қалады). Содан кейін, Na2CO3 қаныққан ерітіндісін сілтілік орта болғанша қосып, қыздырады. Егер ерітіндіде мырыш ионы бар болса, (ZnOH)2CO3 ақ тұнбасы түзіледі. Центрифугамен тұнбаны ерітіндіден бөледі. Ерітіндіде CrO42-, AsO43- иондары болуы мүмкін. Алынған (ZnOH)2CO3 тұнбасын 2н СН3СООН ерітіндісінде ерітеді, ерітіндіден Zn2+ ионын арнайы реакциялармен (дитизон, K4[Fe(CN)6] және т.б.) анықтайды CrO42-, AsO43- иондарын ашу. CrO42-, AsO43- иондары бар ерітіндіні екіге бөліп, біріншісінен CrO42-, екіншісінен AsO43- иондарын арнайы реакцияларымен ашады. CrO42- ионын ашу. Бірнеше реакциялармен анықтауға болады (Ва2+ ионымен сары тұнбаның түзілуі, сутек пероксидімен қышқылдық ортада көк түсті надхром қышқылының алынуы және т.б., ерітіндінің сары түсінің өзі CrO42- ионының бар екенін дәлелдейді). AsO43- ионын ашу. AsO43- ионының бар екенін магнезиалды қоспамен немесе молибден сұйығымен анықтауға болады. ІV-ші аналитикалық топ катиондары қоспасын талдаудың қысқаша схемасы
V-ші аналитикалық топ V-ші аналитикалық топтың топ реагенті NaOH, реагенттің артық мөлшерінде түзілген тұнбалар ерімейді: MgCl2 + 2NaOH → Mg(OH)2¯ + 2NaCl MnCl2 + 2NaOH → Mn(OH)2¯ + 2NaCl Bi(NO3)3 + 3KOH → Bi(OH)3¯ + 3NaNO3 FeCl2 + 2NaOH → Fe(OH)2¯ + 2NaCl FeCl3 + 3NaOH → Fe(OH)3¯ + 3NaCl SbCl3 + 3NaOH → Sb(OH)3¯ + 3NaCl H[SbCl6] + 5NaOH → HSbO3¯ + HCl + 5NaCl + 2H2O Түзілген Mn(OH)2, Bi(OH)3, Sb(OH)3, HSbO3, Mg(OH)2 тұнбалары ақ; Fe(OH)2 ақ тұнба, бірақ бірден кір жасыл түске өтеді одан ауада тотығып, темірдің(ІІІ) гидроксидіне өтеді; Fe(OH)3 тұнбасы қызыл-қоңыр түсті. NaOH және 3% H2O2 қатысында (t ˚C) топтағы кейбір катиондармен жүретін реакциялар: MnSO4 + 2NaOH + H2O2 → MnO(OH)2¯ + Na2SO4 + H2O
2FeCl2 + 4NaOH + H2O2 → 2Fe(OH)3¯ + 4NaCl
SbCl3 + 3NaOH + H2O2 → HSbO3¯ + 3NaCl + 2H2O
VІ-шы аналитикалық топтың топ реагенті NH4OH, эквивалентті мөлшерінің әсері: 2CuSO4 + 2NH4OH → (CuOH)2SO4¯ + (NH4)2SO4 Co(NO3)2 + NH4OH → CoOHNO3¯ + NH4NO3 CdCl2 + 2NH4OH → Cd(OH)2¯ + 2NH4Cl 2NiSO4 + 2NH4OH → (NiOH)2SO4¯ + (NH4)2SO4 HgCl2 + 2NH4OH → [HgNH2]Cl¯ + NH4Cl + 2H2O Түзілген Cd(OH)2, [HgNH2]Cl тұнбалары ақ, (CuOH)2SO4 көгілдір-жасыл, (NiOH)2SO4 жасыл, CoOHNO3 көгілдір түсті. Топ реагенті NH4OH артық мөлшерінің әсері: Cu(OH)2SO4 + 8NH4OH → [Cu(NH3)4]SO4 + [Cu(NH3)4](OH)2 + 8H2O 2CoOHNO3+12NH4OH → [Co(NH3)6](NO3)2 + [Co(NH3)6](OH)2+ 2H2O Cd(OH)2 + 4NH4OH → [Cd(NH3)4](OH)2 + 4H2O (NiOH)2SO4 + 12NH4OH → [Ni(NH3)6]SO4 + [Ni(NH3)6](OH)2 + 12H2O HgCl2 + 4NH4OH → [Hg(NH3)4]Cl2 + 4H2O Түзілген комплексті қосылыстар [Cu(NH3)4]SO4 - көк, [Co(NH3)6](NO3)2 – сары, [Hg(NH3)4]Cl2 және [Cd(NH3)4](OH)2 – түссіз, [Ni(NH3)6]SO4 – көк-күлгін түсті. V-ші аналитикалық топ катиондары қоспасын талдау. V-ші аналитикалық топ катиондары Mg2+, Mn2+, Bi3+, Fe2+, Fe3+, Sb3+, Sb+5. V-ші аналитикалық топ катиондар қоспасының жүйелік талдау жолында олардың қосылыстарының кейбір ерекшеліктерін: висмут және сурьма тұздарының гидролиздерін, сурьманың негіздік тұздарының шарап қышқылында ерігіштігін, марганец оксидінің сұйылтылған азот қышқылында ерімейтіндігін, магний гидроксидінің аммоний хлориді ерітіндісінде ерігіштігін ескеру қажет. І. Алғашқы байқау ü ерітінді түсі; ü тұнбаның бар-жоғы және оның түсі; ü ортаның рН (универсал индикаторымен анықталады). ІІ. Бөлшектік талдау Fe2+, Fe3+ катиондарын ашу. Fe2+ катионын калий гексацианоферраты(ІІІ) ерітіндісімен - K3[Fe(CN)6], ал Fe3+ катионын калий гексацианоферраты(ІІ) - K4[Fe(CN)6] ерітіндісімен бесінші топ катиондары бар тұздардың қоспасынан қышқылдық ортада анықтайды. ІІІ. Жүйелік талдау Sb3+, Bi3+ катиондарын ашу. Тұнба болған жағдайда тұнбаны хлорсутек қышқылында ерітіп, ерітіндінің pH-ын 4-6-ға дейін келтіреді. Содан соң бес есе артық дистилденген су қосады. Түзілген висмут және сурьманың негіздік тұздарының тұнбасын центрифугалайды, тұнбаны 1н шарап қышқылымен өңдейді. Сурьманың негіздік тұздары мен гидроксидтері бұл жағдайда шарап қышқылында еріп кетеді. Висмут туындылары (BiOCl) тұнбада қалады. Алынған шарап қышқылды ерітіндіден Sb3+ катиондарын кез келген сапалық реакцияларымен ашады. Висмуттың негіздік тұзы бар тұнбаны дистилденген сумен шаяды және концентрлі хлорсутек қышқылында ерітеді. Bi3+ катионын сілтілік ортада қалайы(ІІ) хлоридімен немесе басқа да сапалық реакцияларымен ашады. Mg2+, Mn2+, Fe3+ катиондарын ашу. Fe2+, Fe3+, Mg2+, Mn2+ катиондары бар центрифугатты натрий гидроксиді немесе калий гидроксиді ерітіндісімен өңдеп, сутек пероксидін қосады, қыздырады және центрифугалайды. Алынған темір(ІІІ) гидроксиді, марганец оксиді, магний гидроксиді тұнбалар қоспасынан магний гидроксидін еріту үшін аммоний хлоридімен өңдейді, қалған темір(ІІІ) гидроксиді Fe(OH)3, марганец оксиді MnO2 тұнбасының қоспасын темір(ІІІ) гидроксидін еріту үшін сұйылтылған азот қышқылымен өңдейді. Алынған ерітіндіден Fe3+ катионын сапалық реакциялары арқылы ашады. MnO2 тұнбасын концентрлі азот қышқылын және пероксид қосу арқылы ерітіндіге өткізеді. Түзілген ерітіндіден Mn2+ катионын сапалық реакцияларымен ашады (Mn2+ катионының MnO4-ке дейін тотығуы). V-ші аналитикалық топ катиондары қоспасын талдаудың қысқаша схемасы
VI-ші аналитикалық топ катиондары қоспасын талдау. І. Алғашқы байқау ü ерітінді түсі; ü тұнбаның бар-жоғы және оның түсі; ü ортаның рН (универсал индикаторымен анықталады). ІІ. Бөлшектік талдау Бұл топтың катиондары өзіне тән сапалық реакциялармен анықталады. Cu2+ катионын ашу концентрлі аммиак ерітіндісімен жүргізу қажет. Егер Cu2+ катионының түсі жеткілікті түрде анық болмаса, онда оны тексеру қажет. Бұл үшін 3-4 тамшы зерттелетін ерітіндіге 2 тамшы натрий гидроксиді ерітіндісін қосады. Түзілген тұнбаны 5 минут абайлап су моншасында қыздырады (Cu2+ катионы қатысында тұнбаның қарайғанын байқауға болады, CuO түзіледі). Содан кейін 6 тамшы аммиак хлоридінің ерітіндісін NH4Cl қосып, таяқшамен араластырып, центрифугалайды. Центрифугалау нәтижесінде тұнбаны ерітіндіден бөледі. Тұнбаны 3-4 тамшы азот қышқылымен жуып, түзілген ерітіндіге 8-10 тамшы концентрлі аммоний гидроксидін қосады. Cu2+ катионының қатысында ерітінді көк түске боялады. Hg2+ катионын ашу. Алтыншы аналитикалық топ катиондары бар жалпы ерітіндіден ашады. Hg2+ катионы KJ калий йодидімен немесе қалайы(II) хлоридінің SnCl2 бос металдың сынапқа дейін тотықсыздануымен және мыс пластинкасымен анықтайды. Cd2+ катионын ашу. Cd2+ катионын натрий тиосульфатымен ашуға болады. Co2+ катионын ашу. Co2+ катионын аммоний роданидімен NH4SCN ашады. Ni2+ катионын ашу үшін диметилглиоксиммен Чугаев реакциясын жүргізеді. ІІІ. Жүйелік талдау Сынауыққа 10-12 тамшы зерттелетін ерітінді, 20 тамшы 3н аммиак ерітіндісін қосады 2-3 минут қыздырады, центрифугалайды. Тұнбаға кобальттың негіздік тұзы CoOHCl мен меркураммоний хлориді [HgNH2]Cl түседі. Ерітінді - [Cu(NH3)4]Cl2, [Ni(NH3)6]Cl2, [Cd(NH3)4]Cl2. Кобальттың негіздік тұзы CoOHCl және меркураммоний хлоридіне [HgNH2]Cl 5-6 тамшы сұйылтылған күкірт қышқылын қосады, таяқшамен жақсылап араластырады, осы кезде CoOHCl ериді, ал [HgNH2]Cl тұнбада қалады. Тұнбаны центрифугалаумен бөледі. Ерітіндіден Co2+ катионын аммоний роданидімен ашады, ал тұнбаға бес тамшы азот қышқылын қосып ерітеді. Түзілген ерітіндіге 6-8 тамшы дистилденген су қосады, араластырады, түзілген ерітіндіден Hg2+ катионын сапалық реакцияларымен ашады. Cu2+ катионын ашу және бөлу. [Cu(NH3)4]Cl2, [Ni(NH3)6]Cl2, [Cd(NH3)4]Cl2 ерітіндісінен 10 тамшы алып үстінен күкірт қышқылын (таяқшамен араластыра отырып) тамшылатып, лакмус қағазы қышқылдық орта көрсеткенше қосады. Содан кейін 1-2 тамшы күкірт қышқылын және 2-3 түйір натрий тиосульфатының кристалдарын қосып, су моншасында 3-4 минут қыздырады. Cu2+ катионы тұнбаға сульфид CuS түрінде түседі, ал ерітіндіде Ni2+ және Cd2+ катиондары қалады. Тұнбаны центрифугамен бөледі де, мыс сульфидін тұнбаны 4-5 тамшы сұйытылған азот қышқылында ерітеді. Түзілген ерітіндідегі Cu2+ катионын сапалық раекцияларымен ашады. Cd2+ және Ni2+ катиондары бар ерітіндіні екіге бөліп, біріншісінен Cd2+ катионын, екіншісінен Ni2+ катионын сапалық реакцияларымен ашады. VІ-шы аналитикалық топ катиондары қоспасын талдаудың қысқаша схемасы
IV-VI аналитикалық топ катиондары қоспасын талдау. IV, V, VI-шы аналитикалық топ катиондары қоспасын талдау ІV-ші аналитикалық топ катиондары Al3+, Cr3+, Zn2+, Sn2+, Sn4+, As3+, As+5 V-ші аналитикалық топ катиондары: Mg2+, Mn2+, Bi3+, Fe2+, Fe3+, Sb3+, Sb+5 VI-шы аналитикалық топ катиондары: Cu2+, Co2+, Cd2+, Ni2+, Hg2+ Зерттелетін ерітіндіні жақсылап араластырып екіге бөледі. Бірінші бөлігінен IV-VI аналитикалық топ катиондарын ашады, ал екінші бөлігін талдауды қайталау қажет болған жағдайға қалдырады. І. Алғашқы байқау ü ерітінді түсі; ü тұнбаның бар-жоғы және оның түсі; ü ортаның рН (универсал индикаторымен анықталады). ІІ. Бөлшектік талдау Ерітінді түсіне көңіл аудару қажет. Егер ерітінді түссіз болса, онда зерттелетін ерітіндіде түсті иондардың Cu2+, Cr3+, Co2+, Ni2+ болмағаны, бірақ сұйылтылған ерітінділерде түсі байқалмайтын иондар Fe3+, Mn2+ немесе түссіз иондардың Hg2+, Cd2+ болуы мүмкін. Егер зерттелетін ерітіндінің түсі ақшыл-сары болса Fe3+; ақшыл-жасыл болса Fe2+, Ni2+; ақшыл-күлгін болса Mn2+; көк болса Cu2+; күлгін түсті болса Co2+ иондардың болуы мүмкін. Егер рН > 1 болса, онда зерттелетін ерітіндіде сурьма және висмут катиондары жоқ деуге болады. Fe2+ катионын ашу: Зерттелетін ерітіндінің 2-3 тамшысына сондай көлемде 2н HCl және 1 тамшы K3[Fe(CN)6] ерітіндісін қосқанда көк түсті “турнбул көгі” тұнбасының түзілуі, ерітіндіде Fe2+ ионының бар екенін көрсетеді. Fe3+ катионын ашу: Зерттелетін ерітіндінің 2-3 тамшысына сондай көлемде 2н HCl және 1-2 тамшы K4[Fe(CN)6] ерітіндісін қосқанда көк түсті “берлин көгі” тұнбасының түзілуі, ерітіндіде Fe3+ катионының бар екенін көрсетеді. ІІІ. Жүйелік талдау 1. ІV-ші аналитикалық топ катиондарын топ реагенті көмегімен бөлу. ІV - VІ аналитикалық топ катиондары қоспасына Н2О2 қатысында NaOH топ реагентін қосып қыздырғанда V, VI-шы аналитикалық топ катиондарының тұнбасы және IV-ші аналитикалық топ катиондарының ерітіндісі түзіледі. Тұнбада: V-ші топ гидроксидтері: Fe(OH)3, Mg(OH)2, SbO(OH)3, MnO(OH)2, Bi(OH)3 VI-шы топ гидроксидтері: Cu(OH)2, Co(OH)3, Ni(OH)2, HgO, Cd(OH)2 Ерітіндіде: IV-ші топ иондары: AlO2-, ZnO22-, SnO32-, CrO42-, AsO43- V, VI-шы аналитикалық топ катиондары тұнбаларын центрифуга көмегімен бөліп алады. IV-ші аналитикалық топ катиондарының амфотерлік қасиетін пайдаланып, тұз қышқылымен аниондарды катиондарға ауыстырады (CrO42- анионы қышқылдық ортада Cr2O72- анионына ауысады, AsO43- өзгерісіз қалады). Қалайы және алюминий иондарын тұнбаға түсіру. Қалайы және алюминий катиондарының гидролиздену қасиетін пайдаланып, оларды басқа катиондардан бөледі. Зерттелетін ерітіндінің бір бөлігіне (IV-ші аналитикалық топ катиондары) араластыра отырып, аммиак иісі білінгенше немесе дымқылданған лакмус қағазы көгергенше NH4OH ерітіндісін тамшылатып қосады, қыздырады. Алюминий және қалайы катиондары болса Al(OH)3, Sn(OH)4 гидроксидтерінің тұнбасы түзіледі. Центрифугамен тұнбаны ерітіндіден бөліп алады (ерітінді: [Zn(NH3)4]2+, CrO42-, AsO43-) Тұнбаны сумен жуып, содан кейін 2н HCl ерітіндісінде ерітеді, ерітіндіден алдымен Al3+ содан соң Sn4+ катиондарын ашады. Al3+ катионын ашу: Al3+ ализаринмен ашады. Sn4+ катионын ашу: Sn4+ катионын Sn2+ катионына ауыстыру үшін ерітіндіге темір ұнтағын салып 5 минут қайнатады. Қоспаны салқындатып, центрифугамен ерітіндіні бөліп алып, оған тамшылатып NaOH ерітіндісін рН > 10 болғанша қосады. Түзілген тұнбадан ерітіндіні центрифугамен бөліп, одан Sn2+ ионын Hg(II) немесе Bi(III) тұздарымен ашады. Ерітіндідегі CrO42-, AsO43-, [Zn(NH3)4]2+ иондарына қышқыл қосу арқылы комплексті бұзады, ерітіндіде Zn2+, Cr2O72-, AsO43- иондары болады. Ерітінді: Zn2+, CrO42-, AsO43- иондары қоспасына қаныққан Na2CO3 ерітіндісін (сілтілік орта болғанша) қосқанда, ақ түсті (ZnOH)2CO3 тұнбасының түзілуінен Zn2+ катионын анықтайды. (ZnOH)2CO3 тұнбасын тұз қышқылы ерітіндісінде ерітеді. Zn2+ катионын ашу: Zn2+ ионын дитизон немесе K4[Fe(CN)6] көмегімен ашады. As(V) катионын ашу: Ерітіндіден As(V) магнезиалды қоспамен немесе молибден сұйығымен ашады. Cr3+ катионын ашу: Центрифугат ерітіндісінің сарғыш түсі CrO42- ионының барын көрсетеді. Cr3+ катионының барын H2CrO6 қышқылына ауыстыру арқылы да білуге болады. V, VI-шы аналитикалық топ катиондары гидроксидтерін талдау Тұнба: V-ші аналитикалық топ катиондарының гидроксидтері: Fe(OH)3, Mg(OH)2, SbO(OH)3, Bi(OH)3, MnO(OH)2; VI-шы аналитикалық топ катиондарының гидроксидтері: Cu(OH)2, Ni(OH)2, Co(OH)2, HgO. Тұнбаны Н2О2 қатысында HNO3 қышқылымен өңдейді де, қыздырады. Тұнба ериді (Mn4+® Mn2+, Co3+® Co2+ өтеді), ерітінді көлемін екі есе су қосып көбейтеді, гидролиз нәтижесінде SbO(OH)3 тұнбаға түседі, ерітіндіде V, VI-шы аналитикалық топ катиондары болады. Ерітіндіде: V-ші топ катиондары: Fe3+, Mg2+, Mn2+, Bi3+; VI-шы топ катиондары: Cu2+, Cd2+, Co2+, Ni2+, Hg2+ түзіледі. Тұнбадан Sb+5 катионын анықтайды. Sb+5 катионын ашу: SbO(OH)3 тұнбасын HCl ерітіндісінде ерітіп, оған темір үгіндісін қосып қыздырады (Sb+5®Sb0) немесе қалайы фольгасында қара түсті металдық сурьмаға дейін тотықсыздандырады. Тұнбадан центрифугамен бөліп алынған V, VI-шы аналитикалық топ катиондары бар (Sb+5 басқа) ерітіндіге рН = 8-9 болғанша концентрлі NH4OH ерітіндісін қосады. Ерітіндіде: VI-шы аналитикалық топ катиондарының аммиакаттары: [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Hg(NH3)4]2+, [Co(NH3)6]2+, [Ni(NH3)6]2+. Тұнбада: V-ші аналитикалық топ катиондарының гидроксидтері: Fe(ОН)3, Mg(ОН)2, Mn(ОН)2, Bi(ОН)3. Тұнбаны центрифугамен бөліп алып талдайды. Тұнбаны талдау. Mg2+ катионын ашу: Тұнбаны бірнеше рет сумен жуады, оған 1 мл концентрлі NH4OH және NH4Cl ерітіндісін қосады. Магний ионы толық ерітіндіге өткенше тұнбаны осылай бірнеше рет өңдейді де, ерітіндіні тұнбадан бөліп алады. Ерітіндіге өткен магний катионын Na2HPO4 арқылы ашады. Mg2+ ионынан бөліп алынған тұнбаға сұйытылған HNO3 ерітіндісін қосып, Fe(III), Bi(III) гидроксидтерін ерітеді, ерітіндіден Fe3+, Bi3+ иондарын анықтайды. Fe3+ катионын ашу: Үш сынауыққа ерітіндіден 2-3 тамшы алып, біріншісіне KSCN, екіншісіне CH3COONa, үшіншісіне K4[Fe(CN)6] қосады, байқалған өзгерістер бойынша ® a) + KSCN ® Fe3+ ® б) + CH3COONa ® ® в) + K4[Fe(CN)6] ® Fe3+ катионының бар немесе жоқ екеніне қорытынды жасайды. Bi3+ катионын ашу: 2-3 тамшы ерітіндіге калий станиті ерітіндісін қосады, нәтижесінде металл висмуттың қара тұнбасы түзіледі: Bi3+ + K2SnO2 + KOH ® Mn2+ катионын ашу: Марганец(IV) гидроксиді тұнбасын концентрлі HNO3 ерітіндісін қосып ерітеді және Н2О2 ерітіндісін қосып, қайнатып Mn(ІІ)қосылысына ауыстырады және келесі тотығу реакцияларын орындайды:
VI-шы аналитикалық топ катиондарының комплексті қосылыстары ерітінділерін талдау. Ерітінді: [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Hg(NH3)4]2+, [Co(NH3)6]2+, [Ni(NH3)6]2+. Ерітіндіден комплекстерді күкірт қышқылы ерітіндісін қосып бұзады, қара-қоңыр тұнба түзілгенше Na2S2O3 ерітіндісін қосады. Тұнбада мыс және сынап сульфидтері, ал ерітіндіде кобальт, никель және кадмий иондары болады. CuS (Cu2S+S) тұнбасын азот қышқылында ерітеді, ерітіндіде Cu2+ иондары болады, ал тұнбаға HgS қалады. Ерітінді: Cu2+ катионын ашу а) + K4[Fe(CN)6] ® Cu2[Fe(CN)6]¯ қызыл-қоңыр б) + NH4OH ® [Cu(NH3)4]2+ көк түсті ерітінді |
|




 H2CrO6
(органикалық қабат көкке боялады)
2) AsO43- ионын анықтау:
а) + (NH4)2MoO4 + HNO3 → сары тұнба
б) + MgCl2 + NH4Cl + NH4ОН→ ақ тұнба
H2CrO6
(органикалық қабат көкке боялады)
2) AsO43- ионын анықтау:
а) + (NH4)2MoO4 + HNO3 → сары тұнба
б) + MgCl2 + NH4Cl + NH4ОН→ ақ тұнба


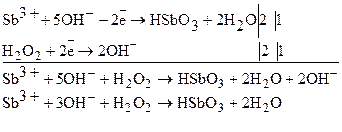
 ® a) + PbO2
® a) + PbO2  Mn2+ ® б) + KВiO3 + HNO3
Mn2+ ® б) + KВiO3 + HNO3