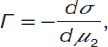|
|
Строение адсорбционного слоев и уравнение их состоянияРеферат по Коллоидной химии г. Казань 2016 Адсорбция (лат. ad — на, при, в; sorbeo — поглощаю) — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза — жидкость, конденсированная фаза — газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз[1]. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции — десорбция[2]. Основные понятия Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Если скорости адсорбции и десорбции равны, то говорят об установленииадсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и состав системы)[3]. Адсорбция и хемосорбция На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями (главным образом это Ван-дер-Ваальсовы силы), может идти химическая реакция. Этот процесс называется хемосорбцией. Чёткое разделение на адсорбцию и хемосорбцию не всегда возможно. Одним из основных параметров по которым различаются эти явления является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того в отличие от адсорбции хемосорбция обычно является необратимой и локализованной. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция.
Схожие явления В предыдущем разделе говорилось о случае протекания гетерогенной реакции на поверхности- хемосорбции. Однако бывают случаи гетерогенных реакций по всему объему, а не только на поверхности- это обычная гетерогенная реакция. Поглощение по всему объёму может проходить и под воздействием физических сил- этот случай называется абсорбцией.
Физическая адсорбция Причиной адсорбции являются неспецифические (то есть не зависящие от природы вещества) Ван-дер-Ваальсовы силы. Адсорбция, осложнённая химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией ихимической адсорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией. Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P:
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции (чаще применяют сокращённый термин — изотерма адсорбции) понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
Значение адсорбции Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты а также некоторые другие группы природных минералов и синтетических веществ. Адсорбция (особенно хемосорбция) имеет также важное значение в гетерогенном катализе. Пример адсорбционных установок приведён на странице азотные установки. Установка для проведения адсорбции называется адсорбером.
Природа адсорбционных сил Взаимодействие между молекулами адсорбтива с поверхностью адсорбента при т. н. физической адсорбции может быть обусловлена различными причинами. Тогда потенциал, который обусловливает взаимодействие одной молекулы адсорбента с одним атомом неполярного адсорбтива, можно выразить так: θ = − Сr 6 + Br12, где r – расстояние между центрами частиц; С – константа дисперсионного притяжения; В – константа, которая характеризует энергию сил отталкивания. Совершенно очевидно, что на сравнительно отдаленных расстояниях должны преобладать силы притяжения, а на расстояниях близких – силы отталкивания. Также на определенных расстояниях эти силы должны быть равными, что будет соответствовать минимуму свободной энергии. Но важно отметить, что при адсорбции дисперсионные силы действуют одновременно между каждой неполярной частицей. Поскольку энергия взаимодействия частиц может быстро убывать с расстоянием, то для определения потенциала адсорбционных сил достаточно провести суммирование на ближайших атомах адсорбента. Важным является то, что при адсорбции сложных неполярных молекул потенциальную энергию можно приближенно подсчитать как сумму всех потенциальных энергий адсорбции звеньев молекулы. Если же адсорбент состоит из ионов, то к действию уже известных дисперсионных сил может прибавляться действие индукционных сил притяжения диполей которые индуцированы в молекулах адсорбтива электрическим полем, которое, в свою очередь, создается ионами решетки адсорбента. При таком взаимодействии доля индукционных сил в адсорбционном взаимодействии может быть пропорциональна поляризуемости молекулы адсорбтива и квадрату напряженности поля на этой поверхности адсорбента.
Если же на полярном адсорбенте происходит адсорбция полярных молекул адсорбтива, то диполи в этом случае поляризуют атомы адсорбента, т. е. как бы индуцируют в них электрические моменты. Вследствие такого влияния индукционное взаимодействие добавляется к дисперсионному. Само индукционное взаимодействие обычно мало и в зависимости от диполя молекулы адсорбтива и поляризуемости адсорбента может достигать больших значений. В случае, если молекулы адсорбируются на адсорбенте, который имеет на поверхности ионы или диполи, возникает т. н. взаимодействие ионов или диполей адсорбтива с электростатическим полем самого адсорбента. При этом молекулы адсорбтива могут даже ориентироваться в поле адсорбента, при этом происходит ориентационное кулоновское взаимодействие. Обычно бывает, что энергии индукционного и ориентационного взаимодействия меньше энергии дисперсионного взаимодействия, и поэтому принимается, что энергия межмолекулярного притяжения определяется энергией дисперсионного притяжения. Также причиной адсорбции может служить образование водородной связи. Связь такого типа может возникать при адсорбции на адсорбентах, которые содержат на поверхности гидроксильные группы таких молекул, как молекулы воды, спиртов, аммиака и аминов. При образовании водородной связи энергия взаимодействия адсорбтива с адсорбентом может быть довольно большой, и теплота, которая выделяется при такой адсорбции, значительно больше теплоты адсорбции веществ, которые сходны по форме и размеру молекул, но не образуют водородной связи. Важно отметить, что, зная термодинамическое описание поверхностного слоя на границе «адсорбент – адсорбтив», его строение, природу различных видов сил, динамику процесса, можно переходить к изучению более сложных процессов адсорбции.
Уравнение адсорбции Гиббса Для изучения явления адсорбции на границе «раствор – газ» нужно установить связь между избытком адсорбированного вещества в слое на поверхности (Г), концентрацией ПАВ в растворе (с) и поверхностным натяжением (σ) на границе раздела фаз «раствор – газ». Целесообразнее рассматривать явления с термодинамических позиций и связывать адсорбцию растворенного вещества с изменением свободной энергии поверхности или ее поверхностного натяжения. Эту связь вывел В. Гиббс в 1876 г, которая получила название «уравнение адсорбции Гиббса»: Г = – с / RT x dσ / dc. Еще можно представить уравнение Гиббса, основанное на термодинамике, с использованием изобарно-изотермического потенциала G, химических потенциалов μ1 иμ2, а также с использованием n1 и n2 числом молей компонентов. Проанализировав его с учетом энтропии S, объема V и давления P, можно записать следующее уравнение: dG = – SdT + VdP + σds + μ1d n1+μ2dn2. Приравняем его к нулю, и с учетом постоянной температуры и давления оно упрощается в уравнение вида: sdσ + n1dμ1 + n2dμ1 = 0. С учетом того, что для разбавленных растворов химический потенциал второго компонента выражается так: μ2 = μ20 + RT lnc, а с учетом того, что температура постоянна dμ2 = RTdnc, подставляя это уравнение в
получаем искомое уравнение адсорбции Гиббса. Исходя из уравнения, можно заметить, что если поверхностное натяжение σ увеличивается с концентрацией с, то концентрация растворенного вещества на поверхностном слое меньше, чем в объеме раствора (т. н. отрицательная адсорбция), и если поверхностное натяжение σуменьшается с увеличением концентрации с, тогда концентрация в слое больше, чем в объеме (оположительная адсорбция), и, наконец, если σ не зависит от с, то концентрация вещества в слое на поверхности и в объеме одинакова. Уравнение Гиббса было выведено с использованием термодинамики. Практически проверить это уравнение сложно, что связано со сложностью определения концентрации растворенного вещества в слоена поверхности. Опытным путем Б. Мак-Бен установил, что с поверхности раствора с помощью прибора срезался очень тонкий слой жидкости. Дальнейшее определение всех параметров уравнения Гиббса показало, что экспериментально найденные значения адсорбции в пределах ошибки опыта совпадали со значениями, которые вычисляли по уравнению Гиббса. Из-за однородности и гладкости поверхности всякой жидкости при изучении адсорбции на ее поверхности совершенно неприложимы обычные представления об активных центрах. При критической температуре исчезает различие между граничащими фазами, поверхностное натяжение, как правило, становится равным нулю. Адсорбция газов и паров имеет настолько большое практическое применение, что в литературе, особенно в технической, можно встретить это понятие, которое применяют только по отношению к процессам на поверхности твердых тел. Это понятие, как и наиболее общие закономерности адсорбции, как рассмотренное уравнение Гиббса, применимо ко всем границам раздела фаз. Пользуясь уравнением Гиббса и всеми вытекающими из него положениями, определив величину Г, можно построить изотерму адсорбции.
Строение адсорбционного слоев и уравнение их состояния В случае если небольшое количество дифильного ПАВ нанести на неограниченно большую поверхности воды, то происходит его растекание и образуется тончайший мономолекулярный слой. Такая пленка на поверхности воды может находится в трех состояниях: газообразном, жидком и твердом. Состояние пленки определяется силами, действующими между молекулами. В случае если силы, действующие между молекулами в пленке, сравнительно невелики, то молекулы ПАВ при достаточно большой предоставленной им поверхности воды стремятся рассеятся по ней и удалится друг от друга на достаточно большое расстояние. В результате теплового движения молекулы всœе время перемещаются по поверхности воды не зависимо друг от друга, что обуславливает поверхностное давление, действующее в направлении, противоположном поверхностному натяжению. Такую пленку считают двухмерным газом, поскольку молекулы этого газа не могут оторваться от воды и вынуждены двигаться только в двух измерениях. Полярная группа дифильного поверхностно-активного вещества благодаря гидрофильности будет погружена в воду, а углеводородный радикал будет лежать “плашмя” на воде. так как между радикалом и молекулами воды существуют силы притяжения. (жирные кислоты с числом С от 12 до 20, спирты). Существенно, что как и для трехмерного газа, в этом случае может быть применено уравнение состояния одного и того же вида. В случае если содержание ПАВ в системе мало, то можно написать: s 0 - s = D = kc. Дифференцируя это уравнение находим: ds = d D = kdc Подставляя полученное выражение в уравнение Гиббса, получим: Г = - с/RT· ds /d c = - c d D /RT d c = - c kdc /RTdc = D/RT Обозначим площадью занимаемую одним молем двумерного газа через s, тогда Г = 1/s . Получаем после подстановки: 1/s = D/RT, Ds = RT Вид последнего уравнения аналогичен виду уравнения Менделœеева - Клапейрона, отнесенному к одному молю газа pV = RT Разница заключается только в том, что в уравнении Менделœева- Клапейрона стоит объем -V и давление, а в нашем случае роль объема играет площадь, поскольку газ двухмерный, а роль давления - D - уменьшение поверхностного натяжения в результате действия поверхностного давления, ᴛ.ᴇ. величина, равная давлению двумерного газа. Состояние трехмерного газа в соответствующих условиях описывается известным уравнением Ван-дер-Ваальса: (р + а)/V2 (V - b) = RT. Для двухмерного газа, как показал А.Н. Фрумкин, крайне важно применять аналогичное уравнение: (D + a/s2) (s - b) = RT В уравнении константы a и b отвечают постоянным а и b в уравнении Ван-дер-Ваальса. В случае если тангенциально действующие силы между углеводородными радикалами молекул ПАВ в поверхностной пленке велики, то молекулы слипаются и образуют крупные конденсированные острова, в которых тепловое движение молекул сильно затруднено. В таких островах молекулы обычно ориентируются параллельно друг другу и перпендикулярно поверхности воды, образуя своеобразный частокол. Отдельные молекулы могут, конечно, отрываться от частокола и располагаться на поверхности в виде разряженной газообразной пленки. Такое явление аналогично испарению жидкости или сублимации твердого тела. Веществами, образующими на поверхности подобные пленки являются дифильные молекулы с большими углеводородными радикалами. При изменении условий, к примеру, при повышении температуры, конденсированные пленки могут переходить в газообразные. Конденсированные пленки обычно жидкие и молекулы в них перемещаются довольно свободно, но если действующие между радикалами молекул силы настолько велики, что молекулы не могут перемещаться, то конденсированные пленки можно рассматривать как твердые. Это имеет место при относительно очень длинных углеводородных радикалах дифильных молекул, содержащих больше 20 -24 атомов углерода. О наличии у конденсированных пленок свойств твердого тела можно убедиться, нанося на них легкий порошок. В случае если пленка твердая, то при осторожном сдувании порошок остается неподвижным. В случае если пленка жидкая, порошок передвигается по поверхности. Или можно в жидкость наполовину погружают маленький стеклянный диск, подвешенный на кварцевой нити к горизонтально вращающейся головке. В случае если пленка твердая, то при вращении головки образуется некоторый угол закручивания, прежде чем диск, разорвав пленку, последует за головкой. В случае если же пленка жидкая, диск следует за головкой без образования угла закручивания. Помимо описанных пленок существуют еще растянутые пленки, промежуточные по свойствам между газообразными и конденсированными. Такие пленки образуются, к примеру, из конденсированных пленок при повышении температуры, вследствие увеличения кинœетической энергии углеводородных радикалов. Размещено в открытой библиотеке http://oplib.ru Предполагают, что растянутых пленках углеводородные цепи переплетаются, что не дает пленке растекаться. Адсорбция из растворов При адсорбции из растворов жидкая фаза состоит не из чистых жидкостей, а из нескольких компонентов. Размещено в открытой библиотеке http://oplib.ru Этот вид адсорбции особенно важен в связи с проблемой очистки жидкостей от примесей (очистка сточных вод, регенерация природных вод и промышленных сбросов). Явление адсорбции из растворов классифицируют прежде всœего по адсорбату. Так различают адсорбцию нейтральных молекул, ионов, коллоидных частиц и высокомолекулярных веществ. Адсорбция неэлектролитов При адсорбции из раствора приходится учитывать взаимодействия между компонентами в растворе, что усложняет задачу. Кроме того имеет место конкуренция за право адсорбироваться между растворителœем и растворенными веществами. По этой причине поверхностные избытки компонентов оказываются разными по знакам. В случае если большинство мест занято молекулами растворенного вещества, то происходит вытеснение растворителя из поверхностного слоя (x 2 > 0, х1<0). Избытки можно определить экспериментально по изменению концентрации компонентов в растворе (анализ состава жидкой фазы до и после адсорбции). Избыток выражают через моляльные объемные концентрации (до сi0 , после сi)^ х2 = (с20 - с2)V/m, где V - общий объем раствора, m - масса адсорбента. Материал размещен на oplib.ru Остановимся на двух закономерностях, имеющих общий характер.Практика показывает, что для начальных участков изотермы адсорбции допустимо использование уравнения Ленгмюра. Во многих случаях при этом К увеличивается в 3 -3,5 раза при удлинœении цепи на одно звено. Адсорбционная способность возрастает в гомологическом ряду и конкурентная адсорбция идет в пользу адсорбента с большой молекулярной массой. Так во многих ферментативных процессах при расщеплении, к примеру, белков пепсином продукты распада оказываются менее поверхностно активными, чем исходные вещества и уступают место в поверхностном слое всœе новым и новым макромолекулам субстрата на поверхности фермента. Материал размещен на oplib.ru Для высокодисперсных тонкопористых сорбентов наблюдается обращение правила Траубе-Дюкло - уменьшение адсорбции с ростом длины молекулы адсорбата выше определœенного критического значения. Вторая закономерность, связанная с полярностью, определяет структуру поверхностного слоя, а также условия выбора того или иного адсорбента в конкретных случаях и имеет в связи с этим большое значение для практики. Она формулируется обычно как правило уравнивания полярностей Ребиндера, гласящее, что процесс адсорбции идет в сторону выравнивания полярностей фаз и тем сильнее, чем больше первоначальная разность полярностей. Действительно, если дисперсная фаза и дисперсионная среда резко отличаются по своей полярности, взаимодействие между ними будет незначительным, что создает благоприятные условия для адсорбции именно растворенного вещества. Чем больше свободная энергия (пропорциональная разности полярностей) на межфазной границе, тем больше возможность снижения ее за счет адсорбции растворенного вещества, обладающего обычно промежуточной полярностью. Необходимо, т.о, создать условия для проявления поверхностной активности, а следовательно преимущественной адсорбции второго компонента. Материал размещен на oplib.ru К примеру для адсорбции бензойной кислоты из водного раствора следует брать неполярный адсорбент - уголь, для адсорбции из растворов в бензоле - полярный адсорбент - силикагель. Тенденция системы к уменьшению s (обусловленной разностью полярностей двух фаз), определяет ориентацию молекул растворенного вещества (ПАВ) в поверхностном слое. Так в первом случае молекула кислоты ориентируется полярной группой к воде, (рис.) и неполярная поверхность твердой фазы, в результате адсорбции становится более полярной. Разность полярностей уменьшается в самопроизвольном процессе адсорбции и ориентации. Точно так же во втором случае разность полярностей фаз уменьшается вследствие обратной ориентации молекул ПАВ, обращенных полярными группами к полярному адсорбенту. Показанные картинки являются простейшими схемами, поясняющими сущность адсорбции из раствора с помощью простейшей модели монослоя. Применительно к молекулярной адсорбции из бинарного раствора фундаментальное адсорбционное уравнение Гиббса принимает вид: ds = - Г1dm1 + Г2dm2 где Г1 и Г2 - величина Гиббсовой адсорбции компонентов 1-растворитель, 2 - растворенное вещество. По уравнению Гиббса-Дюгема: x1dm1 + x2dm2 = 0 где х1 и х2 - молярные доли компонентов в растворе. Отсюда dm2 = - x1dm1/x2, тогда --ds =(Г2 - Г1x2/ x1) dm2 Для получения зависимости Г2 от x2 допустим, что общее число молей компонентов в поверхностном слое до и после адсорбции остается одним и тем же. Тогда при адсорбции добавление одного компонента в поверхностном слое будет равно убыли другого компонента : Г2= -Г1 . Подставляя это значение в уравнение и учитывая, что x1 + x2 = 1, получим: Г2 = - (1 - x2)ds/ dm2 Выразив химический потенциал через активности компонентов: Г2 = - (1 - x2)(а2/RT)ds/ da2 Когда концентрация второго компонента стремится к нулю, то это уравнение переходит в уравнение Гиббса для разбавленных растворов. Размещено в открытой библиотеке http://oplib.ru Это же уравнение является более общим. Но предварительно нужно определить межфазное натяжение и активности компонентов в растворе. Типичные зависимости представлены на рис. Молекулярная адсорбция из растворов имеет большое значение для очистки жидкостей, извлечения ценных примесей, оценки удельной поверхности, для разделœения и анализа многокомпонентных систем. Адсорбция электролитов Ионы в растворе являются носителями электрического заряда. Οʜᴎ адсорбируются только на поверхностях, состоящих из полярных молекул или ионов. Размещено в открытой библиотеке http://oplib.ru По этой причине адсорбция ионов сопровождается перераспределœением зарядов, возникновением электрического поля в области поверхностного слоя. К примеру, переход катионов из объемной жидкой фазы на границу с твердой приводит к тому, что последняя заряжается положительно, жидкая - отрицательно, так как ионы, несущие противоположный заряд, непосредственно не адсорбируются, но под действием сил электоростатического притяжения остаются вблизи адсорбированных ионов. Размещено в открытой библиотеке http://oplib.ru В поверхностном слое возникает двойной электрический слой зарядов (ДЭС), подобный конденсатору с двумя заряженными обкладками. При этом ДЭС возникает при любом направленном переходе ионов одного знака. На способность ионов одинаковой валентности адсорбироваться сильно влияет их радиус. Большую адсорбционную способность проявляют ионы, радиус которых больше. С одной стороны это происходит из-за большей поляризуемости таких ионов. С другой - из-за их меньшей гидратации, поскольку наличие гидратной оболочки уменьшает электростатическое взаимодействие (рис. Воюцкий). Ряды ионов, составленные в порядке уменьшения их способности связывать среду, называются лиотропными или рядами Гофмейстера. Адсорбционная способность ионов весьма сильно зависит от их валентности. Чем больше валентность иона, тем сильнее он притягивается различными участками поверхности. Особый интерес для коллоидной химии представляет адсорбция ионов на поверхности кристалла, в состав которого входят ионы той же природы. При этом адсорбцию можно рассматривать как кристаллизацию, ᴛ.ᴇ. как достройку кристаллической решетки. К примеру кристаллы AgI, внесенные в раствор КI, адсорбируют на поверхности иодид-ионы. В случае если же кристалл AgI внести в раствор AgNO3, то происходит адсорбция ионов серебра. Понятно, что силы, под влиянием которых происходит такая достройка, являются химическими и одновременно электростатическими силами и ионы, достраивающие кристалл, адсорбируются при этом особенно прочно. (рис.). Достраивать решетку могут не только ионы, входящие в состав решетки, но и изоаморфные им. Достраивать так же могут атомные группы, близкие к атомным группам, находящимся на поверхности. Так уголь прочно удерживает органические радикалы, а окиси и гидраты окисей алюминия и желœеза прочно связывают группы, содержащие кислород. Обменная адсорбция(о.а). При адсорбции из жидких растворов поверхность адсорбента всœегда полностью занята молекулами растворителя. Растворенное вещество может адсорбироваться только вытесняя молекулы растворителя с поверхности. Т.е. происходит обменная молекулярная адсорбция. В случае если на поверхности адсорбента уже адсорбирован электролит, то при контакте этого адсорбента с другим электролитом почти всœегда в той или иной степени также наблюдается обменная адсорбция, или правильнее обмен ионов между двойным электрическим слоем адсорбента и средой. Адсорбент, поглощая определœенное количество каких-либо ионов, одновременно выделяет в раствор эквивалентное количество других ионов того же знака. О.А всœегда обратима. Она протекает более медленно чем молекулярная адсорбция. При этом может изменятся рН среды. (схема).О.А специфична, ᴛ.ᴇ. к обмену способны только определœенные ионы. В общем случае можно сказать, что вещества, способные к ионному обмену, называются ионитами. Иониты имеют структуру в виде каркаса, сшитого обычно ковалентными связями. Каркас имеет положительный или отрицательный заряд и выступает в роли полииона. Заряд полииона компенсируется противоположным зарядом подвижных ионов, находящихся в адсорбционном или диффузном слое. Противоионы могут заменяться га другие ионы с зарядом того же знака. Иониты классифицируют по происхождению: природные и синтетические, по составу: неорганические и органические, по знаку заряда обменивающихся ионов: катиониты, аниониты и амфолитыК природным неорганическим ионитам относят силикаты типа цеолитов. Размещено в открытой библиотеке http://oplib.ru Природными ионитами органического происхождения являются находящиеся в почве гуминовые кислоты. Природные иониты не нашли достаточного применения из-за механической и химической нестойкости. Широкое применение получили синтетические иониты на основе смол - ионообменные смолы. Это полиэлектролиты с ограниченной способностью к набуханию. Обменная адсорбция имеет большое значение в земледелии, биологии и технике. Почва способна поглощать и удерживать определœенные ионы, взамен этих она выделяет Ca, Mg и другие. (Алюмосиликатный поглотитель, названный им пермутитом Na2O.3SiO2.2H2O) - схема. Пермутит, обменявший Na и Ca, в согласии с законом действия масс, можно снова регенерировать путем обработки концентрированным раствором поваренной соли. Обменная адсорбция используется так же для улавливания ценных веществ из разбавленных растворов, из которых выделять их не рентабельною. (Точное установление эквивалентной точки при титровании). Явление адсорбции из раствора широко используется для разделœения многокомпонентных систем. Этот метод анализа и разделœения, называемый хроматографией, был разработан русским ученым Цветом в начале ХХ века. Пропуская раствор хлорофила через колонку с адсорбентом (окисью алюминия), Цвет установил, что различные компоненты сложного раствора адсорбируются на различных уровнях высоты колонки. После нескольких циклов промывания в колонке обнаруживаются резко очерченные зоны, расположенные одна над другой. Очевидно, что верхняя зона будет занята компонентом, обладающим наибольшей адсорбционной способностью, а последующие располагаются в порядке убывания адсорбционной способности. Разрезая колонку по зонам можно разделить компоненты. Принципы, разработанные Цветом в настоящее время широко используются для хроматографического разделœения и анализа веществ. Методы хроматографии различают по агрегатному состоянию подвижной и неподвижной фаз, в зависимости от механизма процесса сорбции, по способам оформления метода, в зависимости от способа передвижения компонентов смеси. Классификация и общая характеристика ПАВ: Анионные ПАВ диссоциируют в воде с образованием поверхностноактивного аниона. К ним относят: · карбоновые кислоты и их соли (мыла) общей формулы RCOOM (где М - металл), к примеру пальмитат натрия С15Н31СООNa, стеарат натрия С17Н35СООNa, олеат натрия С17Н33СООNa · алкилсульфокислоты ROSO2OM и алкиларилсульфокислоты RArSO2OM · вещества, содержащие другие типы поверхностно-активных анионов, напримет фосфаты, тиосульфаты. Катионные ПАВ диссоциируют в воде с образованием поверхностно-активного катиона. К ним относят: · соли первичных, вторичных и третичных алифатических и ароматических аминов · соли алкилзамещенных аммониевых оснований Катионные ПАВ наиболее токсичные и наименее биологически разлагаемые из всœех ПАВ. Их часто используют в качестве бактерицидных, фунгицидных, дезинфицирующих веществ и ингибиторов коррозии. Амфолитные ПАВ не диссоциируют в растворах на ионы. Как правило, неионногенные ПАВ являются смесью гомологов с различной длиной полиоксиэтиленовой цепи. Их получают реакцией присоединœения этиленоксида к спиртам, карбоновым кислотам, аминам, алкилфенолам и др. К примеру оксиэтилированные алкилспирты получают: ROH + nH2C¾CH2 ® RO(OCH2CH2)nHО В молекулах неионногенных ПАВ углеводородный радикал может содержать от 6 до 18 углеродных атомов, а n можеьт изменятся от нескольких единиц до ста. Материал размещен на oplib.ru Полиоксиэтиленовая цепь определяет гидрофильные свойства неионногенных ПАВ. Изменяя длины полиоксиэтиленовой и углеводородной цеей можгно регулировать коллоидно-химические свойства ПАВ. (Моющее средство ОП - полиоксиэтиленовые эфиры алкилфенолов) Все ПАВ делят на истинно растворимые в воде и коллоидные. Истинно растворимые (с небольшими углеводородными радикалами) применяются в качестве смачивателœей, вспенивателœей,гидрофобизаторов при флотации, диспергаторов и т.д. Главной особенностью коллоидных ПАВ является их способность образовывать т.д. устойчивые гетерогенные дисперсные системы. Отличаются высокой поверхностной активностью, способность к самопроизвольному образованию лиофильных коллоидных систем, высокая способность стабилизировать дисперсные системы. Кроме высокой поверхностной активности - еще одна количественная характеристика этих веществ - гидрофильно-липофильный баланс (ГЛБ). Это соотношение между гидрофильными свойствами полярной группы и липофильными (липос-жир) свойствами углеводородного радикала, характеризуется числом ГЛБ Число ГЛБ определяют путем сравнения способности различных ПАВ к мицеллообразованию. Методы получения коллоидных систем Сведберг всœе методы получения коллоидных систем делит на конденсационные и диспергационные. Особо от этих методов стоит метод пептизации, который состоит в переводе в коллоидный раствор осадков, частицы которых уже имеют коллоидные размеры. Иногда коллоидные системы могут образовываться путем самопроизвольного диспергирования дисперсной фазы в дисперсионной среде. Основными двумя условиями является нерастворимость или малая растворимость дисперсной фазы в дисперсионной среде и наличие в системе частиц, способных стабилизировать систему. Конденсационный метод. Обычно считается, что образование коллоидных систем в результате конденсации является не чем иным, как процессом кристаллизации. Образование кристаллов идет в две стадии: 1. возникновение зародышей (центров кристаллизации) в пересыщенном растворе, что может быть вызвано химической реакцией, приводящей к получению малорастворимого соединœения, уменьшения растворимости соединœения при замене хорошего растворителя худшим, охлаждением раствора и др. причинами. 2. рост зародышей, что приводит к образованию достаточно крупных кристаллов. Размещено в открытой библиотеке http://oplib.ru Теория зарождения новой дисперсной фазы зародилась в исследованиях Гиббса (1898) по термодинамике поверхностных явлений в двадцатых годах нашего столетия она получила развитие в экспериментальных и теоретических исследованиях конденсации пересыщенного пара школы Фольмера. Экспериментально установили, что зародыши кристаллизации образуются, как правило, в результате осаждения растворенного вещества на чужеродных мельчайших пылинках, случайно оказавшихся в системе, т. е. на уже готовых поверхностях раздела (стенках сосуда, частицах посторонних веществ). Чтобы сконденсированное вещество не возвращалось обратно в фазу раствора, он (раствор) должен быть пересыщен. К примеру в насыщенном паре в результате флуктуаций образуются мельчайшие капельки, но они тут же испаряются, так как давление пара над ними больше, чем давление насыщенного пара. Чтобы происходила конденсация пара крайне важно, чтобы он был пересыщен. |
|