|
|
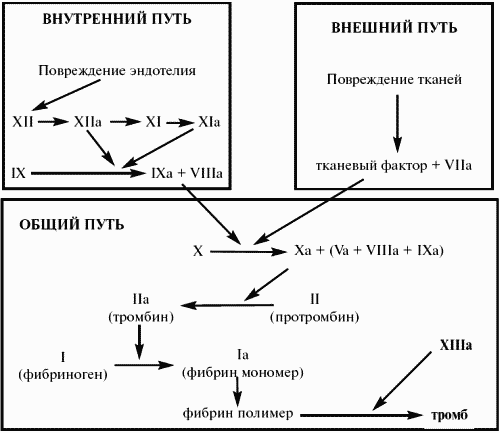
Внешний и внутренний пути свертывания крови.Во внешнем пути свертывания крови участвуют тромбопластин (тканевой фактор, фактор III), проконвертин (фактор VII), фактор Стюарта (фактор X), проакцелерин (фактор V), а также Са2+ и фосфолипиды мембранных поверхностей, на которых образуется тромб (рис. 32). Гомогенаты многих тканей ускоряют свёртывание крови: это действие называют тромбопластиновой активностью. Вероятно, она связана с наличием в тканях какого-то специального белка. Факторы VII и X - проферменты. Они активируются путём частичного протеолиза, превращаясь в протеолитические ферменты - факторы VIIа и Xа соответственно. Фактор V – это белок, который при действии тромбина превращается в фактор V', который не является ферментом, но активирует фермент Xа по аллостерическому механизму; активация усиливается в присутствии фосфолипидов и Са2+.
Рис. 32. Схема свертывания крови
В плазме крови постоянно содержатся следовые количества фактора VIIа. При повреждении тканей и стенок сосуда освобождается фактор III – мощный активатор фактора VIIа; активность последнего увеличивается более чем в 15000 раз. Фактор VIIа отщепляет часть пептидной цепи фактора X, превращая его в фермент - фактор Xа. Сходным образом Xа активирует протромбин; образовавшийся тромбин катализирует превращение фибриногена в фибрин, а также превращение предшественника трансглутаминазы в активный фермент (фактор XIIIа). Под влиянием тромбина от фибриногена отщепляются 2 пептида А и 2 пептида В. Фибриноген превращается в хорошо растворимый фибрин-мономер, который быстро полимеризуется в нерастворимый фибрин-полимер при участии фибринстабилизирующего фактора XIII (трансглутаминаза) в присутствии ионов Са2+ (рис. 33). Этот каскад реакций имеет положительные обратные связи, усиливающие конечный результат. Фактор Xа и тромбин катализируют превращение неактивного фактора VII в фермент VIIа; тромбин превращает фактор V в фактор V', который вместе с фосфолипидами и Са2+ в 104–105 раз повышает активность фактора Xа. Благодаря положительным обратным связям скорость образования самого тромбина и, следовательно, превращения фибриногена в фибрин нарастают лавинообразно, и в течение 10-12 с кровь свертывается. Фибриновый тромб прикрепляется к матриксу в области повреждения сосуда при участии белка фибронектина. Вслед за образованием нитей фибрина происходит их сокращение, для чего необходима энергия АТФ и фактор 8 тромбоцитов (тромбостенин).
Свертывание крови по внутреннему механизму происходит значительно медленнее и требует 10-15 мин. Этот механизм называют внутренним, потому что для него не требуется тромбопластин (тканевой фактор) и все необходимые факторы содержатся в крови (рис. 32). Внутренний механизм свёртывания также представляет собой каскад последовательных активаций проферментов. Начиная со стадии превращения фактора X в Xа, внешний и внутренний пути одинаковы. Как и внешний путь, внутренний путь свертывания имеет положительные обратные связи: тромбин катализирует превращение предшественников V и VIII в активаторы V' и VIII', которые в конечном итоге увеличивают скорость образования самого тромбина. Внешний и внутренний механизмы свертывания крови взаимодействуют между собой. Фактор VII, специфичный для внешнего пути свёртывания, может быть активирован фактором XIIа, который участвует во внутреннем пути свертывания. Это превращает оба пути в единую систему свёртывания крови. Кровотечение из капилляров и мелких сосудов останавливается уже при образовании тромбоцитной пробки. Для остановки кровотечения из более крупных сосудов необходимо быстрое образование прочного тромба, чтобы свести к минимуму потерю крови. Это достигается каскадом ферментных реакций с механизмами усиления на многих ступенях. Различают три механизма активации ферментов каскада: 1. Частичный протеолиз. 2. Взаимодействие с белками-активаторами. 3. Взаимодействие с клеточными мембранами. Ферменты прокоагулянтного пути (факторы II, VII, IX и X) содержат
Реакции, в которых участвуют факторы II, VII, IX и X, активируются ионами Са2+ и фосфолипидами: радикалы γ-карбоксиглутаминовой кислоты образуют центры связывания Са2+ на этих белках. Перечисленные факторы, а также факторы V' и VIII' прикрепляютя к бислойным фосфолипидным мембранам и друг к другу при участии ионов Са2+, и в таких комплексах происходит активация факторов II, VII, IX и X. Ион Са2+ активирует также и некоторые другие реакции свёртывания: декальцинированная кровь не свертывается. В отсутствие витамина К образуются факторы II, VII, IX, и X, не содержащие γ-карбоксиглутаминовых остатков. Такие проферменты не могут превращаться в активные ферменты. Недостаточность витамина К проявляется повышенной кровоточивостью, подкожными и внутренними кровоизлияниями. У людей с наследственными дефектами трансглутаминазы кровь свертывается так же, как у здоровых, однако тромб получается хрупкий, поэтому легко возникают вторичные кровотечения. При повышенной свертываемости крови могут образоваться внутрисосудистые тромбы, закупоривающие неповрежденные сосуды (тромботические состояния, тромбофилии). Наследственные дефекты белков, участвующих в свёртывании крови, проявляются повышением кровоточивости. Гемофилии – заболевания из группы наследственных коагулопатий, обусловленные дефицитом факторов свертывания плазмы крови и характеризующиеся повышенной склонностью к геморрагиям. Гемофилия А вызвана отсутствием фактора VIII. Она составляет подавляющее большинство (около 85%) случаев синдрома. Ген фактора VIII локализован в X- хромосоме; повреждение этого гена проявляется как рецессивный признак, поэтому заболевание наследуется по рецессивному признаку по женской линии. У мужчин, имеющих одну X-хромосому, наследование дефектного гена приводит к гемофилии. Признаки болезни обычно обнаруживаются в раннем возрасте: малейшие повреждения приводят к кровотечениям. Наблюдаются также спонтанные носовые кровотечения, внутрисуставные кровоизлияния. Ввиду постоянных и длительных кровотечений у детей с гемофилией наблюдается анемия различной степени выраженности. Гемофилия В. Гемофилия В обусловлена мутациями гена фактора IX, который, как и ген фактора VIII, локализован в половой хромосоме. Мутации рецессивны, следовательно, гемофилией В болеют в основном мужчины. Данный вид гемофилии составляет около 13% случаев заболевания. Основной метод лечения - заместительная терапия. Для остановки кровотечения при гемофилии А вводят свежую донорскую кровь, содержащую фактор VIII, или препараты фактора VIII, при гемофилии В - препараты фактора IX. Фибринолиз. В течение нескольких дней после образования тромба происходит его рассасывание. В этом процессе принимает участие ферментная система, расщепляющая фибриновый сгусток на мелкие растворимые фрагменты. Основным компонентом этой системы является протеолитический фермент плазмин. Плазмин гидролизирует в фибрине пептидные связи, образованные остатками аргинина и триптофана, в результате чего образуются растворимые пептиды. В циркулирующей крови плазмин находится в виде предщественника – плазминогена. Пламиноген может активироваться комплексом фактора XIIа с калликреином, имеющимся в тромбе, а также белковым активатором тканевого типа, синтезируемым в эндотелии сосудов, и ферментом урокиназой, образующейся в юкстогломерулярном комплексе почек. Плазмин может активироваться и в циркулирующей крови без повреждения сосудов. Там плазмин быстро инактивируется белковым ингибитором α2- антиплазмином, в то время как внутри тромба он защищён от действия ингибитора. Урокиназа находит применение для растворения тромбов или предупреждения их образования при тромбофлебитах, тромбоэмболии легочных сосудов, инфаркте миокарда, хирургических вмешательствах. Известны две молекулярные формы этого активатора. Противосвертывающая системапредставлена набором белков плазмы, ингибирующих протеолитические ферменты. Ее основная функция - сохранять кровь в жидком состоянии в неповреждённых сосудах и ограничивать процесс тромбообразования. Белок плазмы антитромбин III создает 75% всей антикоагулянтной активности плазмы крови. Он ингибирует все протеиназы, участвующие в свёртывании крови, кроме фактора VIIа. Антитромбин III не действует на факторы, находящиеся в составе комплексов с фосфолипидами, а только на те, которые находятся в плазме в растворенном состоянии. Таким образом, он устраняет ферменты, попадающие в кровоток из места образования тромба, и предотвращает распространение свертывания крови на неповрежденные участки кровеносного русла. Известен генетический дефект, при котором концентрация антитромбина III в крови вдвое меньше, чем в норме; у таких людей часто наблюдаются тромбозы. Гепарин – сульфатированный полисахарид, усиливающий ингибирующее действие антитромбина III: он индуцирует конформационные измененияв молекуле антитромбина III, которые повышают сродство ингибитора к тромбину и другим факторам. После соединения этого комплекса с тромбином гепарин освобождается и может присоединяться к другим молекулам антитромбина III. Таким образом, действие гепарина сходно с действием катализаторов. Гепарин применяют как антикоагулянт при лечении тромботических состояний. В плазме крови есть и другие белки – ингибиторы протеиназ, которые также могут уменьшать вероятность внутрисосудистого свёртывания крови. Таким белком является α2- макроглобулин, который ингибирует многие протеиназы, и не только те, которые участвуют в свертывании крови. Контрольные вопросы 1. Перечислите функции белков плазмы крови. 2. Как может измениться уровень альбуминов плазмы при поражении печени? Почему? 3. По какому принципу классифицируют ферменты плазмы крови? Какие из них имеют важное диагностическое значение? 4. Рассмотрите механизм транспорта кислорода и углекислого газа кровью. 5. Назовите важнейшие буферные системы крови. 6. Какие заболевания приводят к развитию метаболического ацидоза? 7. Изложите современные представления о свертывании крови. 8. Какое значение имеет витамин К в синтезе факторов свертывания крови? 9. Какие механизмы приводят к активации ферментов каскада свертывания крови? 10. Что такое антикоагулянтный путь? 11. Охарактеризуйте функционирование противосвертывающей системы крови. 12. Каковы причины развития гемофилий А и В? В чем их отличия?
БИОХИМИЯ ПЕЧЕНИ ОСНОВНЫЕ ФУНКЦИИ ПЕЧЕНИ Невозможно найти такое звено обмена веществ в организме, которое так или иначе не было бы связано с процессами, протекающими в печени. Печень отличается разнообразием ферментов, а соответственно и метаболических превращений веществ. Важнейшие функции печени: 1. Биосинтез веществ «на экспорт». К ним относятся белки плазмы крови, глюкоза, жиры, кетоновые тела и другие. 2. Биосинтез мочевины как конечного продукта обмена азота в организме. 3. Пищеварительная функция, связанная с синтезом желчных кислот, образованием и секрецией желчи. 4. Обезвреживание токсических веществ, образующихся в организме или поступающих извне. 5. Выделительная функция – выделение некоторых продуктов метаболизма с желчью в кишечник. Это единственный способ удаления избытка холестерина из организма и образующихся из него желчных кислот с калом. С желчью выводятся также продукты распада гема (желчные пигменты) и многие продукты, образующиеся в результате обезвреживания веществ в печени. Примерно 80% клеток печени приходится на гепатоциты; около 15% составляют эпителиальные клетки, из которых 44% - клетки Купфера. Наряду с печёночными и купферовскими клетками в печени имеется и небольшое количество соединительной стромы. Она состоит, главным образом, из коллагена. Через печень протекает около 1,2 л крови в минуту, причем 70% ее поступает через воротную вену, собирающую кровь от пищеварительного тракта. Несмотря на то, что всасывание питательных веществ из кишечника в кровь происходит прерывисто, непостоянно (и потому в портальном круге кровообращения могут наблюдаться изменения концентрации ряда веществ - глюкозы, аминокислот и др.), в общем же круге кровообращения изменения в концентрации указанных соединений незначительны, благодаря важной роли печени в поддержании постоянства внутренней среды организма. При некоторых патологических процессах (циррозы) относительное содержание в печени соединительной ткани значительно увеличивается, что оказывает прессорный эффект на кровеносные сосуды и нарушает отток желчи; особенно сильно при этом страдает портальное кровообращение. Около 70% массы печени составляет вода, содержание которой подвержено значительным колебаниям, как в норме, так и при патологии, что указывает на активное участие печени в регуляции водно-солевого гомеостаза. При отеках количество воды может составлять до 80% массы органа; при избыточном отложении жира печени количество воды может существенно снижаться. Около половины сухого остатка ткани печени приходится на белки, причем из них большую часть составляют глобулины. Остальные белки представлены альбуминами, нуклеопротеидами и коллагеном. Из белков, специфических для печени, а также для селезёнки и костного мозга, следует отметить хромопротеин ферритин, содержащий железо. Печень очень богата различными ферментами. Наряду с ферментами, имеющимися и в других органах, печень содержит ферменты, присущие только ей. К ним относятся ферменты, катализирующие синтез мочевины, отщепление фосфорной кислоты от глюкозо-6-фосфата, образование эфиров глюкуроновой кислоты и др. Значение целого ряда ферментов, участвующих в метаболизме различных веществ в печени (белков, жиров, углеводов, пигментов) имеет огромное диагностическое значение в клинической биохимии. Печень является депо для полисахарида гликогена. При тяжёлых паренхиматозных поражениях печени количество гликогена в печёночных клетках резко снижается. И, наоборот, при различных типах гликогеновой болезни (гликогенозы) оно увеличивается, доходя до 20% и более от массы печени. В химическом составе печени определенное место занимают липиды: нейтральные жиры (триглицериды), фосфолипиды, холестерин и др. При выраженном ожирении содержание липидов может достигать 20% от массы органа, а при жировом перерождении до 50%. При некоторых патологических процессах в печени возрастает содержание продуктов обмена липидов. Так, при болезни Нимана-Пика происходит отложение в печени, а также в селезёнке сфингомиелина, а при болезни Гоше – накопление цереброзида керазина. Печень чрезвычайно богата различными витаминами, особенно витаминами А, С, РР, пантотеновой кислотой, в меньшей степени – витаминами В6, Е и В2. Важнейшую роль играет печень в образовании метаболита витамина D3 – его транспортной формы 25-гидроксихолекальциферола (25-ОН-D3). Разнообразен и минеральный состав печени. В ней содержатся Na, K, Cа, Mg и ряд микроэлементов: Fe, Zn, Cu, Mn, As и др. Количество железа, меди, марганца и мышьяка превышает содержание этих элементов в других органах. При ряде патологических процессов содержание элементов может значительно изменяться. |
|