|
|
Зависимость скорости реакции от различных факторовФЕДЕРАЛЬНОЕ АГЕНТСТВО ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ» (МИИТ) НИЖЕГОРОДСКИЙ ФИЛИАЛ Химия Тетрадь для выполнения лабораторных работ для студентов I курса заочного отделения Выполнил студент 1 курса Шифр: Ф.И.О.: Специальность: Проверил: проф.Заглядимова Н.В. Н.Новгород 2015 год Лабораторная работа № 1 Химическая кинетика Зависимость скорости реакции от различных факторов Цель работы: Изучить зависимость скорости реакции от концентрации.
Теоретическое обоснование: Несмотря на термодинамическую возможность процесса (ΔG<0), тем не менее, многие химические реакции практически не реализуются (очень мала скорость их протекания). Следовательно, для оценки реального процесса кроме его термодинамического рассмотрения необходим и иной подход, учитывающий фактор времени. В связи с этим возникает вторая проблема в изучении поведения веществ – «Как протекают химические реакции?» Ответ на этот вопрос дает химическая кинетика, изучающая скорость химических реакций (Vх.р.) и их механизм. При изучении данной темы необходимо учесть, что большинство реальных процессов – многостадийны (V1+V2+…+vLim) и их скорость, как правило, определяется наиболее медленно протекающей лимитирующей стадией (VLim). Скорость химической реакций зависит от целого ряда факторов, в частности, природы вещества, концентрации, температуры, влияния катализатора и др. [V=ƒ(С, Т, Кат)]. Прежде всего, надо обратить внимание на основной закон химической кинетики – кинетический закон действующих масс, отражающий зависимость скорости элементарной реакции от концентрации.
Для реакции aА + bB = сС + dD
закон действия масс имеет вид:
где СА или [A] - концентрация вещества А, моль/л; СВ или [В] - концентрация вещества В, моль/л; а и b – коэффициенты в уравнении реакции; k – коэффициент пропорциональности, называемый константой скорости. Если принять, что [A]=[B]=1 моль/л, то v= k, то есть константа скорости k численно равна скорости реакции, если концентрации реагирующих веществ равны единице. При этом следует знать, что для характеристики скорости чаще используют константу скорости (К), как не зависящую от концентрации, а не собственно скорость. Экспериментальная часть: В результате реакции между серной кислотой и серноватистокислым натрием образуется сера, выделяющаяся в виде мути:
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S ¯ белый осадок Ход работы: Время от начала реакции до момента появления мути зависит от скорости этой реакции. В три пробирки налить: 1. 15 капель раствора Na2S2O3 2. 10 капель раствора Na2S2O3 и 5 капель Н2О 3. 5 капель раствора Na2S2O3 и 10 капель Н2О В каждую пробирку быстро прикапать 5 капель раствора серной кислоты и быстро перемешать. Определить через какое количество времени появится муть в каждой пробирке. Результаты опытов записать в табл.1.
Таблица 1
По результатам наблюдений построить график зависимости скорости реакции от концентрации раствора. По оси абсцисс отложить относительную концентрацию раствора С, по оси ординат - относительную скорость реакции V.
Сделайте вывод: Контрольные вопросы: 1. Как записать выражение закона действующих масс для следующих простых реакций? 2H2(г) + O2(г) = 2H2O(г); O2(г) + 2Zn(к) = 2ZnO(к). 2. Как изменится скорость реакции 2NO(г) + Cl2(г) =2NOCl(г) при увеличении концентрации NO(г) в 3 раза? 3. Реакция H2 + I2 =2HI протекает с заметной скоростью с образованием активированного комплекса. Объясните её механизм. 4. Во сколько раз увеличится скорость реакции, для которой температурный коэффициент равен 2,5 при увеличении температуры от 40 до 900С? 5. Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300, если температурный коэффициент ее скорости равен 3?
Ответы: Лабораторная работа № 2 Химическое равновесие
12 |
|
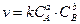 или
или

