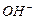|
|
Влияние различных факторов на химическое равновесие
Цель работы: Рассмотреть влияние концентрации на химическое равновесие.
Теоретическое обоснование: При всестороннем изучении химического процесса следует исходить из того, что большинство реакций являются химически обратимыми, т.е. протекающими как в прямом, так и обратном направлениях (↔). При этом со временем скорость (заметьте, что время протекания реакции обратно пропорционально ее скорости) прямой реакции уменьшается, а обратной – увеличивается. Состояние системы, при котором скорости обеих реакций становятся равными, и есть состояние химического равновесия ( Важнейшей характеристикой этого состояния является величина константы равновесия (Кр), выражение которой, полученное на основе закона действующих масс, утверждает, что для любой реакции существует отношение равновесных концентраций, которое при постоянной температуре не зависит от изменения концентрации. Выведем константу равновесия для обратимых химических реакций (в общем виде):
Применим закон действия масс и запишем выражения скорости прямой и обратной реакций: · скорость прямой реакции: vпр. = k1[A]a[B]b · скорость обратной реакции: vобр. = k2[C]c[D]d · в состоянии равновесия: vпр. = vобр. , т.е. k1[A]a[B] b= k2[C]c[D]d Переносим постоянные величины (константы скорости) в левую часть равенства, а переменные (концентрации) – в правую часть равенства, т.е. записываем данное равенство в виде пропорции:
Так как величиныk1иk2вопределенных условиях постоянны, то и отношение их тоже будет постоянной величиной для данной системы. Её обозначают К и называют константой равновесия.
Из уравнения следует, что реакция, которая идет «до конца», имеет очень большую величину Кр, равновесные концентрации исходных реагентов при этом невелики. Реакции же, которые «не протекают», наоборот – имеют очень малую величину Кр, равновесные концентрации продуктов незначительны. Таким образом, строго говоря, все реакции протекают обратимо, и ни одна реакция не доходит до конца, т.е. каждая изолированная система, в конце концов, придет к равновесию. Вышеизложенное приводит Вас к пониманию физического смысла константы равновесия, заключающегося в характеристике глубины протекания химического процесса (выход продукта), определяемой преобладанием скорости прямой реакции над обратной (Кр=К1/К2). Исследуя признаки химического равновесия, обратите внимание, прежде всего, на термодинамический характер этого состояния, т.е. равновесие не зависит от пути процесса. Следует помнить, что важнейшим признаком химического равновесия является его подвижность (↔), приводящая к нарушению равновесия ( Ле-Шателье (Д = пД) дает возможность управлять этим процессом. Принцип Ле-Шателье- если на систему, находящуюся в равновесии, оказать какое-либо воздействие извне (изменить С, Т, Р), то равновесие сместится в том направлении, которое уменьшает оказанное воздействие. Итак, применяя данный принцип к влиянию концентрации, следует, что для смещения равновесия вправо необходимо увеличить концентрации исходных веществ и уменьшить концентрации продуктов реакции. Увеличение же концентрации продукта реакции смещает равновесие системы влево в сторону исходных веществ. Экспериментальная часть:
FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl розовый цвет
Ход работы: Смешать в четырёх пробирках слабые растворы хлорного железа и роданистого аммония, взяв их в равных количествах (по 5 капель). Получается раствор розового цвета, в котором находятся четыре вещества. Пробирку № 1 оставить как контрольную для сравнения цвета. В пробирку № 2 добавить 1-2 капли концентрированного раствора хлорного железа (FeCl3), в пробирку № 3 – такое же количество концентрированного раствора роданистого аммония (NH4CNS). Объясните изменение окраски, указав, в какую сторону сдвинулось равновесие в системе. В пробирку № 4 добавить 1-2 капли концентрированного раствора хлористого аммония (NH4Cl). Объяснить, почему наблюдается ослабление окраски. Результаты записать в табл. 2. Написать выражение константы равновесия Кр для данной реакции (на основании закона действия масс).
Таблица 2
Сделайте вывод: Контрольные вопросы: 1. Напишите выражение Кр для гомогенной системы N2 + 3H2 Какими изменениями концентрации, температуры и давления можно повысить выход NH3? 2. Напишите выражение Кр для гетерогенной системы CO2 + C Какими изменениями концентрации и давления сместить влево равновесие системы? 3. Почему при изменении давления смещается равновесие системы 4HCl(г) + O2(г) и не смещается равновесие системы H2(г) + I2(г) Напишите выражение Кр для каждой из систем. 4. Объясните, почему в реакции FeCl3 + 3NH4CNS Добавление NH4CNS дает значительно более яркое окрашивание Fe(CNS)3 чем действие FeCl3. 5. При 500 К константа равновесия равна 3,4·10-5. Вычислите для этой реакции
Ответы:
Лабораторная работа № 3 Гидролиз солей
Цель работы: 1. Определение рН водных растворов солей. 2. Анализ солей с точки зрения теории электролитической диссоциации.
Теоретическое обоснование: Повсеместность распространения растворов обусловлена самопроизвольным протеканием процессов растворения (∆G < 0) за счет увеличения энтропии в результате смешивания частиц. Изучая растворы, следует помнить о физико-химической природе происхождения растворов, знать основные признаки истинных растворов. Известно, что существуют растворы неэлектролитов и электролитов. Электролиты проводят электрический ток за счет процесса электролитической диссоциации, представляющего собой распад молекул на ионы под действием растворителя (за счет гидратации). Преобразуя выражение константы диссоциации воды (слабый электролит) приходим к понятию ионного произведения воды.
При изучении электролитов, следует обратить внимание на их важнейшую характеристику - силу электролита, оцениваемую величинами степени диссоциации (a) и константы диссоциации (Кд). Различают сильные и слабые электролиты. При этом необходимо иметь в виду, что сильные электролиты диссоциируют практически нацело ( Сильные электролиты существуют преимущественно в виде ионов, а слабые - в виде недиссоциированныхмолекул. (К Водородный показатель pH – характеристика среды pH = -lg[H+]; для нейтральной среды pH=7; для кислой среды pH<7; для щелочной среды pH>7. Эта величина приобретает особое значение при изучении явления гидролиза как особого типа ионообменных реакций в растворах. Гидролиз соли - процесс обменного взаимодействия ее с молекулами воды, сопровождающийся изменением pH раствора и образованием слабого электролита. Поэтому в реакции гидролиза участвует только слабый компонент соли, а среду создает сильный компонент соли Изучая это явление, проведите классификацию солей (анализ солей с точки зрения теории электролитической диссоциации) по их способности подвергаться гидролизу. В каких случаях гидролиз не идет, а когда соль гидролизируется особенно сильно? Почему? Научитесь составлять ионообменные реакции гидролиза (учитывая ступенчатый гидролиз), при этом не забывайте о величине pH. Глубину протекания данного процесса количественно оценивайте величиной константы гидролиза Кг. Из определения процесса гидролиза следует что соли, образованные двумя сильными компонентами гидролизу не подвергаются, рН=7. Не забывайте, что в холодных и умеренно концентрированных растворах гидролиз практически ограничивается первой стадией.
Экспериментальная часть:
Таблица № 1 Ход работы:
Таблица № 2
Сделайте выводы: 1. Все ли соли подвергаются гидролизу? 2. Как протекает гидролиз солей, образованных слабым основанием и слабой кислотой, слабым основанием и сильной кислотой, сильным основанием и слабой кислотой, сильным основанием и сильной кислотой. Составьте уравнения гидролиза этих солей, укажите Кд и pH (>7 или <7).
Контрольные вопросы: 1. Какой раствор будет более щелочным: Na2SO3 или Na2SiO3? Составьте молекулярные и ионно-молекулярные уравнения реакций. 2. Важнейший полупродукт титанового производства – тетрахлорид титана (TiCl4) – дымит на воздухе. Объясните это явление, подтвердив его соответствующими реакциями. 3. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: FeCl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 4. Почему раствор NH4CH3COO имеет рН=7, а NH4CN - рН=10? Чем Вы это можете объяснить? 5. По формулам солей CsNO3, BiCl3, K2Cr2O7 предскажите реакцию среды этих растворов (рН). Составьте молекулярные и ионно-молекулярные уравнения гидролиза K2Cr2O7.
Ответы: Лабораторная работа № 4 Электролиз Цель работы: Ознакомиться с основными положениями электрохимии, работой химического источника тока, способами определения и расчета его электродвижущей силы (ЭДС), закономерностями протекания электролиза.
Теоретическое обоснование: Электрохимические процессы Различают электрохимические процессы двух типов: одни идут самопроизвольно (∆G < 0) за счет превращения химической энергии в электрическую X®Э, другие - только под действием электрического тока Э®Х (∆G > 0). Этим и определяется их практическое использование. Следовательно, тип процесса является основным предметом изучения данной темы. Химизм любого электрохимического процесса отражает следующее ключевое уравнение обратимой реакции
,
направление, которой и определяет тот или иной тип процесса. Первый тип процессов включает химические источники токаи коррозиюи характеризуется величиной ЭДС (исходя из формулы DG0 = -nFE0). В основе электрохимической коррозии лежит механизм образования локальных микрогальванических элементов (пар), на подавлении работы которых и основана защита металлов от коррозии. Второй тип процессов представляет электролиз, который используется для получения веществ (металлов, кислот, щелочей и др.), а в инженерной практике с помощью растворимого анода производятся металлические покрытия, очистка металлов, электрохимическая обработка их. Конкретное протекание электролиза определяется последовательностью выделения веществ на электродах (катод, анод), характеризуемой значениями электродных потенциалов. Именно ряд φ есть самая важная количественная характеристика в электрохимии. Стандартный электродный потенциал (φ°) возникает вследствие образования двойного электрического слоя на границе фаз (Ме - раствор). Двойной электрический слой, в свою очередь, - результат гетерогенной окислительно-восстановительной реакции, в которой процессы окисления и восстановления пространственно разделены. Поэтому анодный А (окисление) и катодный К (восстановление) процессы, составляющие химическую сущность электрохимии, есть не что иное, как электронные уравнения. Запомните, что в электрохимии на аноде (А) всегда происходит полуреакция окисления, а на катоде (К) - полуреакция восстановления Вывод. Использование электрохимического процесса основано на определении его типа, т.е. направления превращения энергии Х Û Э (гальванический элемент или электролиз) в зависимости от знака ЭДС (φК - φА). Ряд φ0 позволяет составить уравнения анодного и катодного процессов, с тем, чтобы предвидеть возможность практического применения их. Электролиз В отличие от первого типа электрохимических процессов, протекающих самопроизвольно (DG<0), второй типпроцессов – электролиз (Э ® X) происходит только под действием электрического тока (DG>0). Количественная сторона процесса электролиза характеризуется законами Фарадея. При рассмотрении электролиза особое внимание уделите последовательности разряда ионов на электродах, которая определяется величинами электродных потенциалов процессов. При этом помните, что на катоде в первую очередь восстанавливаются положительные ионы (или молекулы Н2О в водных растворах) с наибольшим значением потенциала φ0, а на аноде - преимущественно окисляются отрицательные ионы (или молекулы Н2О в водных растворах) с меньшим значением электродного потенциала. Однако указанная последовательность разряда ионов на электродах часто нарушается из-за явления, называемого перенапряжением, которое объясняется кинетикой электродных процессов (их многостадийностью и замедленностью отдельных стадий). В связи с практическим применением в технике обратите внимание на электролиз с растворимым анодом (гальванопластика, анодирование, электрохимическая обработка металлов и т.д.). В случае металлических покрытий покрываемое изделие служит катодом, а покрывающий металл - анодом, при этом процесс электролиза сводится к переносу ионов металла с анода на катод. Итак, электрохимические процессы, связанные с химией поверхностей (наряду с гетерогенным катализом, растворением, осаждением и др.), являются одними из наиболее интересных и важных в практическом отношении химических реакций. Какова их роль в инженерной практике?
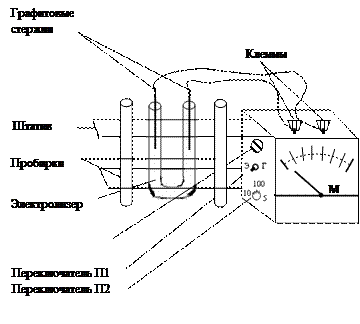
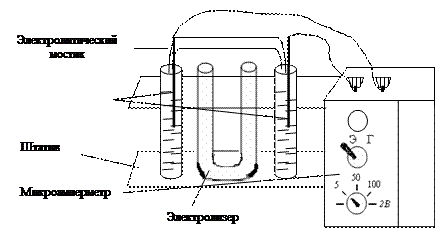
Экспериментальная часть: Описание прибора
Прибор представляет собой простейший ампервольтметр с универсальным шунтом (рис. 1). Он предназначен для проведения лабораторных работ по разделам химии: А. Электролиз растворов Б. гальванический элемент В. Электролитическая диссоциация. На передней панели прибора (рис. 2) расположены: шкала микроамперметра М-285 К, переключатель рода работ (П1) с двумя положениями: «Г» - гальванический элемент, «Э» - электролиз, электролитическая диссоциация; переключатель пределов измерений (П2) с четырьмя положениями (три на ток и одно на напряжение). В левом верхнем углу панели вмонтирована сигнальная лампа, которая загорается при прохождении большого тока через электролит (сильный электролит). На верхней стороне прибора расположены клеммы для подключения электродов. Слева к прибору прикреплен штатив с электролизером и двумя пробирками. Прибор питается от сети постоянного тока напряжением 9 В. Вилку прибора вставляют в розетку так, чтобы окрашенные в белый и черный цвет части розетки и вилки совпали. В противном случае стрелка микроамперметра будет отклоняться влево – прибор будет «зашкаливать».
Рис. 1
Рис. 2 Ход работы: Опыт № 1 Электролиз хлорида меди Исследуемый раствор наливают в электролизер, который представляет собой U - образно изогнутую стеклянную трубку, в колена которой опускают графитовые электроды. Электролизер наполняют до половины концентрированным раствором хлорида меди. Запишите показания прибора. Что происходит на катоде? Какой газ выделяется на аноде? Составьте уравнения электродных реакций. Опыт № 2Электролиз иодида калия Электролизер наполните на 3/4 объема раствором иодида калия. Прибавьте в каждое колено по 2 капли фенолфталеина. Опустите в колена электролизера графитовые электроды. В каком колене и почему окрасился раствор? Где и почему выделяется иод? Составьте уравнения электродных реакций. Что образовалось в прикатодном пространстве?
Заполните таблицу
Сделайте вывод: Контрольные вопросы: 1. В водном растворе электролита присутствуют катионы металлов: Cd2+, Sn2+, Al3+, Zn2+, Na+. Какой катион будет восстанавливаться первым на катоде при электролизе? Ответ подтвердите составлением катодных процессов. 2. При электролизе водных растворов каких солей у анода выделяется кислород? CuSO4, KCL, Fe(NO3)3, Сs3PO4. Ответ подтвердите составлением электродных процессов. 3. Что образуется в результате электролиза раствора CuSO4? Составьте уравнения электродных процессов. 4. При электролизе водных растворов каких веществ CuCl2, K2SO4, NiSO4, NaCl – на катоде выделяется водород. Составьте уравнения катодных процессов. 5. Составьте уравнения реакций, происходящих на электродах при электролизе раствора и расплава KOH.
Ответы: Лабораторная работа № 5 12 |
|
 ).
). .
.
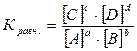 .
.
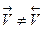 ), т.е. к его смещению при изменении внешних условий. При этом очень важно уметь предвидеть направление, в котором происходит смещение равновесия под действием различных факторов. Знание принципа
), т.е. к его смещению при изменении внешних условий. При этом очень важно уметь предвидеть направление, в котором происходит смещение равновесия под действием различных факторов. Знание принципа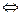 2NH3,
2NH3, 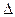 H = - 46 кДж
H = - 46 кДж .
.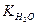 = [H+][OH-] = 10-14 (моль/л).
= [H+][OH-] = 10-14 (моль/л). =10-14). Эта константа дает возможность определить среду раствора (нейтральную, кислую, щелочную) через величину водородного показателя pH.
=10-14). Эта константа дает возможность определить среду раствора (нейтральную, кислую, щелочную) через величину водородного показателя pH.
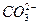 +НОН=
+НОН=
 +
+