|
|
диффузия частиц растворенного вещества.248. С точки зрения протолитической теории кислоты –это: 1) вещества, диссоцирующие на ионы; 2) вещества, которые способны отдавать протоны; 3) вещества, которые способны принимать протоны; 4) электролиты, диссоцирующие в водном растворе на ионы гидроксония и кислотных остатков; 5) сложные вещества, образующие при диссоциации разноименно заряженные ионы. 249. С точки зрения протолитической теории основания –это: 1) вещества, диссоцирующие на ионы; 2) вещества, которые способны отдавать протоны; 3) вещества, которые способны принимать протоны; 4) электролиты, диссоцирующие в водном растворе на ионы гидроксония и кислотных остатков; 5) сложные вещества, образующие при диссоциации разноименно заряженные ионы. 250. Отношение количества растворенного вещества к объему раствора – это: 1) массовая доля растворенного вещества; 2) моляльная концентрация; 3) молярная концентрация; 4) молярная концентрация эквивалента; 5) мольная доля. 251. Отношение количества растворенного вещества к массе растворителя – это: 1) массовая доля растворенного вещества; 2) моляльная концентрация; 3) молярная концентрация; 4) молярная концентрация эквивалента; 5) мольная доля. 252. Отношение массы растворенного вещества к массе раствора – это: 1) массовая доля растворенного вещества; 2) моляльная концентрация; 3) молярная концентрация; 4) молярная концентрация эквивалента; 5) мольная доля. 253. Запись на этикетке склянки «0,5н.» показывает что: 1) В 1 литре раствора находится 0,5 моль растворенного вещества; 2) В 1 литре раствора находится 0,5 моль эквивалентов растворенного вещества; 2bm 3) В 100 граммах раствора находится 0,5 моль растворенного вещества; 4) В 100 граммах раствора находится 0,5 грамм растворенного вещества; 5) В 1 литре растворителя находится 0,5 моль растворенного вещества. 254. Запись на этикетке склянки «0,5%-ный» показывает что: 1) В 1 литре раствора находится 0,5 моль растворенного вещества; 2) В 1 литре раствора находится 0,5 моль эквивалентов растворенного вещества; 3) В 100 граммах раствора находится 0,5 моль растворенного вещества; 4) В 100 граммах раствора находится 0,5 грамм растворенного вещества; 5) В 1 литре растворителя находится 0,5 моль растворенного вещества. 255. Концентрация ионов водорода в растворе равна [Н+] = 5·10-6 моль/л. Чему равна pH раствора? 1) 6,0 2) 5,0 3) 5,3 4) 3,6 5) 5,6 256. Концентрация ионов водорода в растворе равна [Н+] = 2,5·10-4 моль/л. Чему равна pH раствора? 1) 6,0 2) 5,0 3) 5,3 4) 3,6 5) 5,6 257. Продуктами гидролиза К3РО4 по второй ступени являются: 1) Н3РО4 и КОН 2) К2НРО4 и КОН 3) КН2РО4 и КОН 4) Н3РО4 и К2О 5) 3К+ и РО43- 258. Продуктами гидролиза AlCI3 по первой ступени являются: 1) AIOHCI2 + HCI 2) AI(OH)2CI + HCI 3) AI(OH)3 + HCI 4) AI2O3 + HCI 5) AI3+ + 3CI- 259. Какие продукты образуются при сливании растворов AlCI3 и Na2CO3: 1) Al2(СО3)3 + NaCI 2) Al2(СО3)3 + NaCI + СО2 3) Al(ОН)3 + NaCI + СО2 4) Al(ОН)3 + СО2 5) Al2(СО3)3 + НCI + Н2О 260. На степень электролитической диссоциации не оказывает влияние: 1) природа растворителя; 2) давление; 3) природа растворенного вещества; 4) концентрация раствора; 5) температура. 261. Добавление одноименных ионов: 1) увеличивает степень диссоциации 2) уменьшает степень диссоциации; 3) увеличивает температуру раствора; 4) увеличивает растворимость вещества; 5) не влияет на степень диссоциации. 262. В каком ряду находятся только слабые электролиты: 1) все растворимые соли; 2) азотная, серная, соляная кислоты; 3) щелочи; 4) вода, гидроксид аммония, синильная кислота; 5) вода, серная кислота, едкий натр.
“Окислительно-восстановительные реакции, электрохимия” 263. Какое вещество-продукт восстановления разбавленной серной кислоты - образуется в реакции Fe+H2SO4 (раз): 1) H2S; 2) S; 3) SO2; 4) H2; 5) SO3. 264. В уравнении реакции K2Cr2O7+KNO2+H2SO4 расставьте коэффициенты и укажите коэффициент перед серной кислотой: 1) 6; 2) 8; 3) 10; 4) 4; 5) 2. 265. Какой продукт образуется при взаимодействии цинка с очень разбавленной азотной кислотой: 1) NO2; 2) H2; 3) NO; 4) NH4NO3; 5) HNO2. 266. Какой металл при взаимодействии с концентрированной азотной кислотой может восстановить ее до NO2: 1) Cs; 2) Ca; 3) Ba; 4) Cu; 5) Zn. 267. Какой из продуктов образуется при взаимодействии меди с концентрированной серной кислотой: 1) H2S; 2) H2; 3) S; 4) SO2; 5) SO3. 268. Какое вещество-продукт окисления фосфора- образуется в реакции P+HNO3 (конц): 1) H3PO4; 2) P2O5; 3) H3PO3; 4) PH3; 5) H3PO2. 269. В уравнении реакции K2Cr2O7+H2O2+H2SO4 расставьте коэффициенты и укажите коэффициент перед восстановителем: 1) 3; 2) 5; 3) 7; 4) 10; 5) 4. 270. В каком из процессов происходит восстановление: 1) Cr(OH)3 2) H2S 3) K2Cr2O7 4) MnO 5) MnCI2 271. Подберите коэффициенты в уравнении V+HF+HNO3 и укажите коэффициент при формуле воды: 1) 2; 2) 5; 3) 10; 4) 21; 5) 3. 272. Раствор какого из приведенных соединений марганца имеет зеленую окраску : 1) MnO2; 2) KMnO4; 3) K2MnO4; 4) Mn2O3; 5) MnCI2. 273. Расставьте коэффициенты в уравнении AI+NaOH+H2O и подсчитайте их сумму: 1) 17; 2) 19; 3) 21; 4) 23; 5) 14. 274. Окислители – это: 1) Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции повышается; 2) Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции понижается; 3) Свободные металлы; 4) Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции не изменяется; 5) Вещества, содержащие в своем составе элемент, который находится в самой низшей степени окисления. 275. Восстановители – это: 1) Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции повышается; 2) Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции понижается; 3) Свободные галогены; 4) Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции не изменяется; 5) Вещества, содержащие в своем составе элемент, который находится в самой высшей степени окисления. 276. Как называются реакции, в результате которых один и тот же элемент и окисляется и восстанавливается: 1) Внутримолекулярные окислительно – восстановительные реакции; 2) Межмолекулярные окислительно – восстановительные реакции; 3) Реакции диспропорционирования; 4) Реакция разложения; 5) Межатомные окислительно – восстановительные реакции. 277. Как называются реакции, в которых одно вещество является окислителем,а другое– восстановителем : 1) Внутримолекулярные окислительно – восстановительные реакции; 2) Межмолекулярные окислительно – восстановительные реакции; 3) Реакции диспропорционирования; 4) Реакция разложения; 5) Межатомные окислительно – восстановительные реакции. 278. Разложение по схеме 2КСlО3 1) Межмолекулярного окисления – восстановления; 2) Внутримолекулярного окисления – восстановления; 3) Диспропорционирования; 4) Диссоциации; 5) Горения. 279. Реакция по схеме Cl2 + Н2О 1) Межмолекулярного окисления – восстановления; 2) Внутримолекулярного окисления – восстановления; 3) Диспропорционирования; 4) Диссоциации; 5) Гидратации. 280. В процессе окисления степень окисления элемента: 1) Повышается; 2) Понижается; 3) Не изменяется; 4) Становится равным нулю; 5) Становится отрицательным. 281. В процессе восстановления степень окисления элемента, входящего в состав вещества: 1) Повышается; 2) Понижается; 3) Не изменяется; 4) Становится равным нулю; 5) Становится отрицательным. 282. Самая высшая степень окисления хрома в соединениях равна: 1) +2; 2) +3; 3) +5; 4) +6; 5) +7. 283. Если в составе вещества элемент находится в своей самой низшей степени окисления, то данное вещество является: 1) Только окислителем; 2) Только восстановителем; 3) И окислителем, и восстановителем; 4) Слабым окислителем; 5) Сильным окислителем. 284. В каком случае при электролизе водных растворов указанных солей у анода выделяется кислород: 1) MqSO4; 2)CuС12; 3) ZnС12; 4) CuCl2; 5) Na2S. 285. Какая масса хлорида натрия необходима для получения при электролизе 44,8 л Cl2: 1)117 г; 2) 234 г; 3) 11,7 г; 4) 23,4 г; 5) 22.4 л. 286. При электролизе водных растворов каких из солей на катоде выделяется водород: 1) CuCl2; 2) CuSO4; 3) MqCl2; 4) Cu(NO3)2; 5) AqNO3. 287. В каком случае первый металл вытесняет ионы второго: 1) Cu и Zn; 2) Fe и Cu; 3) Cu и Fe; 4) Zn и Mq; 5) Zn и Na. 288. При электролизе водных растворов какой соли на катоде выделяется металл: 1)ZnCl2; 2) NaCl; 3) CuSO4; 4) K2SO4; 5) Cа(NO3)2 . 289. Какой металл вытесняет свободный марганец из водных растворов его солей: 1) Cr; 2) Aq; 3) Cu; 4) Mq; 5) Fe. 290. Какие из защитных покрытий являются анодными по отношению к защищаемому металлу: 1) Fe покрыто Cd; 2) Fe покрыто Al; 3) Cr покрыт Cu; 4) Al покрыт Au; 5) Zn покрыт Cu. 291. О фторе нельзя сказать, что он 1) самый активный 2) самый электроотрицательный 3) самый агрессивный Самый легкий элемент 5) самый сильный окислитель. 292. Наиболее ярко выражены окислительные свойства У фтора 2) у хлора; 3) у бромида 4)у иода 5) у серы. 293. Наиболее ярко выражены восстановительные свойства 1) у фтора; 2) у хлора; 3) у бромида; 4) у иодида; 5) не знаю. 294. При электролизе раствора сульфата меди (II) на инертных электродах выделяются : 1) Cu, O2; 2) Cu, SO2; 3) Cu, H2; 4) Cu, SO3; 5) H2, SO2. 295. Какой газ выделяется у инертного анода при электролизе раствора сульфата калия: 1) О2; 2) Н2; 3) SO2; 4) SO3; 5) Н2S. 296. Какой газ выделяется у катода при электролизе раствора сульфата калия: 1) О2; 2) Н2; 3) SO2; 4) SO3; 5) Н2S. 297. Какое уравнение соответствует электролизу раствора хлорида натрия: 1) 2NaCI → 2Na + CI2 2) NaCI + H2O → NaOH + HCI 3) 2NaCI + 2H2O → 2NaOH + H2 + CI2 4) NaCI + H2O → NaOH + H2 + O2 5)NaCI → Na+ + CI- 298. Какое уравнение соответствует электролизу расплава хлорида натрия: 5) 2NaCI → 2Na + CI2 6) NaCI + H2O → NaOH + HCI 7) 2NaCI + 2H2O → 2NaOH + H2 + CI2 8) NaCI + H2O → NaOH + H2 + O2 5)NaCI → Na+ + CI- 299. При измерении электродных потенциалов металлов в качестве электрода сравнения используется: 1) угольный электрод; 2) инертный электрод; 3) графитовый электрод; 4) никелевый электрод; 5) водородный электрод; 300. Какое вещество накапливается в катодном пространстве в растворе при электролизе раствора K2SO4 1) KOH 2) H2SO4 3) H2 4) O2 5) KHSO4 |
|
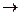 KNO3+K2SO4+Cr2(SO4)3+H2O
KNO3+K2SO4+Cr2(SO4)3+H2O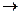 2КCl + О2 является реакцией:
2КCl + О2 является реакцией: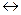 НCl + НClО является реакцией:
НCl + НClО является реакцией: