|
|
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.ХИМИЧЕСКОЕ РАВНОВЕСИЕ Пример 1 Оксид азота (II) и хлор взаимодействует по уравнению реакции Решение. Запишем выражение закона действующих масс для этой реакции согласно формуле (12)
Для газообразных веществ давление пропорционально их концентрации, следовательно, можно записать: 1) Допустим, давление NO возрастает в х раз, тогда
Следовательно, согласно условию задачи:
Решая данное уравнение, получим,
Т.е., давление NO необходимо увеличить в 4 раза. Поскольку концентрация 2) При увеличении давления во всей системе в х раз получим
Решая данное уравнение, получим,
Пример 2 Взаимодействие оксида азота (II) с кислородом протекает по уравнению реакции Решение. Запишем выражение закона действующих масс для этой реакции согласно формуле (12)
А) при увеличении концентрации
Следовательно: Б) при увеличении концентрации
Следовательно: В) при увеличении концентрации
Следовательно:
Пример 3 Скорость химической реакции при повышении температуры на 60 °С увеличится в 3,5 раза. Во сколько раз возрастет скорость этой реакции при увеличении температуры на 15 °С? Решение. Запишем выражение правила Вант-Гоффа согласно уравнению (13):
Согласно условию задачи: При увеличении температуры на 15 °С: Пример 4 При 65 °С некоторая реакция заканчивается за 50 минут. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если ее проводить при 150 °С? Решение.
Для решения воспользуемся формулой (14):
Согласно условию задачи: Þ
Пример 5 Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при 25 °С? Решение. Для решения воспользуемся уравнением Аррениуса (формула 15):
Обозначим для реакции, протекающей без катализатора энергию активации через Запишем уравнение Аррениуса: § реакция без катализатора: § реакция с катализатором: Найдем отношение констант скоростей:
Отсюда находим:
Таким образом, снижение энергии активации на 31,014 кДж привело к увеличению скорости реакции в 273 тысяч раз. Пример 6. Константы скорости реакции при 328,2 К и 298,2 К соответственно равны 0,01 Решение. Для расчета константы скорости реакции при 343,2 К воспользуемся формулой (16)
Пример 7. В гомогенной системе Решение. 1) Используя формулу 17, запишем выражение константы равновесия, протекающей реакции
С учетом данным задачи, получаем: 2) В условии задачи даны равновесные концентрации всех участников реакции. Для определения исходных концентраций реагирующих веществ рассуждаем следующим образом. Необходимо помнить, что исходное количество реагирующего вещества (Со(в-ва)), количество реагирующего вещества, вступившего в реакцию (
Для вещества Исходя из уравнения реакции: если реагирует 2 моль NО, то образуется 2 моль NО2; по условию задачи: если реагирует Þ
Следовательно,
Для вещества Исходя из уравнения реакции: если реагирует 1 моль по условию задачи: если реагирует Þ
Следовательно,
Можно оформить решение данной задачи в виде таблицы:
Пример 8. Исходные концентрации азота и водорода в реакционной смеси для синтеза аммиака составляли 4 и 10 моль/л соответственно. Каковы будут равновесные концентрации в этой смеси, если к моменту наступления равновесия прореагировало 50% азота (объем реакционной смеси не изменяется). Решение. Запишем уравнение реакции синтеза аммиака:
Пример 9. Используя справочные данные, найти приближенное значение температуры, при которой константа равновесия реакции образования водяного газа Решение.
Для решения воспользуемся формулами (20) и (10):
Согласно условию задачи Следовательно, Для расчета можно воспользоваться значениями Данные для решения задачи берем из справочника [1]:
Тепловой эффект реакции при температуре 298 К рассчитаем по уравнению 8:
Для данной реакции:
Изменение энтропии реакции рассчитываем по формуле:
где Для данной реакции:
Таким образом,
ЗАДАНИЯ ДЛЯ САМОПОДГОТОВКИ
1. Запишите кинетические уравнения для следующих реакций:
2. Как изменится скорость прямой реакции при увеличении давления в 4 раза для данных реакций: а) 3. При 20 оС реакция растворения железа в соляной кислоте заканчивается за 2 минуты, а при 40 оС – за 30 с. Определите, за какое время реакция закончится при 70 оС? 4. Рассчитайте среднюю скорость химической реакции, если за период измерений 15 с концентрация одного из реагентов изменилась с 0.35 моль/л до 0.31 моль/л. 5. При 30 оС скорость некоторой реакции равна 0.005 моль/лс. Температурный коэффициент этой реакции равен 2. Определите скорость этой реакции при 100 оС. 6. При некоторой температуре константа равновесия реакции
7. Определите, как необходимо изменить температуру и давление, чтобы увеличить выход продуктов реакции:
|
|
 . Во сколько раз нужно увеличить давление каждого из исходных веществ при неизменном давлении второго вещества, чтобы скорость реакции возросла в 16 раз? Во сколько раз нужно увеличить давление во всей системе, чтобы скорость реакции возросла в 16 раз?
. Во сколько раз нужно увеличить давление каждого из исходных веществ при неизменном давлении второго вещества, чтобы скорость реакции возросла в 16 раз? Во сколько раз нужно увеличить давление во всей системе, чтобы скорость реакции возросла в 16 раз?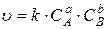

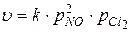

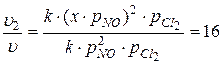 ,
,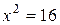 ,
,  .
. входит в выражение закона действующих масс в первой степени, то, очевидно, что для увеличения скорости в 16 раз давление хлора также необходимо увеличить в 16 раз.
входит в выражение закона действующих масс в первой степени, то, очевидно, что для увеличения скорости в 16 раз давление хлора также необходимо увеличить в 16 раз.
 .
.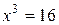 ,
,  .
. . Как изменится скорость реакции, если увеличить концентрацию: а) NO в 3 раза; б) О2 в 2 раза; в) NO и О2 в 2 раза.
. Как изменится скорость реакции, если увеличить концентрацию: а) NO в 3 раза; б) О2 в 2 раза; в) NO и О2 в 2 раза. 
 в 3 раза, получим
в 3 раза, получим
 , т.е. при увеличении концентрации
, т.е. при увеличении концентрации  в 2 раза, получим
в 2 раза, получим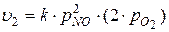
 , т.е. при увеличении концентрации
, т.е. при увеличении концентрации 
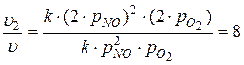 , т.е. при увеличении концентрации
, т.е. при увеличении концентрации  .
. Þ
Þ  .
. Þ
Þ  .
.

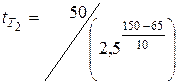 Þ
Þ  .
.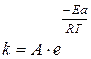 .
. , константу скорости – через
, константу скорости – через  , а для реакции, протекающей с катализатором – через
, а для реакции, протекающей с катализатором – через  и
и  , соответственно.
, соответственно.

 Þ
Þ  Þ
Þ 
 и 0,001
и 0,001  . Вычислите энергию активации данной реакции.
. Вычислите энергию активации данной реакции.  , из которой можно определить значение энергии активации – величины постоянной для данной реакции:
, из которой можно определить значение энергии активации – величины постоянной для данной реакции: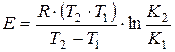 ,
,  (Дж).
(Дж). (
(  ) установилось равновесие при следующих концентрациях реагирующих веществ:
) установилось равновесие при следующих концентрациях реагирующих веществ:  ,
,  и
и  Вычислите константу равновесия и исходную концентрацию
Вычислите константу равновесия и исходную концентрацию 
 (л/моль).
(л/моль). ) и равновесное количество реагирующего вещества ([в-ва]) связаны между собой следующим выражением:
) и равновесное количество реагирующего вещества ([в-ва]) связаны между собой следующим выражением: .
. моль NО, то образуется 0,16 моль NО2:
моль NО, то образуется 0,16 моль NО2: моль.
моль.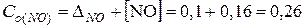 .
. моль
моль  моль.
моль. .
.



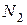 ,
т.е.
,
т.е.  моль
моль
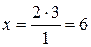 моль
моль


 моль NH3:
моль NH3:

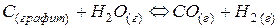 равна единице. Зависимостью
равна единице. Зависимостью  и
и  от температуры пренебречь.
от температуры пренебречь. ;
; 
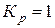 Þ
Þ  .
. Þ
Þ  .
. и
и  реакции.
реакции.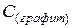



 , кДж/моль
, кДж/моль
 , Дж/(моль×К)
, Дж/(моль×К)

 ;
; 
 ,
, – стандартная энтропия вещества.
– стандартная энтропия вещества. ;
; 
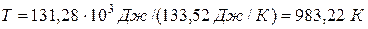
 ;
;  ;
; ;
; 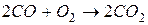 .
. ; в)
; в)  ?
? равна 1. Начальная концентрация СО равна 0,2 моль/л, Н2О – 0,5 моль/л. Рассчитайте равновесные концентрации всех газов в момент наступления равновесия.
равна 1. Начальная концентрация СО равна 0,2 моль/л, Н2О – 0,5 моль/л. Рассчитайте равновесные концентрации всех газов в момент наступления равновесия. ,
,  ,
,  ,
,  ,
,