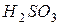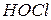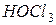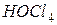|
|
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
Пример 1. Давление пара воды при 25 °С составляет 3167 Па. Вычислить для той же температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы ( Решение. Для расчета молярной массы растворенного вещества воспользуемся законом Рауля для нелетучего вещества (22): где Так как
С учетом данных задачи, получим:
Þ
Пример 2. Давление пара растворителя при 119,6 К составляет 87711 Па, а давление пара 5%-ного раствора – 84990 Па. Вычислить молярную массу растворенного вещества. Молярная масса растворителя 83,5 г/моль. Решение. Для расчета молярной массы растворенного вещества воспользуемся законом Рауля для нелетучего вещества (22): Согласно условию, массовая доля растворенного вещества Следовательно, можно записать
Þ Þ Þ Þ Решая уравнение, получаем,
Пример 3. Раствор, содержащий 1,22 г бензойной кислоты ( Решение.
Для решения задачи воспользуемся формулой 24:
Þ С учетом данных задачи, получаем:
Пример 4. Вычислить температуру кипения 15%-го раствора толуола ( Решение. Для решения задачи воспользуемся формулой 24:
Þ Согласно условию, массовая доля растворенного вещества С учетом данных задачи, получаем:
Пример 4. Вычислить осмотическое давление раствора, содержащего 16 г сахарозы ( Решение. Для решения задачи воспользуемся формулой 25:
где Св – молярность раствора, моль/м3; Т – температура, К; R – универсальная газовая постоянная, 8,314 Дж/(моль×К). Рассчитаем молярную концентрацию используемого раствора по формуле (29) (при расчете учтем, что Следовательно,
где Согласно данных задачи:
ЗАДАНИЯ ДЛЯ САМОПОДГОТОВКИ 1. Растворимость азота и кислорода в воде при 0 °С и 101325 Па равна соответственно 23,5 и 48,9 мл/л. Вычислите температуру замерзания воды, насыщенной воздухом. 2. Определите отношение осмотических давлений растворов мочевины ( 3. Раствор тростникового сахара (молекулярная масса 342), содержащий 0,6844 г вещества на 100 г воды, замерзает при ( ‑ 0,0374 °С). Вычислите температуру замерзания раствора 1,5876 г сахара в 125 г воды. 4. Какую массу сульфата натрия необходимо растворить в 1300 г воды, чтобы полученный раствор не замерзал при температуре ( – 4,1 ºС). Криоскопическая константа воды 1,86 К·кг/моль, кажущаяся степень диссоциации сульфата натрия равна 0,9 или 90 %. 5. Температура кипения раствора, содержащего 4,388 г NaCl в 1000 г воды, равна 100,074 °С. Вычислить кажущуюся степень диссоциации соли в растворе. 6. Давление пара воды над раствором, содержащим 66,9 г Ca(NО3)2 в 1000 г воды, при 100°С равно 746,9 мм. рт. ст. Вычислить кажущуюся степень диссоциации соли в растворе.
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Составными частями раствора являются растворенное вещество (формула 27) и растворитель, масса раствора представляет собой массу этих двух компонентов (формула 28). Массовую долю растворенного вещества в растворе можно рассчитать по формуле (26), молярную концентрацию – по формуле (29), молярную концентрацию эквивалентов – по формуле (30), моляльность – по формуле (31), мольную долю – по формуле (32). В соответствии с текстом задачи применяют любую из этих формул. Пример 1. Найти массовую долю (
Решение. 1) для расчета массовой доли растворенного вещества воспользуемся формулой (26): где С учетом данных задачи, получаем: 2) для расчета молярной концентрации раствора воспользуемся формулой (29): где С учетом данных задачи, получаем:
3) для расчета молярной концентрации эквивалентов раствора воспользуемся формулой (30):
где
С учетом данных задачи, получаем:
Пример 2. Смешали 15 см3 25%-го раствора *Рассмотрим решение задачи двумя способами.
Решение. В данном случае смешиваются растворы одного и того же вещества, поэтому суммарная масса конечного раствора будет равна массе двух взятых для смешения растворов, а содержание растворенного вещества в конечном растворе – сумме масс растворенного вещества в первом и втором растворах, т.е. условие данной задачи можно представить в виде схемы:
1) метод последовательной подстановки: Для расчета массовой доли растворенного вещества в конечном растворе воспользуемся формулой (26): где масса конечного раствора может быть рассчитана по формуле (28):
с учетом данных задачи:
Þ
с учетом данных задачи:
Þ Таким образом, получаем:
2) метод вывода конечной алгебраической формулы и расчет по ней: Массовую долю растворенного вещества в конечном растворе будем рассчитывать по формуле (26): где
Þ
с учетом данных задачи, получаем:
Пример 3. К 100 см3 96%-го раствора Решение. В данном случае смешиваются раствор серной кислоты и вода, поэтому суммарная масса конечного раствора будет равна сумме их масс; растворенное вещество содержится только в первом растворе, поэтому масса растворенного вещества в конечном растворе будет равна массе растворенного вещества в первоначальном растворе серной кислоты. Составим схему задачи для расчета массовой доли растворенного вещества в конечном растворе:
Для расчета массовой доли растворенного вещества в конечном растворе воспользуемся формулой (26):
с учетом данных задачи:
Þ
с учетом данных задачи:
Þ Таким образом, получаем: 2) Основная формула для рассчета: В данном случае смешиваются раствор серной кислоты и вода, поэтому суммарный объем конечного раствора будет равна сумме объемов исходных растворов; растворенное вещество содержится только в первом растворе, поэтому количество моль эквивалентов растворенного вещества в конечном растворе будет равна количество моль эквивалентов растворенного вещества в первоначальном растворе серной кислоты. Составим схему задачи для расчета молярной концентрации эквивалентов растворенного вещества в конечном растворе:

Запишем формулу для расчета молярной концентрации эквивалентов конечного раствора:
где т.к.
Þ
Следовательно, В результате, получаем:
Пример 4. Для нейтрализации 20 мл 0,1н раствора кислоты потребовалось 8 мл раствора
Решение. Для решения задачи воспользуемся законом эквивалентов, согласно которому для данного взаимодействия можно записать:
С учетом формул (29) и (30) можно записать: 1) т.к
2) В итоге получаем:
Выражаем молярность раствора щелочи:
С учетом данных задачи:
ЗАДАНИЯ ДЛЯ САМОПОДГОТОВКИ 1. Определите массы сахарозы и воды, необходимые для получения 250 г раствора с массовой долей вещества 5 %. 2. Какую массу нитрата калия нужно растворить в. 9 кг воды для получения раствора с массовой долей вещества 8 %? 3. Какую массу воды нужно добавить к 400 г раствора с массовой долей серной кислоты 12 %, чтобы массовая доля вещества в растворе стала равна 25%? 4. При упаривании 200 г раствора с массовой долей NaCl 15 %, масса раствора уменьшилась на 20 %. Какова массовая доля соли в растворе. 5. Сколько (в г) нужно взять каждого из растворов с массовыми долями ZnSО4 5 % и 12 %, чтобы получить 1000 г раствора с массовой долей соли 10 %? 6. Какую массу воды нужно прибавить к 200 см3 раствора с концентрацией Н3РО4 2,8 моль/л (р = 1,14 г/см3), чтобы получить раствор с массовой долей кислоты 14,6 %? 7. Смешали два раствора гидроксида калия: 300 см3 с массовой долей вещества 48,25 % (р = 1,49 г/см3) и 200 см3 раствора с концентрацией 5,08 моль/л (р = 1,22 г/см3). Определить концентрацию и массовую долю КОН в полученном растворе, если его плотность 1,39 г/см3. 8. Какой объем раствора с концентрацией азотной кислоты 0,8 моль/л можно приготовить из 1 л раствора азотной кислоты с массовой долей 30 % (р = 1,18 г/см3)? 9. К 300 г раствора сульфата натрия добавили 20 г NaSО4∙10 H2О, при этом массовая доля вещества в растворе стала 6 %. Какова была массовая доля Na2SО4 в исходном растворе? РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Пример 1. Степень диссоциации уксусной кислоты в 0,125М растворе равна 1,183×10-2. Найти константу диссоциации кислоты и значение рК.
Решение. Для решения воспользуемся формулой (35): Отсюда
Пример 2. Вычислить концентрацию ионов водорода в 0,18М растворе хлорноватистой кислоты
Решение. Для решения задачи воспользуемся формулой (35): Поскольку константа диссоциации данной кислоты очень мала, то для расчета можно значением знаменателя пренебречь, т.е. Отсюда Следовательно,
Пример 3. Вычислить при 100°С давление насыщенного пара воды над раствором, содержащим 5 г гидроксида калия в 180 г воды. Кажущаяся степень диссоциации щелочи равна 0,8.
Решение. В данном случае в качестве растворенного вещества выступает электролит, поэтому для решения задачи необходимо воспользоваться формулой закона Рауля для раствора электролита (37):
где Изотонический коэффициент может быть рассчитан по формуле (36): В данном случае процесс диссоциации гидроксида калия можно записать уравнением Находим изотонический коэффициент:
Понижение давлении пара над раствором ( Þ При 100°С давление насыщенного пара над водой равно 101,33 кПа, т.е. При подстановке данных задачи, получаем:
Находим начальное давление насыщенного пара над раствором:
Пример 4. Концентрация ионов водорода в растворе равна 0,006 моль/л. Определите рН раствора и рОН.
Решение. Для расчета водородного показателя рН воспользуемся формулой (41): Для расчета рОН воспользуемся формулой (45):
ЗАДАНИЯ ДЛЯ САМОПОДГОТОВКИ
1. рН некоторого раствора равна 6. Во сколько раз число ионов 2. Какая масса HCN содержится в 200 мл раствора этой кислоты, имеющего рН=5,07 ( 3. При какой молярной концентрации раствора степень диссоциации азотистой кислоты 4. Сколько воды нужно добавить к 300 мл 0,2М раствора уксусной кислоты 5. В 1л 0,01М раствора уксусной кислоты содержится 6. Вычислить степень диссоциации NaCl в 2М растворе, если осмотическое давление раствора при 0 °С равно 68,1 атм.
2.7. ЭЛЕКТРОЛИЗ. При решении задач этого раздела необходимо пользоваться значениями стандартных электродных потенциалов, которые приведены в приложении 5.
Пример 1. Гальванический элемент состоит из металлического цинка, погруженного в 0,1М раствор нитрата цинка, и металлического олова, погруженного в 0,02М раствор нитрата олова. Вычислить ЭДС элемента, написать уравнения электродных процессов и окислительно-восстановительной реакции, протекающей в данном гальваническом элементе, составить схему элемента. Решение. Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е.
Вычислим электродные потенциалы по уравнению Нернста (48):
С учетом условия задачи, получаем:
В результате расчета, получаем:
В данном случае на цинковом электроде будет протекать процесс окисления, он будет служить анодом: на оловянном электроде будет протекать процесс восстановления, он будет служить катодом: Следовательно,
Уравнение окислительно-восстановительной реакции, характеризующей работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов:
Схема рассматриваемого гальванического элемента имеет следующий вид:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита).
Пример 2. По данным о стандартных электродных потенциалах меди и цинка рассчитайте ЭДС элемента, составленного из полуэлементов:
Решение. Рассчитаем ЭДС по формулам:
Þ Значения табличных электродных потенциалов (таблица 2):
Так как медный полуэлемент более электроположителен, на медной пластине (катод) будет протекать процесс восстановления, и медь будет окислителем; а на цинковой пластине (анод) будет протекать процесс окисления, и цинк будет восстановителем:
Пример 3. Установить, в каком направлении возможно самопроизвольное протекание реакции Решение. Запишем уравнение реакции в ионно-молекулярном форме: Запишем стандартные электродные потенциалы электрохимических систем, участвующих в реакции:
В данном случае
Пример 4. Какая масса меди выделится на катоде при электролизе раствора сульфата меди (II) в течение 1,5 ч, при силе тока 2,5А? Решение. Согласно закону Фарадея (формула 46): где В результате расчета получаем:
Пример 5. Чему равна сила тока при электролизе раствора в течение 1,25 ч, если на катоде выделилось 1,4л водорода (н.у)? Решение. Для решения воспользуемся законом Фарадея (формула 46) В результате расчета получаем:
ЗАДАНИЯ ДЛЯ САМОПОДГОТОВКИ 1. Рассчитайте потенциал железного электрода, погруженного в 0,2 М раствор FeSO4. Как изменится потенциал электрода, если раствор разбавить в 1000 раз? 2. Рассчитайте ЭДС гальванического элемента, состоящего из цинкового и оловянного электродов, погруженных в растворы солей:
3. Запишите продукты следующих реакций. Какие из окислительно-восстановительных реакций могут протекать в водном растворе? Для ответа воспользуйтесь значениями стандартных окислительно-восстановительных потенциалов (приложение 5):
4. При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Какой это металл? 5. При электролизе раствора CuSO4 на аноде выделилось 168 см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. 6. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у.) выделилось при этом на катоде? 7. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора AgNO3. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4 г. Определите расход электричества при этом. 8. Одним из известных способов защиты металлов от коррозии является нанесение на защищаемую поверхность тонкого слоя другого металла. Одним из таких способов является никелирование ‑ покрытие образца тонким слоем никеля с помощью процесса электролиза. Металлический цилиндр радиусом 17 мм и высотой 26 см необходимо покрыть слоем никеля толщиной 100 мкм. Какое время необходимо для проведения электролиза, если выход по току равен 88 %, а плотность никеля составляет 8,9 г/см3? 9. Расставьте коэффициенты в следующих окислительно-восстановительных реакциях:
ПРИЛОЖЕНИЕ
Приложение 1 Названия важнейших кислот и их солей
Приложение 2 ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ И СОЕДИНЕНИЙ В ВОДНЫХ РАСТВОРАХ [1] |
|
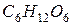 ).
). ,
, – давление пара над чистым растворителем,
– давление пара над чистым растворителем,  – давление пара над раствором данной концентрации,
– давление пара над раствором данной концентрации, 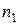 и
и  – число моль растворителя и растворенного вещества, соответственно.
– число моль растворителя и растворенного вещества, соответственно. , то
, то  , где
, где .
. Þ
Þ .
. , следовательно, в 100 г раствора содержится 5г(
, следовательно, в 100 г раствора содержится 5г(  ) растворенного вещества и 95 г (
) растворенного вещества и 95 г (  ) растворителя.
) растворителя.




 и
и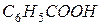 ) в 100 г сероуглерода, кипит при 46,529 °С. Температура кипения сероуглерода 46,3 °С. Вычислите эбуллиоскопическую константу сероуглерода.
) в 100 г сероуглерода, кипит при 46,529 °С. Температура кипения сероуглерода 46,3 °С. Вычислите эбуллиоскопическую константу сероуглерода.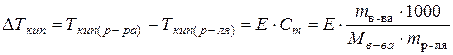

 , где
, где 
 ) в бензоле. Температура кипения бензола 80,2 °С. Эбуллиоскопическая константа (Е) бензола 2,57 °С.
) в бензоле. Температура кипения бензола 80,2 °С. Эбуллиоскопическая константа (Е) бензола 2,57 °С. .
. , следовательно, в 100 г раствора содержится 15г растворенного вещества и 85 г растворителя.
, следовательно, в 100 г раствора содержится 15г растворенного вещества и 85 г растворителя. , где
, где  .
. ) в 450 г воды при 293 К. Плотность раствора считать равной единице.
) в 450 г воды при 293 К. Плотность раствора считать равной единице.
 :
: , т.к.
, т.к.  , то в результате получим
, то в результате получим  )
)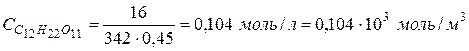 ,
,
 .
. ) и глюкозы (C6H12O6) с одинаковой массовой долей растворенного вещества.
) и глюкозы (C6H12O6) с одинаковой массовой долей растворенного вещества. ), молярную (
), молярную (  ) и молярную концентрацию эквивалентов (
) и молярную концентрацию эквивалентов (  ) 250 г водного раствора, содержащего 25 г хлорида кальция (плотность раствора 1,178 г/см3).
) 250 г водного раствора, содержащего 25 г хлорида кальция (плотность раствора 1,178 г/см3).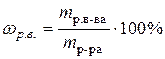 ,
,


 , где
, где  .
. ,
,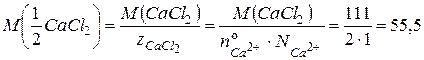 (
(  )
) .
. (плотность 1,18 г/см3) и 100 см3 10%-го раствора
(плотность 1,18 г/см3) и 100 см3 10%-го раствора 
 ,
, ,
, ;
; 
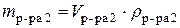 ;
; 


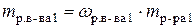 ;
; 
 ;
; 



 или 12,13%
или 12,13%





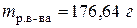

 , т.е. для расчета молярной концентрации эквивалентов конечного раствора необходимо знать количество моль эквивалентов вещества в конечном растворе и объем конечного раствора.
, т.е. для расчета молярной концентрации эквивалентов конечного раствора необходимо знать количество моль эквивалентов вещества в конечном растворе и объем конечного раствора.
 w1=96% =0,96
w1=96% =0,96
 w1=96% =0,96
w1=96% =0,96

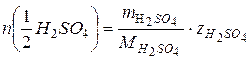 ,
, ,
,  ,
, 

 .
. .
. , какова молярность раствора щелочи.
, какова молярность раствора щелочи. .
.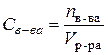 Þ
Þ  ,
, Þ
Þ .
. .
. .
. 
 .
.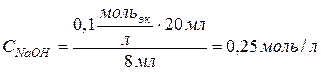
 . Подставим данные задачи:
. Подставим данные задачи:  .
. Þ
Þ  .
. (
(  ).
). .
. Þ
Þ 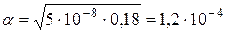 .
.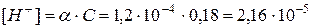 (моль/л).
(моль/л). ,
, – изотонический коэффициент.
– изотонический коэффициент. , где
, где  – степень электролитической диссоциации; n – число ионов, на которые распалась каждая молекула.
– степень электролитической диссоциации; n – число ионов, на которые распалась каждая молекула. , т.е.
, т.е. 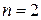 .
.
 ) вычисляем по уравнению
) вычисляем по уравнению 
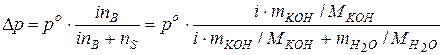 .
.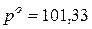 кПа.
кПа. кПа.
кПа. Þ
Þ  кПа.
кПа. Þ
Þ  .
. Þ
Þ  Þ
Þ  .
. в этом растворе больше числа ионов
в этом растворе больше числа ионов  ?
? )?
)? (
( 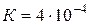 ) будет равна 0,25?
) будет равна 0,25?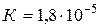 , чтобы степень диссоциации удвоилась?
, чтобы степень диссоциации удвоилась? ее молекул и ионов. Определить степень диссоциации уксусной кислоты.
ее молекул и ионов. Определить степень диссоциации уксусной кислоты.
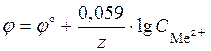
 ; где
; где  (В)
(В)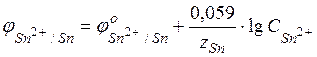 ; где
; где  (В)
(В) (В)
(В) (В)
(В) >
>  , следовательно,
, следовательно,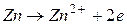 ;
;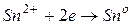 .
. Þ
Þ  (В)
(В)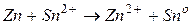
 ÷
÷ 
 ÷÷
÷÷  ,
, 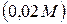 ÷
÷  .
. ÷
÷  ÷÷
÷÷ 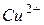 ,
,  ÷
÷  .
. , где
, где  .
.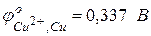 ,
, 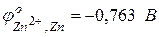

 ;
;  .
. .
.
 ,
,  ,
, ,
, 
 >
>  , следовательно, окислителем будет служить хлор, а восстановителем – ион
, следовательно, окислителем будет служить хлор, а восстановителем – ион  . Рассматриваемая реакция будет протекать справа налево.
. Рассматриваемая реакция будет протекать справа налево. ,
, , т.к. на катоде протекает процесс
, т.к. на катоде протекает процесс 
 (г)
(г) Þ
Þ  , где экв. объем водорода
, где экв. объем водорода  (л/мольэк)
(л/мольэк) (А)
(А)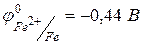
 ,
, 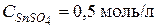 .
.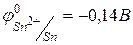 ,
,  .
.