|
|
Цепной механизм химической реакцииСодержание [убрать] · 1Классификация o 1.11.По наличию границы раздела фаз все химические реакции подразделяются на гомогенные и гетерогенные o 1.22.По изменению степеней окисления реагентов o 1.33.По тепловому эффекту реакции o 1.44.По типу превращений реагирующих частиц · 2Применение · 3См. также · 4Примечания · 5Литература · 6Ссылки Классификация[править | править вики-текст] Существует большое количество признаков, по которым можно классифицировать химические реакции. 1.По наличию границы раздела фаз все химические реакции подразделяются на гомогенные и гетерогенные[править | править вики-текст] Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. В многостадийной химической реакции некоторые стадии могут быть гомогенными, а другие — гетерогенными. Такие реакции называются гомогенно-гетерогенными[1]. В зависимости числа фаз, которые образуют исходные вещества и продукты реакции, химические процессы могут быть гомофазными (исходные вещества и продукты находятся в пределах одной фазы) и гетерофазными (исходные вещества и продукты образуют несколько фаз). Гомо- и гетерофазность реакции не связана с тем, является ли реакция гомо- или гетерогенной[2]. Поэтому можно выделить четыре типа процессов: · Гомогенные реакции (гомофазные). В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация раствора кислоты раствором щёлочи:
· Гетерогенные гомофазные реакции. Компоненты находятся в пределах одной фазы, однако реакция протекает на границе раздела фаз, например, на поверхности катализатора. Примером может быть гидрирование этилена на никелевом катализаторе:
· Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах нескольких фаз, однако реакция протекает в одной фазе. Так может проходить окисление углеводородов в жидкой фазе газообразным кислородом. · Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:
2.По изменению степеней окисления реагентов[править | править вики-текст] В данном случае различают · Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции конпропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления. Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
Пример реакции конпропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
Не относятся к окислительно-восстановительным реакции, в которых не происходит изменения степеней окисления атомов, например:
3.По тепловому эффекту реакции[править | править вики-текст] Все химические реакции сопровождаются выделением или поглощением энергии. При разрыве химических связей в реагентах выделяется энергия, которая в основном идёт на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить: · экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) например, указанное выше горение водорода · эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды. Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0) наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение. 4.По типу превращений реагирующих частиц[править | править вики-текст] · соединения: · разложения: · замещения: · обмена (в т.ч. тип реакции-нейтрализация): Химические реакции всегда сопровождаются физическими эффектами: поглощением или выделением энергии, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций. Реакция соединения-химическая реакция, в результате которой из двух или большего числа исходных веществ образуется только одно новое.В такие реакции могут вступать как простые, так и сложные вещества. Реакция разложения-химическая реакция, в результате которой из одного вещества образуется несколько новых веществ. В реакции данного типа вступают только сложные соединения, а их продуктами могут быть как сложные, так и простые вещества Реакция замещения-химическая реакция,в результате которой атомы одного элемента, входящие в состав простого вещества, замещают атомы другого элемента в его сложном соединении. Как следует из определения, в таких реакциях одно из исходных веществ должно быть простым, а другое сложным. Реакции обмена- реакция, в результате которой два сложных вещества обмениваются своими составными частями 5.По признаку направления протекания химические реакции делятся на необратимые и обратимые Необратимыми называют химические реакции, протекающие лишь в одном направлении("слева направо"), в результате чего исходные вещества превращаются в продукты реакции. О таких химических процессах говорят, что они протекают "до конца".К ним относят реакции горения, а также реакции, сопровождающиеся образованием малорастворимых или газообразных веществ Обратимыминазываются химические реакции, протекающие одновременно в двух противоположных направлениях("слева направо" и "справа налево").В уравнениях таких реакций знак равенства заменяется двумя противоположно направленными стрелками.Среди двух одновременно протекающих реакций различают прямую(протекает "слева направо") и обратную(протекает "справа налево").Поскольку в ходе обратимой реакции исходные вещества одновременно и расходуются и образуются, они не полностью превращаются в продукты реакции.Поэтому об обратимых реакциях говорят, что они протекают "не до конца". В результате всегда образуется смесь исходных веществ и продуктов взаимодействия. 6. По признаку участия катализаторов химические реакции делятся на каталитические и некаталитические Каталитическими называют реакции, протекающие в присутствии катализаторов.В уравнениях таких реакций химическую формулу катализатора указывают над знаком равенства или обратимости, иногда вместе с обозначением условий протекания(температура t, давление p).К реакциям данного типа относятся многие реакции разложения и соединения. Некаталитическими называются многие реакции, протекающие в отсутствие катализаторов.Это, например, реакции обмена и замещения. Применение[править | править вики-текст] С помощью химических реакций можно получать практически любые вещества, которые в природе находятся в ограниченных количествах, например, азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле. См. также[править | править вики-текст] · Химическая кинетика Примечания[править | править вики-текст] 1. ↑ Эмануэль, Кнорре. Курс химической кинетики, 1984, с. 50. 2. ↑ Эмануэль, Кнорре. Курс химической кинетики, 1984, с. 51. Литература[править | править вики-текст] · Эмануэль Н. М., Кнорре Д. Г. Курс химической кинетики. — 4-е изд., переработанное и дополненное. — М.: Высшая школа, 1984. — 463 с. · Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989. · Басоло Ф., Пирсон Р. Механизмы неорганических реакций. — М.: Мир, 1971. — 591 с. · Воронин А. И., Ошеров В. И., Динамика молекулярных реакций. М.: Наука, 1990. — 421с. · Воробьев А. Х., Лекции по теории элементарного акта химических реакций в конденсированной фазе. МГУ, 2000. · Ганкин В. Ю., Ганкин Ю. В., Как образуется химическая связь и протекают химические реакции. М.: Граница, 2007.-319 с. · Никитин Е. Е., Теория элементарных атомно-молекулярных процессов в газах. М., Химия, 1970. · Салем Л. Электроны в химических реакциях. М.: Мир, 1985. 299 c. · Тоуб М. Механизмы неорганических реакций. — М.: Мир, 1975. — 275 с. · Глесстон С., Лейдлер К., Эйринг Г. Теория абсолютных скоростей реакций. М.: ГИИЛ, 1948. — 584 с. · Уманский С. Я. Теория элементарных химических реакций. Интеллект, 2009. — 408с. · Степанов Н. Ф. «Сложный мир элементарных актов химических реакций» Соросовский образовательный журнал, 1996, № 11, с. 30-36. · Степанов Н. Ф. «Потенциальные поверхности и химические реакции» Соросовский образовательный журнал, 1996, № 10, с. 33-41.\
ТЕОРИЯ ХИМИЧЕСКИХ РЕАКЦИЙ В ходе развития теории химических реакций возникли следующие основные вопросы: 1. Почему не все термодинамически возможные реакции могут быть осуществлены? 2. Почему скорость химической реакции с увеличением температуры возрастает по экспоненте? 3. Почему в реакциях, протекающих с разрывом связей, дополнительная энергия (энергия активации) обычно намного меньше энергии, необходимой для термического разрушения связи? 4. Наконец, почему реакции протекают с разрушением химических связей при комнатной температуре, тогда как для термического разрушения этих связей молекулы нужно нагреть до 4,000° C и более?
Примерами таких реакций могут служить взаимодействие радикалов и ионов с молекулами, каталитические и фотохимические реакции. Данный вопрос не был затронут вплоть до начала наших работ. Цепной механизм химической реакции
AB + CD → AC + BD, а, в основном, механизм химической реакции - цепной: AB ⇄ A + B A + CD → AC + D D + AB → DB + A где A, B и D - активные частицы (радикалы, ионы, координационно-ненасыщенные соединения). То есть, в отличие от идеологии, принятой в XX веке, активные элементы (частицы, вызывающие химические преобразования) в химических реакциях -это не частицы или молекулы с высокой кинетической энергией. Активные элементы - это особые химические частицы (радикалы, ионы, координационно-ненасыщенные соединения и т.д.), у которых количество электронов меньше, чем у ближайшего к ним инертного газа. 12 |
|

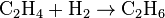




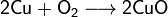
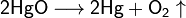
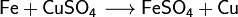
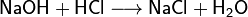
 В наших исследованиях мы выяснили, что, в отличие от мнения, господствовавшего до конца XX века, взаимодействие молекул протекает не по схеме:
В наших исследованиях мы выяснили, что, в отличие от мнения, господствовавшего до конца XX века, взаимодействие молекул протекает не по схеме: