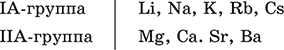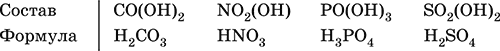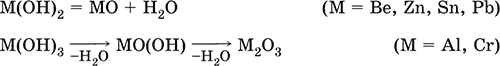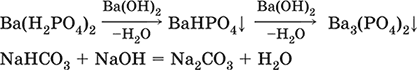|
|
Классификация и взаимосвязь неорганических веществ
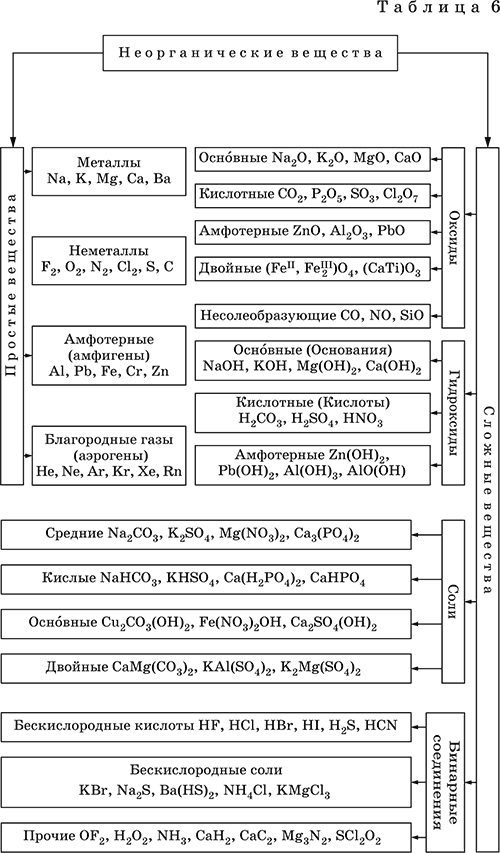
Классификация неорганических веществ базируется на химическом составе – наиболее простой и постоянной во времени характеристике. Химический состав вещества показывает, какие элементы присутствуют в нем и в каком числовом отношении для их атомов. Элементы условно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионов многоэлементных веществ (металлические свойства), вторые – в состав анионов (неметаллические свойства). В соответствии с Периодическим законом в периодах и группах между этими элементами находятся амфотерные элементы, проявляющие одновременно в той или иной мере металлические и неметаллические (амфотерные, двойственные) свойства. Элементы VIIIA‑группы продолжают рассматривать отдельно (благородные газы), хотя для Kr, Хе и Rn обнаружены явно неметаллические свойства (элементы Не, Ne, Ar химически инертны). Классификация простых и сложных неорганических веществ приведена в табл. 6. Ниже приводятся определения (дефиниции) классов неорганических веществ, их важнейшие химические свойства и способы получения. Неорганические вещества – соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:
Простые вещества образованы атомами одного элемента. Делятся по химическим свойствам:
Металлы – простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):
Простые вещества элементов Cu, Ag и Ni также относят к металлам, так как у их оксидов CuO, Ag2O, NiO и гидроксидов Cu(OH)2, Ni(OH)2 преобладают основные свойства. Неметаллы – простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы: F2, Cl2, Br2, I2, O2, S, N2, Р, С, Si. Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами. Амфигены – амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены: Be, Cr, Zn, Аl, Sn, Pb. Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа. Аэрогены – благородные газы, одноатомные простые вещества элементов VIIIA‑группы: Не, Ne, Ar, Kr, Xe, Rn. Из них He, Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr, Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицательностью. Сложные вещества образованы атомами разных элементов. Делятся по составу и химическим свойствам:
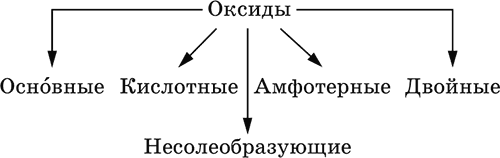
Оксиды – соединения элементов с кислородом, степень окисления кислорода в оксидах всегда равна (‑II). Делятся по составу и химическим свойствам:
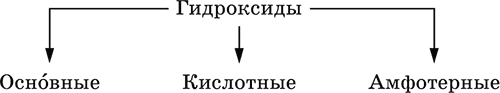
Элементы He, Ne и Ar соединений с кислородом не образуют. Соединения элементов с кислородом в других степенях окисления – это не оксиды, а бинарные соединения, например O+IIF2‑I и H2+IO2‑I. Не относятся к оксидам и смешанные бинарные соединения, например S+IVCl2‑IO‑II. Оснóвные оксиды – продукты полной дегидратации (реальной или условной) основных гидроксидов, сохраняют химические свойства последних. Из типичных металлов только Li, Mg, Ca и Sr образуют оксиды Li2O, MgO, СаО и SrO при сжигании на воздухе; оксиды Na2O, К2O, Rb2O, Cs2O и ВаО получают другими способами. Оксиды CuO, Ag2O и NiO также относят к основным. Кислотные оксиды – продукты полной дегидратации (реальной или условной) кислотных гидроксидов, сохраняют химические свойства последних. Из типичных неметаллов только S, Se, Р, As, С и Si образуют оксиды SO2, SeO2, Р2O5, As2O3, СO2 и SiO2 при сжигании на воздухе; оксиды Cl2O, Cl2O7, I2O5, SO3, SeO3, N2O3, N2O5 и As2O5 получают другими способами. Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными, так как NO2 и ClO2 реагируют со щелочами, образуя соли двух кислот, а ClO2 и с водой, образуя две кислоты: а) 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O б) 2ClO2 + Н2O (хол.) = НClO2 + НClO3 2ClO2 + 2NaOH (хол.) = NaClO2 + NaClO3 + H2O Оксиды CrO3 и Mn2O7 (хром и марганец в высшей степени окисления) также являются кислотными. Амфотерные оксиды – продукты полной дегидратации (реальной или условной) амфотерных гидроксидов, сохраняют химические свойства амфотерных гидроксидов. Типичные амфигены (кроме Ga) при сжигании на воздухе образуют оксиды BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО; амфотерные оксиды Ga2O3, SnO и РЬO2 получают другими способами. Двойные оксиды образованы либо атомами одного амфотерного элемента в разных степенях окисления, либо атомами двух разных (металлических, амфотерных) элементов, что и определяет их химические свойства. Примеры: (FeIIFe2III)O4, (Рb2IIPbIV)O4, (MgAl2)O4, (CaTi)O3. Оксид железа образуется при сгорании железа на воздухе, оксид свинца – при слабом нагревании свинца в кислороде; оксиды двух разных металлов получают другими способами. Несолеобразующие оксиды – оксиды неметаллов, не имеющие кислотных гидроксидов и не вступающие в реакции солеобразования (отличие от основных, кислотных и амфотерных оксидов), например: СО, NO, N2O, SiO, S2O. Гидроксиды – соединения элементов (кроме фтора и кислорода) с гидроксогруппами О‑IIН, могут содержать также кислород O‑II. В гидроксидах степень окисления элемента всегда положительная (от +I до +VIII). Число гидроксогрупп от 1 до 6. Делятся по химическим свойствам:
Оснóвные гидроксиды (основания) образованы элементами с металлическими свойствами. Получаются по реакциям соответствующих основных оксидов с водой: М2O + Н2O = 2МОН (М = Li, Na, К, Rb, Cs) МО + Н2O = М(ОН)2 (М = Са, Sr, Ва) Исключение: гидроксиды Mg(OH)2, Cu(OH)2 и Ni(OH)2 получают другими способами. При нагревании реальная дегидратация (потеря воды) протекает для следующих гидроксидов: 2LiOH = Li2O + Н2O М(ОН)2 = МО + Н2O (М = Mg, Са, Sr, Ва, Cu, Ni) Основные гидроксиды замещают свои гидроксогруппы на кислотные остатки с образованием солей, металлические элементы сохраняют свою степень окисления в катионах солей. Хорошо растворимые в воде основные гидроксиды (NaOH, КОН, Са(ОН)2, Ва(ОН)2 и др.) называют щелочами, так как именно с их помощью в растворе создается щелочная среда. Кислотные гидроксиды (кислоты) образованы элементами с неметаллическими свойствами. Примеры:
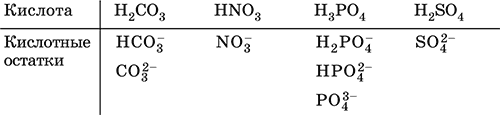
При диссоциации в разбавленном водном растворе образуются катионы Н+ (точнее, Н3O+) и следующие анионы, или кислотные остатки:
Кислоты можно получить по реакциям соответствующих кислотных оксидов с водой (ниже приведены реально протекающие реакции): Cl2O + H2O = 2HClO Е2O3 + Н2O = 2НЕO2 (Е = N, As) As2O3 + 3H2O = 2H3AsO3 EO2 + H2O = H2EO3 (Е = С, Se) E2O5 + H2O = 2HEO3 (Е = N, Р, I) E2O5 + 3H2O = 2H3EO4 (E = P, As) EO3 + H2O = H2EO4 (E = S, Se, Cr) E2O7 + H2O = 2HEO4 (E = Cl, Mn) Исключение: оксиду SO2 в качестве кислотного гидроксида соответствует полигидрат SO2 nН2O («сернистая кислота H2SO3» не существует, но кислотные остатки HSO3‑ и SO32‑ присутствуют в солях). При нагревании некоторых кислот протекает реальная дегидратация и образуются соответствующие кислотные оксиды: 2HAsO2 = As2O3 + H2O H2EO3 = EO2 + H2O (E = C, Si, Ge, Se) 2HIO3 = I2O5 + H2O 2H3AsO4 = As2O5 + H2O H2SeO4 = SeO3 + H2O При замене (реальной и формальной) водорода кислот на металлы и амфигены образуются соли, кислотные остатки сохраняют в солях свой состав и заряд. Кислоты H2SO4 и Н3РO4 в разбавленном водном растворе реагируют с металлами и амфигенами, стоящими в ряду напряжений левее водорода, при этом образуются соответствующие соли и выделяется водород (кислота HNO3 в такие реакции не вступает; ниже типичные металлы, кроме Mg, не указаны, так как они реагируют в подобных условиях с водой): М + H2SO4(pasб.) = MSO4 + Н2↑ (М = Be, Mg, Cr, Mn, Zn, Fe, Ni) 2M + 3H2SO4(paзб.) = M2(SO4)3 + 3H2↑ (M = Al, Ga) 3M + 2Н3РO4(разб.) = M3(PO4)2↓ + 3H2↑ (M = Mg, Fe, Zn) В отличие от бескислородных кислот кислотные гидроксиды называют кислородсодержащими кислотами или оксокислотами. Амфотерные гидроксиды образованы элементами с амфотерными свойствами. Типичные амфотерные гидроксиды: Be(OH)2 Sn(OH)2 Al(OH)3 AlO(OH) Zn(OH)2 Pb(OH)2 Cr(OH)3 CrO(OH) He образуются из амфотерных оксидов и воды, но подвергаются реальной дегидратации и образуют амфотерные оксиды:
Исключение: для железа(III) известен только метагидроксид FeO(OH), «гидроксид железа(III) Fe(OH)3» не существует (не получен). Амфотерные гидроксиды проявляют свойства основных и кислотных гидроксидов; образуют два вида солей, в которых амфотерный элемент входит в состав либо катионов солей, либо их анионов. Для элементов, имеющих несколько степеней окисления, действует правило: чем выше степень окисления, тем более выражены кислотные свойства гидроксидов (и/или соответствующих оксидов).
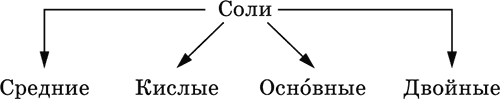
Соли – соединения, состоящие из катионов основных или амфотерных (в роли основных) гидроксидов и анионов (остатков) кислотных или амфотерных (в роли кислотных) гидроксидов. В отличие от бескислородных солей, соли, рассматриваемые здесь, называются кислородсодержащими солями или оксосолями. Делятся по составу катионов и анионов:
Средние соли содержат средние кислотные остатки СО32‑, NO3‑, РО43‑, SO42‑ и др.; например: К2СO3, Mg(NO3)2, Cr2(SO4)3, Zn3(PO4)2. Если средние соли получают по реакциям с участием гидроксидов, то реагенты берут в эквивалентных количествах. Например, соль К2СO3 можно получить, если взять реагенты в соотношениях: 2КОН и 1Н2СO3, 1К2O и 1Н2СO3, 2КОН и 1СO2. Реакции образования средних солей:
1)
Основание + Кислота → Соль + Вода
1а) основный гидроксид + кислотный гидроксид →… 2NaOH + H2SO4 = Na2SO4 + 2Н2O Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O 1б) амфотерный гидроксид + кислотный гидроксид →… 2Al(ОН)3 + 3H2SO4 = Al2(SO4)3 + 6Н2O Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2Н2O 1в) основный гидроксид + амфотерный гидроксид →… NaOH + Al(ОН)3 = NaAlO2 + 2Н2O (в расплаве) 2NaOH + Zn(OH)2 = Na2ZnO2 + 2Н2O (в расплаве) 2)
Основной оксид + Кислота = Соль + Вода
2а) основный оксид + кислотный гидроксид →… Na2O + H2SO4 = Na2SO4 + Н2O CuO + 2HNO3 = Cu(NO3)2 + H2O 2б) амфотерный оксид + кислотный гидроксид →… Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O ZnO + 2HNO3 = Zn(NO3)2 + H2O 2в) основный оксид + амфотерный гидроксид →… Na2O + 2Al(ОН)3 = 2NaAlO2 + ЗН2O (в расплаве) Na2O + Zn(OH)2 = Na2ZnO2 + Н2O (в расплаве) 3)
Основание + Кислотный оксид → Соль + Вода
За) основный гидроксид + кислотный оксид →… 2NaOH + SO3 = Na2SO4 + Н2O Ва(ОН)2 + СO2 = ВаСO3 + Н2O 3б) амфотерный гидроксид + кислотный оксид →… 2Al(ОН)3 + 3SO3 = Al2(SO4)3 + 3H2O Zn(OH)2 + N2O5 = Zn(NO3)2 + H2O Зв) основный гидроксид + амфотерный оксид →… 2NaOH + Al2O3 = 2NaAlO2 + Н2O (в расплаве) 2NaOH + ZnO = Na2ZnO2 + Н2O (в расплаве) 4)
Основной оксид + Кислотный оксид → Соль
4а) основный оксид + кислотный оксид →… Na2O + SO3 = Na2SO4, BaO + СO2 = ВаСO3 4б) амфотерный оксид + кислотный оксид →… Al2O3 + 3SO3 = Al2(SO4)3, ZnO + N2O5 = Zn(NO3)2 4в) основный оксид + амфотерный оксид →… Na2O + Al2O3 = 2NaAlO2, Na2O + ZnO = Na2ZnO2 Реакции 1в, если они протекают в растворе, сопровождаются образованием других продуктов – комплексных солей: NaOH (конц.) + Al(OН)3 = Na[Al(OH)4] КОН (конц.) + Cr(OH)3 = К3[Cr(ОН)6] 2NaOH (конц.) + M(OH)2 = Na2[M(OH)4] (М = Be, Zn) КОН (конц.) + M(OH)2 = K[M(OH)3] (М = Sn, Pb) Все средние соли в растворе – сильные электролиты (диссоциируют нацело). Кислые соли содержат кислые кислотные остатки (с водородом) HCO3‑, Н2РO42‑, HPO42‑ и др., образуются при действии на основные и амфотерные гидроксиды или средние соли избытка кислотных гидроксидов, содержащих не менее двух атомов водорода в молекуле; аналогично действуют соответствующие кислотные оксиды: NaOH + H2SO4 (конц.) = NaHSO4 + H2O Ва(ОН)2 + 2Н3РO4 (конц.) = Ва(Н2РO4)2 + 2Н2O Zn(OH)2 + Н3РO4 (конц.) = ZnHPO4↓ + 2Н2O PbSO4 + H2SO4 (конц.) = Pb(HSO4)2 K2HPO4 + Н3РO4 (конц.) = 2КН2РO4 Са(ОН)2 + 2ЕO2 = Са(НЕO3)2 (Е = С, S) Na2EO3 + ЕO2 + H2O = 2NaHEO3 (Е = С, S) При добавлении гидроксида соответствующего металла или амфигена кислые соли переводятся в средние: NaHSO4 + NaOH = Na2SO4 + Н2O Pb(HSO4)2 + Pb(OH)2 = 2PbSO4↓ + 2H2O
Почти все кислые соли хорошо растворимы в воде, диссоциируют нацело (КНСO3 = К+ + HCO3‑). Оснóвные соли содержат гидроксогруппы ОН, рассматриваемые как отдельные анионы, например FeNO3(OH), Ca2SO4(OH)2, Cu2CO3(OH)2, образуются при действии на кислотные гидроксиды избытка основного гидроксида, содержащего не менее двух гидроксогрупп в формульной единице: Со(ОН)2 + HNO3 = CoNO3(OH)↓ + Н2O 2Ni(OH)2 + H2SO4 = Ni2SO4(OH)2↓ + 2H2O 2Cu(OH)2 + H2CO3 = Cu2CO3(OH)2↓ + 2H2O Основные соли, образованные сильными кислотами, при добавлении соответствующего кислотного гидроксида переходят в средние: CoNO3(OH) + HNO3 = Co(NO3)2 + Н2O Ni2SO4(OH)2 + H2SO4 = 2NiSO4 + 2H2O Большинство основных солей малорастворимы в воде; они осаждаются при совместном гидролизе, если образованы слабыми кислотами: 2MgCl2 + Н2O + 2Na2CO3 = Mg2CO3(OH)2↓ + СO2↑ + 4NaCl Двойные соли содержат два химически разных катиона; например: CaMg(CO3)2, KAl(SO4)2, Fe(NH4)2(SO4)2, LiAl(SiO3)2. Многие двойные соли образуются (в виде кристаллогидратов) при совместной кристаллизации соответствующих средних солей из насыщенного раствора: K2SO4 + MgSO4 + 6Н2O = K2Mg(SO4)2 6Н2O↓ Часто двойные соли менее растворимы в воде по сравнению с отдельными средними солями. Бинарные соединения – это сложные вещества, не относящиеся к классам оксидов, гидроксидов и солей и состоящие из катионов и бескислородных анионов (реальных или условных). Их химические свойства разнообразны и рассматриваются в неорганической химии отдельно для неметаллов разных групп Периодической системы; в этом случае классификация проводится по виду аниона. Примеры: а) галогениды: OF2, HF, KBr, PbI2, NH4Cl, BrF3, IF7 б) хальгогениды: H2S, Na2S, ZnS, As2S3, NH4HS, K2Se, NiSe в) нитриды: NH3, NH3 H2O, Li3N, Mg3N2, AlN, Si3N4 г) карбиды: CH4, Be2C, Al4C3, Na2C2, CaC2, Fe3C, SiC д) силициды: Li4Si, Mg2Si, ThSi2 е) гидриды: LiH, CaH2, AlH3, SiH4 ж) пероксидьг. H2O2, Na2O2, СаO2 з) надпероксиды: HO2, КO2, Ва(O2)2 По типу химической связи среди этих бинарных соединений различают: ковалентные: OF2, IF7, H2S, P2S5, NH3, H2O2 ионные: Nal, K2Se, Mg3N2, CaC2, Na2O2, KO2 Встречаются двойные (с двумя разными катионами) и смешанные (с двумя разными анионами) бинарные соединения, например: KMgCl3, (FeCu)S2 и Pb(Cl)F, Bi(Cl)O, SCl2O2, As(O)F3. Все ионные комплексные соли (кроме гидроксокомплексных) также относятся к этому классу сложных веществ (хотя обычно рассматриваются отдельно), например: [Cu(NH3)4]SO4 K4[Fe(CN)6] Na3[AlF6] [Ag(NH3)2]Cl K3[Fe(NCS)6] K2[SiF6] К бинарным соединениям относятся ковалентные комплексные соединения без внешней сферы, например [Fe(CO)5] и [№(СО)4]. По аналогии со взаимосвязью гидроксидов и солей из всех бинарных соединений выделяют бескислородные кислоты и соли (остальные соединения классифицируют как прочие). Бескислородные кислоты содержат (как и оксокислоты) подвижный водород Н+ и поэтому проявляют некоторые химические свойства кислотных гидроксидов (диссоциация в воде, участие в реакциях солеобразования в роли кислоты). Распространенные бескислородные кислоты – это HF, НCl, HBr, HI, HCN и H2S, из них HF, HCN и H2S – слабые кислоты, а остальные – сильные. Примеры реакций солеобразования: 2HBr + ZnO = ZnBr2 + Н2O 2H2S + Ва(ОН)2 = Ba(HS)2 + 2Н2O 2HI + Pb(OH)2 = Pbl2↓ + 2Н2O Металлы и амфигены, стоящие в ряду напряжений левее водорода и не реагирующие с водой, вступают во взаимодействие с сильными кислотами НCl, НВr и HI (в общем виде НГ) в разбавленном растворе и вытесняют из них водород (приведены реально протекающие реакции): М + 2НГ = МГ2 + Н2↑ (М = Be, Mg, Zn, Cr, Mn, Fe, Co, Ni) 2M + 6НГ = 2МГ3 + H2↑ (M = Al, Ga) Бескислородные соли образованы катионами металлов и амфигенов (а также катионом аммония NH4+) и анионами (остатками) бескислородных кислот; примеры: AgF, NaCl, KBr, PbI2, Na2S, Ba(HS)2, NaCN, NH4Cl. Проявляют некоторые химические свойства оксосолей. Общий способ получения бескислородных солей с одноэлементными анионами – взаимодействие металлов и амфигенов с неметаллами F2, Cl2, Br2 и I2 (в общем виде Г2) и серой S (приведены реально протекающие реакции): 2М + Г2 = 2МГ (М = Li, Na, К, Rb, Cs, Ag) M + Г2 = МГ2 (М = Be, Mg, Са, Sr, Ва, Zn, Mn, Со) 2М + ЗГ2 = 2МГ3 (М = Al, Ga, Cr) 2М + S = M2S (М = Li, Na, К, Rb, Cs, Ag) M + S = MS (M = Be, Mg, Ca, Sr, Ba, Zn, Mn, Fe, Co, Ni) 2M + 3S = M2S3 (M = Al, Ga, Cr) Исключения: а) Cu и Ni реагируют только с галогенами Cl2 и Br2 (продукты МCl2, МBr2) б) Cr и Mn реагируют с Cl2, Br2 и I2 (продукты CrCl3, CrBr3, CrI3 и MnCl2, MnBr2, MnI2) в) Fe реагирует с F2 и Cl2 (продукты FeF3, FeCl3), с Br2 (смесь FeBr3 и FeBr2), с I2 (продукт FeI2) г) Cu при реакции с S образует смесь продуктов Cu2S и CuS Прочие бинарные соединения – все вещества этого класса, кроме выделенных в отдельные подклассы бескислородных кислот и солей. Способы получения бинарных соединений этого подкласса разнообразны, самый простой – взаимодействие простых веществ (приведены реально протекающие реакции): а) галогениды: S + 3F2 = SF6, N2 + 3F2 = 2NF3 2P + 5Г2 = 2РГ5 (Г = F, CI, Br) С + 2F2 = CF4 Si + 2Г2 = Sir4 (Г = F, CI, Br, I) б) халькогениды: 2As + 3S = As2S3 2E + 5S = E2S5 (E = P, As) E + 2S = ES2 (E = C, Si) в) нитриды: 3H2 + N2 2NH3 6M + N2 = 2M3N (M = Li, Na, K) 3M + N2 = M3N2 (M = Be, Mg, Ca) 2Al + N2 = 2AlN 3Si + 2N2 = Si3N4 г) карбиды: 2M + 2C = M2C2 (M = Li, Na) 2Be + С = Be2C M + 2C = MC2 (M = Ca, Sr, Ba) 4Al + 3C = Al4C3 Si + С = SiC д) силициды: 4Li + Si = Li4Si 2M + Si = M2Si (M = Mg, Ca) е) гидриды: 2M + H2 = 2MH (M = Li, Na, K) M + H2 = MH2 (M = Mg, Ca) ж) пероксиды, надпероксиды: 2Na + O2 = Na2O2 (сгорание на воздухе) M + O2 = МО2 (М = К, Rb, Cs; сгорание на воздухе) Многие из этих веществ полностью реагируют с водой (чаще гидролизуются без изменения степеней окисления элементов, но гидриды выступают как восстановители, а надпероксиды вступают в реакции дисмутации): РCl5 + 4Н2O = Н3РO4 + 5НCl SiBr4 + 2Н2O = SiO2↓ + 4НBr P2S5 + 8Н2O = 2Н3РO4 + 5H2S↑ SiS2 + 2Н2O = SiO2↓ + 2H2S Mg3N2 + 8H2O = 3Mg(OH)2↓ + 2(NH3 H2O) Na3N + 4H2O = 3NaOH + NH3 H2O Be2C + 4H2O = 2Be(OH)2↓ + CH4↑ MC2 + 2H2O = M(OH)2 + C2H2↑ (M = Ca, Sr, Ba) Al4C3 + 12H2O = 4Al(OH)3↓ + 3CH4↑ MH + H2O = MOH + H2↑ (M = Li, Na, K) MgH2 + 2H2O = Mg(OH)2↓ + H2↑ CaH2 + 2H2O = Ca(OH)2 + H2↑ Na2O2 + 2H2O = 2NaOH + H2O2 2MO2 + 2H2O = 2MOH + H2O2 + O2↑ (M = K, Rb, Cs) Другие вещества, наоборот, устойчивы по отношению к воде, среди них SF6, NF3, CF4, CS2, AlN, Si3N4, SiC, Li4Si, Mg2Si и Ca2Si.
|
|