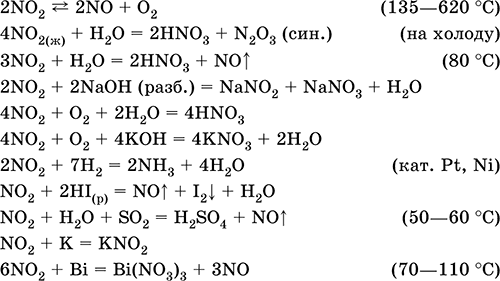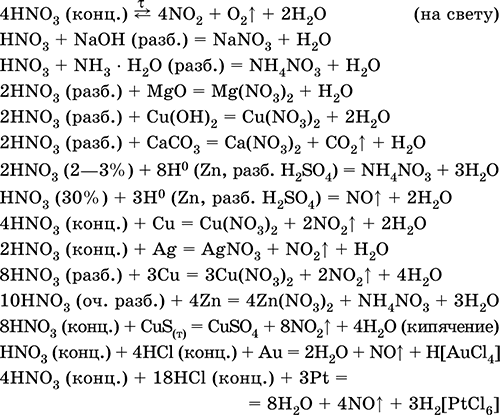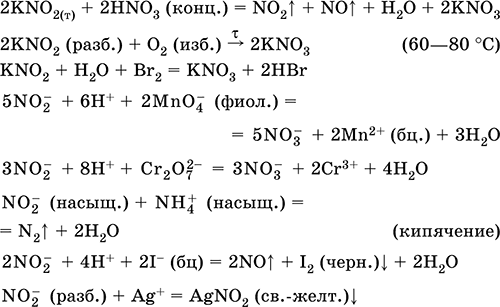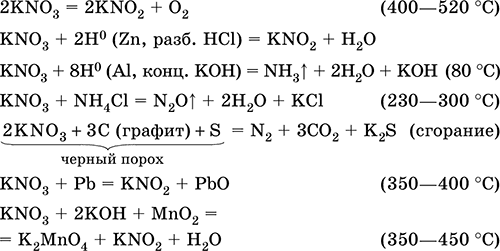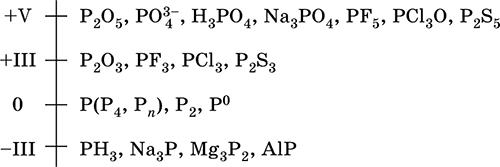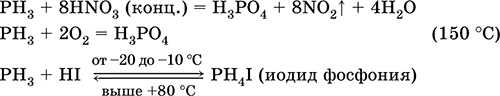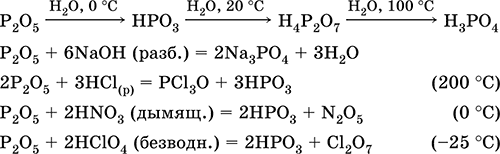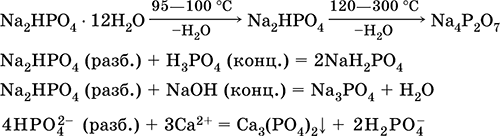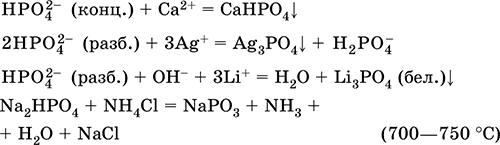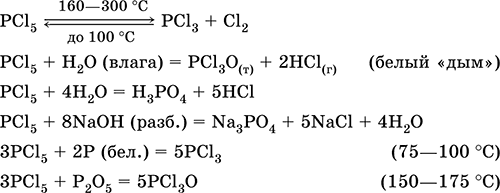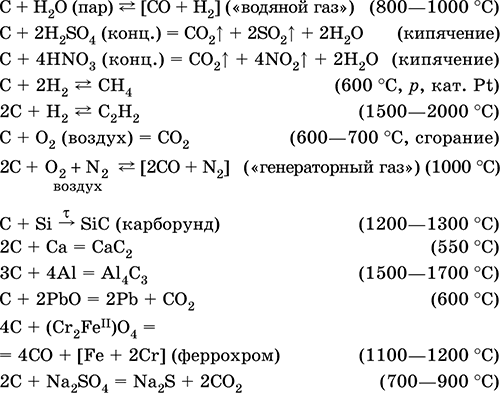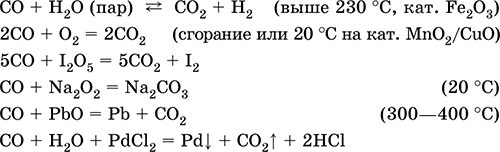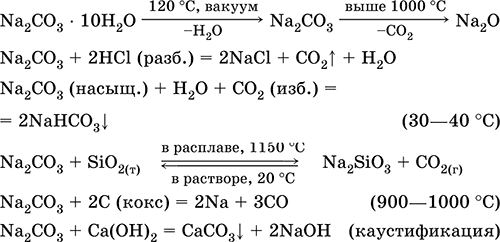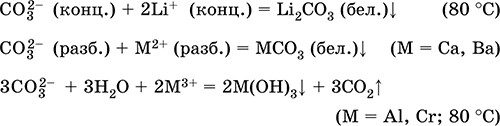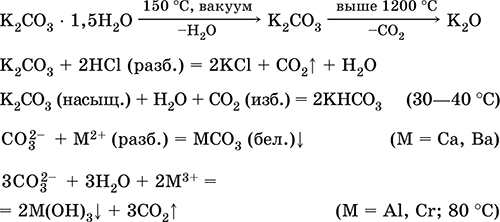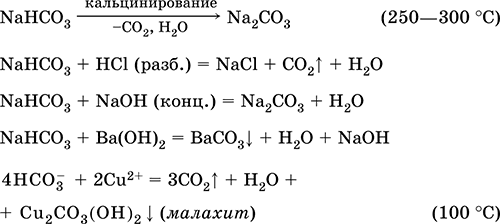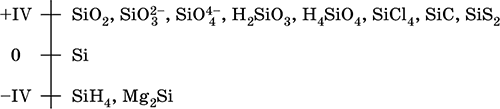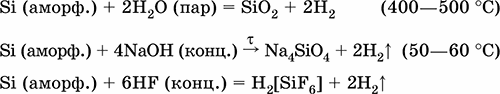|
|
Оксиды азота. Азотная кислота
Монооксид азота NO. Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную σπ‑связь ( N=O), в твердом состоянии димер N2O2 со связью N – N. Чрезвычайно термически устойчив. Чувствителен к кислороду воздуха (буреет). Мало растворим в воде и не реагирует с ней. Химически пассивен по отношению к кислотам и щелочам. При нагревании реагирует с металлами и неметаллами. Весьма реакционноспособна смесь NO и NO2 («нитрозные газы»). Промежуточный продукт в синтезе азотной кислоты. Уравнения важнейших реакций: 2NO + O2 (изб.) = 2NO2 (20 °C) 2NO + С (графит) = N2 + СO2 (400–500 °C) lONO + 4Р (красн.) = 5N2 + 2Р2O5 (150–200 °C) 2NO + 4Cu = N2 + 2Cu2O (500–600 °C) Реакции смеси NO и NO2: NO + NO2 + Н2O = 2HNO2(p) NO + NO2 + 2KOH (разб.) = 2KNO2 + H2O NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (450–500 °C) Получение: в промышленности – окисление аммиака (см.) кислородом на катализаторе, в лаборатории – взаимодействие разбавленной азотной кислоты с восстановителями: 8HNO3 (хол.) + 6Hg = 3Hg2(NO3)2 + 2NO↑ + 4Н2O или восстановление нитритов: 2NaNO2 + 2H2SO4 (разб.) + 2NaI = 2NO↑ + I2↓ + 2H2O + 2Na2SO4 Диоксид азота NO2. Кислотный оксид, условно отвечает двум кислотам – HNO2 и HNO3 (кислота для NIV не существует). Бурый газ, при комнатной температуре мономер NO2, на холоду жидкий бесцветный димер N2O4 (тетраоксид диазота). Молекула NO2 – радикал со строением незавершенного треугольника [‑N(O)2] (sр2‑гибридизация) с ковалентными σ, π‑связями N=O. Молекула N2O4 содержит очень длинную связь N – N (175 пм), которая легко разрывается при температуре выше комнатной (в интервале 20,7–135,0 °C). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Усиливает химическую активность NO (см.). Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит. Уравнения важнейших реакций:
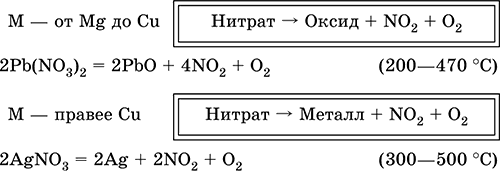
Получение: в промышленности – окисление NO (см.) кислородом воздуха, в лаборатории – взаимодействие концентрированной азотной кислоты с восстановителями: 6HNO3 (конц., гор.) + S = H2SO4 + 6NO2↑ + 2Н2O 5HNO3 (конц., гор.) + Р (красн.) = Н3РO4 + 5NO2↑ + Н2O 2HNO3 (конц., гор.) + SO2 = H2SO4 + 2NO2↑ Оксид диазота N2O. Бесцветный газ с приятным запахом («веселящий газ»), N=N=O, формальная степень окисления азота +I, плохо растворим в воде. Поддерживает горение графита и магния: 2N2O + С = СO2 + 2N2 (450 °C) N2O + Mg = N2 + MgO (500 °C) Получают термическим разложением нитрата аммония: NH4NO3 = N2O + 2Н2O (195–245 °C) Применяется в медицине как анестезирующее средство. Триоксид диазота N2O3.При низких температурах – синяя жидкость, ON=NO2, формальная степень окисления азота +III. При 20 °C на 90 % разлагается на смесь бесцветного NO и бурого NO2 («нитрозные газы», промышленный дым – «лисий хвост»). N2O3 – кислотный оксид, на холоду с водой образует HNO2, при нагревании реагирует иначе: 3N2O3 + Н2O = 2HNO3 + 4NO↑ Со щелочами дает соли HNO2, например NaNO2. Получают взаимодействием NO с O2 (4NO + 3O2 = 2N2O3) или с NO2 (NO + NO2 = N2O3) при сильном охлаждении. «Нитрозные газы» ядовиты и экологически опасны, действуют как катализаторы разрушения озонового слоя атмосферы. Пентаоксид диазота N2O5. Бесцветное твердое вещество, O2N – О–NO2, степень окисления азота +V. При комнатной температуре за 10 ч разлагается на NO2 и O2. Реагирует с водой и щелочами как кислотный оксид: N2O5 + Н2O = 2HNO3 N2O5 + 2NaOH = 2NaNO3 + H2O Получают дегидратацией дымящей азотной кислоты: 2HNO3 + Р2O5 = N2O5 + 2НРO3 или окислением NO2 озоном при ‑78 °C: 2NO2 + O3 = N2O5 + O2 Азотная кислота HNO3. Оксокислота. Бесцветная жидкость. Молекула имеет искаженно‑треугольное строение [N(O)2(OH)] (sp2– гибридизация), содержит ковалентные σπ‑связи N=O и о‑связь N – ОН. Разлагается при стоянии на свету (желтеет). Хорошо растворяет оксиды азота (красно‑бурая «дымящая» кислота, плотность 1,56 г/мл). Неограниченно смешивается с водой, перегоняется при обычных условиях в виде азеотропной смеси (массовая доля кислоты 68,4 %, плотность 1,41 г/мл, температура кипения 120,7 °C), образует гидрат HNO3 Н2O (точнее, H3NO4 – ортоазотная кислота). Сильная кислота в растворе, ион NO3‑ имеет строение правильного треугольника (sр2‑гибридизация). Нейтрализуется щелочами и гидратом аммиака. Реагирует с основными и амфотерными оксидами и гидроксидами, вытесняет слабые кислоты из их солей. Сильный окислитель в концентрированном растворе (за счет Nv). Образует смесь продуктов восстановления азота – от NIVO2 до N‑IIIН4+, в зависимости от концентрации кислоты и силы восстановителя в этой смеси преобладают разные продукты (условно для концентрированной кислоты указывают NO2, для разбавленной – NO, для очень разбавленной – NH4+). Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Ni и Pb, не реагирует с Au и Pt. Смесь HNO3 (конц.) и НCl (конц.) – «царская водка» – обладает еще более сильным окислительным действием: переводит в раствор золото и платину. Нитрующим началом HNO3 в ее реакциях с органическими веществами является ион NO2+ (нитроил). В отличие от самой кислоты HNO3 ее соли – нитраты проявляют сильные окислительные свойства только при сплавлении за счет выделяющегося кислорода. При нагревании нитраты разлагаются по‑разному, в зависимости от положения металла в ряду напряжений:
Применяется азотная кислота для производства минеральных удобрений, взрывчатых веществ, нитратов металлов, органических нитропроизводных, искусственных волокон и пластмасс, красителей, лекарственных препаратов. Уравнения важнейших реакций:
Получение: промышленный синтез состоит из следующих этапов: N2 + Н2 → NH3 → NO → NO2 → HNO3 → HNO3, а именно: производство аммиака (см.), каталитическое окисление аммиака (см.) до NO, перевод NO (см.) в NO2, поглощение смеси NO2 и O2 водой (см.).
Нитриты. Нитраты
Нитрит калия KNO2. Оксосоль. Белый, гигроскопичный. Плавится без разложения. Устойчив в сухом воздухе. Очень хорошо растворим в воде (образуется бесцветный раствор), гидролизуется по аниону. Типичный окислитель и восстановитель в кислотной среде, очень медленно реагирует в щелочной среде. Вступает в реакции ионного обмена. Качественные реакции на ион NO2‑ – обесцвечивание фиолетового раствора MnO4 и появление черного осадка при добавлении ионов I‑. Применяется в производстве красителей, как аналитический реагент на аминокислоты и иодиды, компонент фотографических реактивов. Уравнения важнейших реакций:
Получение в промышленности – восстановлением калийной селитры в процессах: KNO3 + Pb = KNO2 + PbO (350–400 °C) KNO3 (конц.) + Pb (губка) + Н2O = KNO2 + Pb(OH)2↓ 2KNO3 + СаО + SO2 = 2KNO2 + CaSO4 (300 °C) Нитрат калия KNO3. Оксосоль. Техническое название калийная, или индийская, селитра. Белый, плавится без разложения, при дальнейшем нагревании разлагается. Устойчив на воздухе. Хорошо растворим в воде (с высоким эндо‑эффектом, Q = ‑36 кДж), гидролиза нет. Сильный окислитель при сплавлении (за счет выделения атомарного кислорода). В растворе восстанавливается только атомарным водородом (в кислотной среде до KNO2, в щелочной среде до NH3). Применяется в производстве стекла, как консервант пищевых продуктов, компонент пиротехнических смесей и минеральных удобрений. Уравнения важнейших реакций:
Получение: в промышленности 4KOH (гор.) + 4NO2 + O2 = 4KNO3 + 2Н2O и в лаборатории: КCl + AgNO3 = KNO3 + AgCl↓
Фосфор
Фосфор – элемент 3‑го периода и VA‑группы Периодической системы, порядковый номер 15. Электронная формула атома [10Ne]3s23p3, устойчивая степень окисления в соединениях +V. Шкала степеней окисления фосфора:
Электроотрицательность фосфора (2,32) значительно ниже, чем у типичных неметаллов, и немного выше, чем у водорода. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде. В природе – тринадцатый по химической распространенности элемент (шестой среди неметаллов), встречается только в химически связанном виде. Жизненно важный элемент. Недостаток фосфора в почве восполняется введением фосфорных удобрений – главным образом суперфосфатов. Красный и белый фосфор Р. Известно несколько аллотропных форм фосфора в свободном виде, главные – это белый фосфор Р4 и красный фосфор Рn. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.). Красный фосфор состоит из полимерных молекул Рn разной длины. Аморфный, при комнатной температуре медленно переходит в белый фосфор. При нагревании до 416 °C возгоняется (при охлаждении пара конденсируется белый фосфор). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. На воздухе загорается только при нагревании. Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек. Не ядовит. Белый фосфор состоит из молекул Р4. Мягкий как воск (режется ножом). Плавится и кипит без разложения (tпл 44,14 °C, tкип 287,3 °C, ρ 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), при большой массе возможно самовоспламенение. В особых условиях переводится в красный фосфор. Хорошо растворим в бензоле, эфирах, сероуглероде. Не реагирует с водой, хранится под слоем воды. Чрезвычайно химически активен. Проявляет окислительно‑восстановительные свойства. Восстанавливает благородные металлы из растворов их солей. Применяется в производстве Н3РO4 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит. Уравнения важнейших реакций:
Получение в промышленности – восстановление фосфорита раскаленным коксом (песок добавляют для связывания кальция): Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2Р + 5СО (1000 °C) Пар фосфора охлаждают и получают твердый белый фосфор. Красный фосфор готовят из белого фосфора (см. выше), в зависимости от условий степень полимеризации n (Рn) может быть различной. Фосфин РН3. Бинарное соединение, степень окисления фосфора равна – III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3‑гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH3). Сильный восстановитель, сгорает на воздухе, окисляется в HNO3 (конц.). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит. Уравнения важнейших реакций:
Получение в лаборатории: Са3Р2 + 6НCl (разб.) = ЗСаCl2 + 2РН3↑ Оксид фосфора (V) Р2O5. Кислотный оксид. Белый, термически устойчивый. В твердом и газообразном состояниях димер Р4О10 со строением из четырех тетраэдров [O=Р(O)3], связанных по трем вершинам (Р – О–Р). При очень высоких температурах мономеризуется до Р2O5. Существует также стеклообразный полимер (Р2O5)n. Чрезвычайно гигроскопичен, энергично реагирует с водой, щелочами. Восстанавливается белым фосфором. Отнимает воду у кислородсодержащих кислот. Применяется как весьма эффективный дегидратирующий агент для осушения твердых веществ, жидкостей и газовых смесей, реагент в производстве фосфатных стекол, катализатор полимеризации алкенов. Ядовит. Уравнения важнейших реакций:
Получение: сжигание фосфора (см.) в избытке сухого воздуха. Ортофосфорная кислота Н3РO4. Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия Р2O5 с водой. Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3‑гибридизация), содержит ковалентные σ‑связи Р – ОН и σ, π‑связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н2O). Слабая кислота в растворе, нейтрализуется щелочами, не полностью – гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена. Качественная реакция – выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали. Уравнения важнейших реакций:
Получение в промышленности: кипячение фосфоритной руды в серной кислоте: Са3(РO4)2 + 3H2SO4 (конц.) = 2Н3РO4 + 3CaSO4↓ Ортофосфат натрия Na3PO4. Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием. Вступает в реакции ионного обмена. Качественная реакция на ион РO43‑ – образование желтого осадка ортофосфата серебра (I). Применяется для устранения «постоянной» жесткости пресной воды, как компонент моющих средств и фотопроявителей, реагент в синтезе каучука. Уравнения важнейших реакций: Na3PO4 12Н2O = Na3PO4 + 12Н2O (200 °C, вакуум) 2РО43‑ (конц.) + 8Н2O + 2Al = 2[Al(ОН)4]‑ + 2НРО42‑ + ЗН2↑ 2РО43‑ (конц.) + 4Н2O + Zn = [Zn(OH)4]2‑ + 2HPO42‑ + Н2↑ 2РО43‑ (разб.) + ЗСа2+ = Са3(РO4)2↓ РО43‑ (разб.) + 3Ag+ = Ag3PO4↓ (желт.)↓ Получение: полная нейтрализация Н3РO4 (см.) гидроксидом натрия или по реакции: 2Н3РO4 + 3Na2CO3 = 2Na3PO4 + 3CO2↑ + 3H2O Гидроортофосфат натрия Na2HPO4. Кислая оксосоль. Белый, при умеренном нагревании разлагается без плавления. Хорошо растворим в воде, гидролизуется по аниону. Реагирует с Н3РO4 (конц.), нейтрализуется щелочами. Вступает в реакции ионного обмена. Качественная реакция на ион НРО42‑ – образование желтого осадка ортофосфата серебра (I). Применяется как эмульгатор при сгущении коровьего молока, компонент пищевых пастеризаторов и фотоотбеливателей. Уравнения важнейших реакций:
Получение: неполная нейтрализация Н3РO4 гидроксидом натрия в разбавленном растворе: 2NaOH + Н3РO4 = Na2HPO4 + 2Н2O Дигидроортофосфат натрия NaH2PO4. Кислая оксосоль. Белый, гигроскопичный. При умеренном нагревании разлагается без плавления. Хорошо растворим в воде, анион Н2РO4 подвергается обратимой диссоциации. Нейтрализуется щелочами. Вступает в реакции ионного обмена. Качественная реакция на ион Н2РO4 – образование желтого осадка ортофосфата серебра(I). Применяется в производстве стекла, для защиты стали и чугуна от коррозии, как умягчитель воды. Уравнения важнейших реакций:
Получение: неполная нейтрализация Н3РO4 едким натром: Н3РO4 (конц.) + NaOH (разб.) = NaH2PO4 + Н2O Ортофосфат кальция Са3(РO4)2. Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.). Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок – как компонент зубных паст и стабилизатор полимеров. Уравнения важнейших реакций: Са3(РO4)2 + 2H2SO4 (60 %) = Са(Н2РO4)2↓ + 2CaSO4↓ (до 50 °C) Са3(РO4)2 + 4Н3РO4 (40 %) = ЗСа(Н2РO4)2↓ (примесь СаНРO4) Са3(РO4)2 + 5С + 3SiO2 = 3CaSiO3 + 2Р + 5СО (1000 °C) Смесь Са(Н2РO4)2 и CaSO4 называется простым суперфосфатом, Са(Н2РO4)2 с примесью СаНРO4 – двойным суперфосфатом, они легко усваиваются растениями при подкормке. Наиболее ценные удобрения – аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4. Хлорид фосфора (V) РCl5. Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sр3d‑гибридизация). В твердом состоянии димер Р2Cl10 с ионным строением РCl4+[РCl6]‑. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором. Применяется как хлорагент в органическом синтезе. Ядовит. Уравнения важнейших реакций:
Получение: хлорирование фосфора.
7.5. Неметаллы IVA‑группы
Углерод в свободном виде
Углерод – элемент 2‑го периода и IVA‑группы Периодической системы, порядковый номер 6. Химия углерода – это в основном химия органических соединений; неорганических производных углерода не так много. Электронная формула атома [3He]2s22p2, характерные степени окисления 0, ‑IV, +II и +IV, состояние CIV считается устойчивым. Шкала степеней окисления углерода:
Углерод имеет среднюю для неметаллов электроотрицательность (2,50), проявляет неметаллические (кислотные) свойства. Неорганические углеродсодержащие вещества – оксиды, угольная кислота и ее соли, бинарные соединения; органические вещества – практически неограниченное число соединений с водородом (углеводороды) и их производных, содержащих различные по длине цепи и циклы атомов углерода. В природе – одиннадцатый по химической распространенности элемент (четвертый среди неметаллов). Встречается в самородном состоянии (алмаз, графит) и в виде соединений. Жизненно важный элемент для всех организмов. Аллотропные формы углерода С. В свободном виде углерод существует в виде четырех аллотропных модификаций: графит, алмаз, карбин и фуллерен. Г р а ф и т – устойчивая аллотропная форма существования элемента. Серо‑черный, с металлическим блеском, жирный на ощупь, мягкий, обладает электропроводимостью. Кристаллическая решетка состоит из слоев правильных шестиугольных колец, конденсированных по всем сторонам за счет оя‑связей (вр2‑гибридизация). Реагирует с водяным паром, кислотами‑окислителями. Типичный восстановитель при сплавлении, реагирует с кислородом, оксидами металлов и солями. Восстанавливается водородом и металлами. Для графита характерно образование множества карбидов – солеобразных (СаС2, Al4С3), ковалентных (карборунд SiC), металлоподобных (имеющих нестехиометрический состав, например цементит Fe3C). Солеобразные карбиды полностью гидролизуются в воде. Применяется как конструкционный материал, основа угольных электродов, замедлитель нейтронов в ядерных реакторах, кокс – восстановитель в металлургии и химической технологии, сажа – наполнитель резины. Алмаз содержит в узлах кристаллической решетки атомы С с тетраэдрическим окружением (sр3‑гибридизация, р 3,52 г/см3). Благородный камень, имеет наибольшую твердость среди природных веществ. Химическая активность ниже, чем у графита. Выше 1200 °C переходит в графит. В чистом состоянии алмазы – прозрачные бесцветные кристаллы с сильным преломляющим эффектом. После обработки природных алмазов (огранка, шлифовка) получают ювелирные драгоценные камни – бриллианты. Менее чистые алмазы обычно окрашенные и мутные, например серо‑голубой и черный (карбонадо). В промышленности из графита при 2000 °C под очень высоким давлением получают мелкие кристаллы искусственных алмазов. Применяются они для изготовления режущих инструментов и точных измерительных приборов. Карбин состоит из линейных макромолекул (С2)n со строением –C≡C– или =C=C= (sр‑гибридизация, ρ 3,27 г/см3). Химически менее активен, чем графит. При 2300 °C переходит в графит. Прозрачен и бесцветен, полупроводник. Широкого применения не имеет, очень редко встречается в природе. Фуллерен состоит из молекул C60 или C70 (полые сферы; sр2‑гибридизация, ρ 1,7 г/см3, температура плавления 500–600 °C для С60), термически устойчив до 900– 1000 °C. Темноокрашенный порошок, растворим в гексане (темно‑красный раствор для С60 темно‑оранжевый для С70), полупроводник. Химические свойства изучены мало. Получают фуллерен, испаряя графит в атмосфере гелия при пониженном давлении. Обнаружен в природе. Возможное использование в будущем – основа сверхпроводящих материалов. Ниже рассматриваются свойства графита как самой распространенной и химически активной формы углерода. Уравнения важнейших реакций:
Получение: искусственные формы графита – кокс и сажа образуются при пиролизе каменного угля и углеводородов.
Оксиды углерода
Монооксид углерода СО. Несолеобразующий оксид. Бесцветный газ, без запаха, легче воздуха. Молекула слабополярна, содержит ковалентную тройную σππ‑связь [:C≡O;], изоэлектронна молекуле N2. Термически устойчив. Малорастворим в воде и не реагирует с ней. Химически пассивен в обычных условиях, не реагирует с кислотами и щелочами. Сильный восстановитель при высокой температуре и при наличии катализаторов. Вступает в реакции присоединения с кислородом и пероксидом натрия. С переходными металлами образует комплексные соединения без внешней сферы (карбонилы). Количественно реагирует с I2O5. Качественная реакция – помутнение раствора хлорида палладия(II). Применяется как реагент в органическом синтезе, промышленно важный восстановитель металлов из их руд. Чрезвычайно ядовит, загрязняет атмосферу городов (продукт неполного сгорания моторного топлива). По тому же механизму, что и кислород, СО присоединяется к атому железа в гемоглобине крови, причем связывается более прочно и тем самым блокирует перенос кислорода в организме, вызывая сильное отравление и остановку дыхания; отсюда тривиальное название СО – угарный газ. Уравнения важнейших реакций:
Получение в промышленности: сжигание кокса (см.) при недостатке кислорода, восстановление раскаленным коксом углекислого газа и водяного пара:
Диоксид углерода СO2. Кислотный оксид. Техническое название – углекислый газ. Бесцветный газ, без запаха, в 1,5 раза тяжелее воздуха (можно «переливать» из сосуда в сосуд). Молекула неполярна, имеет линейное строение [С(O)2] (sр‑гибридизация), содержит ковалентные σπ‑связи С=O. Термически устойчив до температуры красного каления. При сжатии (давление = 50 атм) и охлаждении легко переходит в жидкое и твердое («сухой лед») состояния. Твердый СO2 возгоняется уже при низких температурах. Мало растворим в воде (O,88 л/1 л Н2O при 20 °C); образует моногидрат, который медленно изомеризуется (на 0,4 %) в угольную кислоту. Реагирует со щелочами. Восстанавливается магнием и кальцием. Из воздуха удаляется при контакте с пероксидом натрия (одновременно регенерируется кислород). Простейшая качественная реакция – угасание горящей древесной лучинки в атмосфере СO2. Применяется в многотоннажных производствах соды, сахара и карбамида, в пищевой промышленности для газирования безалкогольных напитков и как хладагент. Содержится в воздухе (0,03 % по объему), воде минеральных источников. Не поддерживает горение и дыхание. Ассимилируется зелеными растениями при фотосинтезе (с помощью хлорофилла и под воздействием солнечных лучей). Ядовит при содержании в воздухе свыше 15 % по объему. Уравнения важнейших реакций:
Получение в промышленности – при полном сгорании кокса (см.) или при обжиге известняка: СаСO3 = СаО + СO2 (900–1200 °C) в лаборатории – при обработке карбонатов (например, кусочков мрамора СаСO3) сильными кислотами: СаСO3(т) + H2SO4 = CaSO4↓ + Н2O + CO2↑
Карбонаты
Карбонат натрия Na2CO3. Оксосоль. Техническое название кальцинированная сода. Белый, при нагревании плавится и разлагается. Чувствителен к влаге и углекислому газу в воздухе. Образует декагидрат (кристаллическая сода). Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Восстанавливается коксом. Вступает в реакции ионного обмена. Качественная реакция на ион СО32‑ – образование белого осадка карбоната бария, разлагаемого сильными кислотами (НCl, HNO3) с выделением углекислого газа. Применяется для синтеза соединений натрия, устранения «постоянной» жесткости пресной воды, в производстве стекла, мыла и других моющих средств, целлюлозы, минеральных красок, эмалей. В природе содержится в грунтовых рассолах, рапе соляных озер. Уравнения важнейших реакций:
Получение в промышленности (способ Сольве, 1861–1863): а) через насыщенный раствор NaCl пропускают смесь NH3 и СO2: NaCl + NH3 + Н2O + СO2 = NH4Cl + NaHCO3↓ (в этих условиях питьевая сода малорастворима); б) осадок NaHCO3 подвергают обезвоживанию (кальцинированию): 2NaHCO3 = Na2CO3 + Н2O + СO2 Карбонат калия К2СO3. Оксосоль. Техническое название поташ. Белый, гигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Чувствителен к влаге и углекислому газу в воздухе. Очень хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Разлагается сильными кислотами. Вступает в реакции ионного обмена. Применяется в производстве оптического стекла, жидкого мыла, минеральных красок, многих соединений калия, как дегидратирующий агент. Уравнения важнейших реакций:
Получение в промышленности: а) нагревание сульфата калия [природное сырье – минералы каинит KMg(SO4)Cl ЗН2O и шёнит K2Mg(SO4)2 • 6Н2O] с гашёной известью Са(ОН)2 в атмосфере СО (давление = 15 атм): K2SO4 + Са(ОН)2 + 2СО = 2K(HCOO) + CaSO4 б) прокаливание формиата калия К(НСОО) на воздухе: 2K(HCOO) + O2 = К2СO3 + Н2O + СO2 Гидрокарбонат натрия NaHCO3. Кислая оксосоль. Техническое название питьевая сода. Белый рыхлый порошок. При слабом нагревании разлагается без плавления, во влажном состоянии начинает разлагаться при комнатной температуре. Умеренно растворим в воде, гидролизуется по аниону в небольшой степени. Разлагается кислотами, нейтрализуется щелочами. Вступает в реакции ионного обмена. Качественная реакция на ион НСОд – образование белого осадка карбоната бария при действии баритовой воды и разложение осадка сильными кислотами (НCl, HNO3) с выделением углекислого газа. Применяется в пищевой промышленности, как лекарственное средство. Уравнения важнейших реакций:
Получение: насыщение раствора Na2CO3 (см.) углекислым газом. Карбонат кальция СаСO3. Оксосоль. Распространенное природное вещество, главная составная часть осадочной горной породы – известняка (его разновидности – мел, мрамор, известковый туф, мергель), чистый СаСO3 в природе – это минерал кальцит. Белый, при прокаливании разлагается, плавится под избыточным давлением СO2. Нерастворим в воде (= 0,0007 г/100 г Н2O). Реагирует с кислотами, солями аммония в горячем растворе, коксом. Переводится в раствор действием избытка углекислого газа с образованием гидрокарбоната Са(НСO3)2 (существует только в растворе), который определяет «временную» жесткость пресной воды (вместе с солями магния и железа). Устранение жесткости (умягчение воды) проводится кипячением или нейтрализацией гашёной известью. Применяется для производства СаО, СO2, цемента, стекла и минеральных удобрений [в том числе известковой селитры Ca(NO3)2 4Н2O], как наполнитель бумаги и резины, строительный камень (щебень) и компонент бетона и шифера, в виде осажденного порошка – для изготовления школьных мелков, зубных порошков и паст, смесей для побелки помещений. Уравнения важнейших реакций:
Кремний
Кремний – элемент 3‑го периода и IVA‑группы Периодической системы, порядковый номер 14. Электронная формула атома [10Ne]3s23p2. Характерная степень окисления в соединениях +IV. Шкала степеней окисления кремния:
Электроотрицательность кремния невысока для неметаллов (2,25). Проявляет неметаллические (кислотные) свойства; образует оксиды, кремниевые кислоты, очень большое число солей – силикатов в виде цепей, лент и трехмерных сеток тетраэдров [SiO4], бинарные соединения. В настоящее время широко развивается химия органических соединений кремния со связями Si – С и кремнийорганических полимеров – силиконов и силиконовых каучуков со связями Si – Si, Si – О и Si – С. Важнейший элемент неживой природы, второй по химической распространенности. Встречается только в связанном виде. Жизненно важный элемент для многих организмов. Кремний Si. Простое вещество. Крупнокристаллический – темно‑серый, с металлическим блеском, весьма твердый, очень хрупкий, непрозрачный, тугоплавкий, распространенный полупроводник. Кристаллическая решетка – атомная, связи Si – Si очень прочные. Аморфный – белый или желто‑коричневый (с примесями, в основном Fe), химически более активен. Устойчив на воздухе (покрыт прочной оксидной пленкой), не реагирует с водой. Реагирует с HF (конц.), щелочами. Окисляется кислородом, хлором. Восстанавливается магнием. Спекается с графитом. Промышленно важным является сплав с железом – ферросилиций (12–90 % Si). Применяется как легирующая добавка в стали и сплавы цветных металлов, компонент полупроводниковых материалов для микроэлектроники, основа силиконов. Уравнения важнейших реакций:
Получение в промышленности: восстановление SiCl4 или SiO2 при прокаливании: SiCl4 + 2Zn = Si + 2ZnCl2 SiO2 + 2Mg = Si + 2MgO (последняя реакция может быть осуществлена и в лаборатории, после обработки соляной кислотой остается аморфный кремний). Диоксид кремния SiO2. Кислотный оксид. Белый порошок (кварцевый песок) и прозрачные кристаллы, природный продукт окрашен примесями (кремнезём) – в виде обычного песка и камня (кремень). Кристаллическая решетка атомная, каждый атом кремния окружен четырьмя атомами кислорода [Si(O)4], а каждый атом кислорода – двумя атомами кремния [O(Si)2]. Имеет несколько кристаллических модификаций (все минералы), важнейшие – кварц, тридимит и кристобалит, редко встречающиеся и искусственно полученные – китит, коэсит, стишовит, меланофлогит, волокнистый кремнезём. Тугоплавкий, при медленном охлаждении расплава образуется аморфная форма – кварцевое стекло (в природе минерал лешательеит). Наиболее химически активна аморфная форма. Практически не реагирует с водой (из раствора осаждается гидрат SiO2 nН2O), распространенными кислотами. Кварцевое стекло разъедается в HF (конц.). Реагирует со щелочами в растворе (образует ортосиликаты) и при сплавлении (продукты – метасиликаты). Легко хлорируется в присутствии кокса. Восстанавливается коксом, магнием, железом (в доменном процессе). Применяется как промышленное сырье в производстве кремния, обычного, термо– и химически стойкого стекла, фарфора, керамики, абразивов и адсорбентов, наполнитель резины, смазок, клеев и красок, компонент строительных связующих растворов, в виде монокристаллов кварца – основа генераторов ультразвука и точного хода кварцевых часов. Разновидности кварца (горный хрусталь, розовый кварц, аметист, дымчатый кварц, халцедон, оникс и др.) – драгоценные, полудрагоценные или поделочные камни. Уравнения важнейших реакций:
|
|