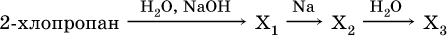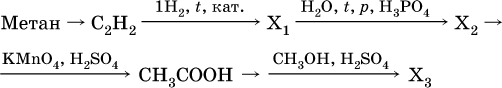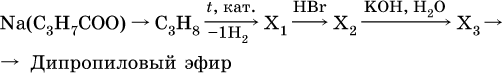|
|
Примеры заданий частей А, В, С
1–2. Класс органических веществ 1. нитросоединения 2. первичные амины содержит функциональную группу 1) – О – NO2 2) – NO2 3) – NH2 4) – NO3‑
3. Водородные связи образуются между молекулами 1) формальдегида 2) пропанола‑1 3) циановодорода 4) этиламина
4. Число структурных изомеров из группы предельных аминов для состава C3H9N равно 1) 1 2) 2 3) 3 4) 4
5. В водном растворе аминокислоты CH3CH(NH2)COOH химическая среда будет 1) кислотной 2) нейтральной 3) щелочной 4) любой
6. Двойственную функцию в реакциях выполняют (по отдельности) все вещества набора 1) глюкоза, этановая кислота, этиленгликоль 2) фруктоза, глицерин, этанол 3) глицин, глюкоза, метановая кислота 4) этилен, пропановая кислота, аланин
7–10. Для реакции в растворе между глицином и 7. гидроксидом натрия 8. метанолом 9. хлороводородом 10. аминоуксусной кислотой продуктами будут 1) соль и вода 2) соль 3) дипептид и вода 4) сложный эфир и вода
11. Соединение, которое реагирует с хлороводородом, образуя соль, вступает в реакции замещения и получается восстановлением продукта нитрования бензола, – это 1) нитробензол 2) метиламин 3) анилин 4) фенол
12. При добавлении лакмуса к бесцветному водному раствору 2‑аминопропановой кислоты раствор окрашивается в цвет: 1) красный 2) желтый 3) синий 4) фиолетовый
13. Для распознавания изомеров со строением СН3–СН2–СН2–NO2 и NH2–СН(СН3) – СООН следует использовать реактив 1) пероксид водорода 2) бромная вода 3) раствор NaHCO3 4) раствор FeCl3
14. При действии концентрированной азотной кислоты на белок появляется… окрашивание: 1) фиолетовое 2) голубое 3) желтое 4) красное
15. Установите соответствие между названием соединения и классом, к которому оно относится
16. Анилин действует в процессах: 1) нейтрализация муравьиной кислотой 2) вытеснение водорода натрием 3) получение фенола 4) замещение с хлорной водой
17. Глицин участвует в реакциях 1) окисления с оксидом меди (II) 2) синтеза дипептида с фенилаланином 3) этерификации бутанолом‑1 4) присоединения метиламина
18–21. Составьте уравнения реакций по схеме 18.
19.
20.
21.
Химические реакции. Скорость, энергетика и обратимость
Скорость реакций
Количественной характеристикой быстроты течения химической реакции А + B → D + E является ее скорость, т. е. скорость взаимодействия частиц реагентов А и В или скорость появления продуктов D и Е. Изучением скорости химических реакций занимается особый раздел химии – химическая кинетика. В гомогенных (однородных) системах исследуется скорость реакции между реагентами, не имеющими границы раздела (газовые реакции, реакции в растворах). В гетерогенных системах изучается скорость реакции на поверхности раздела между реагирующими веществами (например, А – твердое вещество, В – газ или А – твердое вещество, В – вещество в растворе). Для гомогенных систем скорость реакции – это изменение концентраций реагентов или продуктов в единицу времени:
где v – скорость реакции, моль/(л с); Δcреаг = (с'реаг – с"реаг) ― уменьшение концентрации реагентов, моль/л, за промежуток времени Δτ = τ2 – τ1; Δcпрод = (с"прод – с'прод) – увеличение концентрации продуктов, моль/л, за тот же промежуток времени. В начальный момент времени (τ = 0) концентрация реагентов наибольшая, а концентрация продуктов равна нулю. В процессе реакции концентрация реагентов уменьшается, а концентрация продуктов растет. К факторам, влияющим на скорость реакции, относятся природа реагентов, катализатор, температура, концентрация реагентов. 1. Природа реагентов. Здесь большую роль играет характер химических связей в соединениях, строение их молекул. Например, выделение водорода цинком из раствора хлороводорода происходит значительно быстрее, чем из раствора уксусной кислоты, так как полярность связи Н – Cl больше, чем связи О – Н в молекуле СН3СООН; иначе говоря, из‑за того, что НCl – сильный электролит, а СН3СООН – слабый электролит в водном растворе. Чем больше поверхность соприкосновения реагирующих веществ, тем быстрее протекает реакция. Поверхность твердого вещества может быть увеличена путем его измельчения или растворения (если вещество растворимо). Реакции в растворах протекают практически мгновенно. 2. Катализаторы. Большое влияние на скорость реакции оказывают катализаторы – вещества, увеличивающие скорость реакции (часто от нуля до очень больших значений), но не входящие в состав продуктов. Увеличение скорости реакции под влиянием катализаторов называется катализом. Во многих случаях катализаторы образуют с одним из реагирующих веществ промежуточное соединение, которое реагирует с другим исходным веществом, в результате получается продукт и высвобождается катализатор. Иногда употребляют отрицательные катализаторы – ингибиторы, которые, наоборот, замедляют нежелательные химические реакции (например, коррозию металлов). 3. Температура. Для газовых реакций известно, чтопри повышении температуры на десять градусов(ΔТ = 10 К или Δt = 10 °C)скорость реакции возрастает в 2–4 раза (правило Вант‑Гоффа). Для скорости реакции ν2 и ν1 при значениях температуры t2 и t1 имеем:
ν2 = ν1 γ0,1(t2‑t1),
где γ – температурный коэффициент скорости реакции, γ = 2–4. Для реакций в растворах скорость также увеличивается с ростом температуры и часто в той же мере, как и для газовых реакций. При повышении температуры возрастает число активных молекул, т. е. таких молекул, которые в момент столкновения обладают большей энергией и могут образовать продукты. Как показывают исследования, активных молекул в реакционной среде при обычных условиях очень мало. Иначе все реакции между газами протекали бы мгновенно, и в воздухе не было бы, например, свободного кислорода, необходимого для дыхания. Реакции между газами при обычных условиях практически не идут (встречаются исключения, например, при 20 °C полностью протекает реакция 2NO + O2 = 2NO2). 4. Концентрация реагентов. Чтобы произошло взаимодействие, частицы реагирующих веществ в гомогенной среде должны столкнуться. Число столкновений пропорционально числу частиц реагирующих веществ в объеме реактора, т. е. молярным концентрациям этих веществ. Чем большие количества веществ взяты для реакции в данном объеме системы, т. е. чем выше концентрация реагентов, тем больше число столкновений частиц и тем больше скорость реакции. Зависимость скорости реакции от концентрации реагентов распространяется на газовые смеси и растворы. Установлено, что:
|
|