|
|
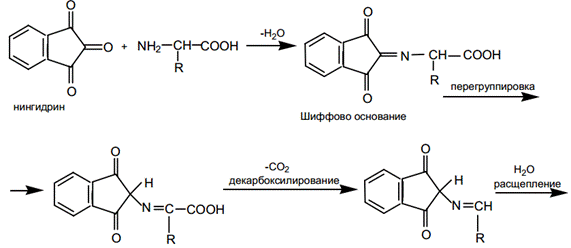
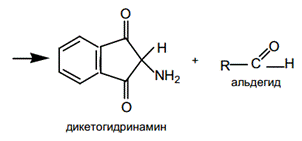
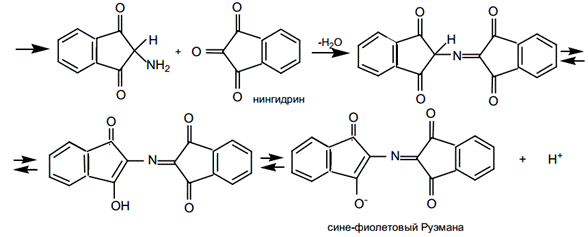
Нингидриновая реакция на свободные альфа аминокислоты.Универсальная реакция на аминокислоты, основана на том, что нингидрин образует с ними соединения с двойной связью между углеродом и азотом, называемые иминами или основаниями Шиффа. Эти соединения обладают высокой реакционной способностью. Дальнейшее превращение их приводит к промежуточному амину, который может реагировать со второй молекулой нингидрина, давая соединение, окрашенное в сине-фиолетовый (пурпурный) цвет – сине-фиолетовый Руэмана. Ход работы: К исследуемым образцам добавить по 5 капель 0,5 % спиртового раствора нингидрина. Пробирки со смесями аккуратно прогреть на пламени и через 2-3 мин зарегистрировать появление окраски.
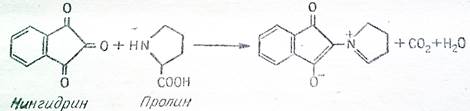
В отличие от большинства α-аминокислот пролин реагирует с нингидрином несколько иначе, пролин сам с нингидрином, вследствие чего развивается ярко-желтая окраска.
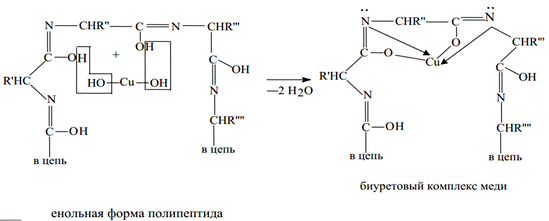
Биуретовая реакция (Пиотровского) на пептидную связь. Основана на образовании в щелочной среде цветного комплекса пептидной связи с ионом Cu2+. Служит универсальным тестом для выявления пептидов и белков в растворах. Так как с ростом количества пептидных связей, интенсивность окраски раствора линейно нарастает, широко применяется для фотометрического определения концентраций белка. Также эта реакция идет с мочевиной Ход работы. В пробирки с 5 каплями исследуемых растворов (белка и аминокислоты) добавить столько же 10 % раствора едкого натра. Хорошо перемешать и добавить по 2 капли 1 % раствора сульфата меди (CuSO4). Пробы перемешать и через несколько минут зарегистрировать развитие окраски.
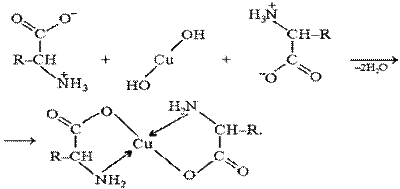
Образование комплексов с металлами аминокислотами α-аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a-аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами. Ход работы. В пробирку наливают 15 капель 5%-го раствора сульфата меди(II), добавляют 1-2 капли 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 5 капель концентрированного раствора аминокислоты.
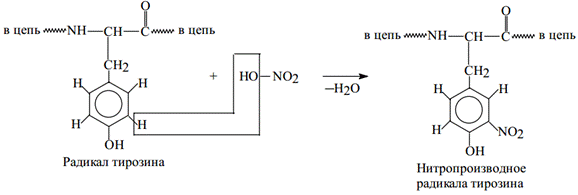
Ксантопротеиновая реакция (Мульдера) на ароматические радикалы. Как уже сказано выше, основана на образовании нитропроизводных аминокислот с ароматическим R: Фен, Тир, Три.
Ход работы: Включив тягу вытяжного шкафа, в пару пробирок с исследуемыми растворами осторожно добавить по нескольку капель концентрированной азотной кислоты (HNO3). Пробирки аккуратно прогреть на пламени, избегая направления горлышек на соседей, и зарегистрировать развитие окраски.
Реакция Щульца-Распайли на триптофан Ход работы: В пробирку налить 5 капель исследуемых раствора белка и аминокислоты, добавить 1-2 капли 10% раствора сахарозы и подслоить равным объемом концентрированной H2SO4. На границе двух жидкостей образуется красно-фиолетовое кольцо (при нагревании на водяной бане реакция идет быстрее - главное не смешивать жидкости). Необходимо следить, чтобы жидкость не перегрелась выше 70°С, так как иначе под влиянием H2SO4 происходит обугливание органического вещества и раствор буреет.
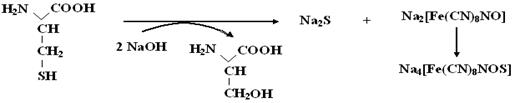
Реакция Фоля на цистеин Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. Обнаружение сульфидов можно проводить несколькими способами: взаимодействием с плюмбатом натрия (PbS – осадок черного цвета) и ниропруссидом (пурпурное окрашивание).
В одну пробирку наливают по 5 капель исследуемых 1%-ных растворов белка и аминокислоты добавляют по 5 капель 30 %-ного раствора NaOH, 5 капель насыщенного раствора (NH4)2SO4 и 1-2 капли 5% раствора нитропруссида натрия.
Реакции осаждения белков Стабильность белковых растворов обусловлена двумя основными факторами: наличием заряда белковой молекулы и, обусловленной зарядом, гидратной оболочки вокруг нее. Устранение этих факторов приводит к осаждению белка из раствора. Реакции осаждения белков делят на две группы: обратимые и необратимые. При необратимых реакциях осаждения белки подвергаются денатурации и, утрачивая свои нативные свойства, теряют способность растворяться в первоначальном растворителе. К этим реакциям относят: осаждение белков кислотами, солями тяжелых металлов, при нагревании и др. При обратимых реакциях осаждения молекулы белка не подвергаются глубоким изменениям (разрушаются четвертичная и до 30 % третичной структуры), сохраняют свои нативные (первоначальные) свойства и полученные осадки можно вновь растворить в первоначальном растворителе. К названным реакциям относят: осаждение белков этанолом и ацетоном при температуре минус 3¸5°С, высаливание (осаждение белков нейтральными солями – NaCl, MgSO4, (NH4)2SO4, Na2SO4) и др. Реакции осаждения применяют для обнаружения белка в растворе, получения безбелковых фильтратов (например, при определении сахаров в молоке или крови), выделения из раствора отдельных групп белков (фракционирования белков). РЕАКТИВЫ. Вода дистиллированная; раствор белка (белок одного куриного яйца отделяют от желтка, разбавляют водой до 250 мл, тщательно перемешивают и фильтруют через двойной слой марли); растворы с массовыми долями: уксусной кислоты 1% и 10 %, гидроксида натрия 10 %, сульфосалициловой кислоты 10 %, трихлоруксусной кислоты (ТХУ) 10 %, сульфата меди 6 %, ацетата свинца 5 %, нитрата серебра 3 %, насыщенный раствор хлорида натрия; концентрированные кислоты: азотная, серная, соляная; этанол 96 %. |
|