|
|
ХИМИЧЕСКОЕ РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХПроизведение растворимости. Условия образования и растворения осадков.В аналитической практике, выполняя операции осаждения или отделения ионов, промывания и растворения осадков, имеют дело с гетерогенными (неоднородными) системами. Примером такой системы может быть насыщенный раствор, соприкасающийся с осадком того или иного вещества. Насыщенный раствор и осадок отделены друг от друга поверхностью раздела и являются фазами гетерогенной системы. Предположим, малорастворимая соль АgCI приведена в соприкосновение с водой. При этом происходит: - процесс растворения: ионы переходят в раствор, что можно выразить условно схемой:
АgCI↓ → Ag+ + CI-
- процесс осаждения: ионы в растворе сталкиваются с поверхностью осадка и осаждаются, что условно можно отразить следующей схемой:
Аg+ + CI- → AgCI↓
Постепенно скорость растворения уменьшается, а скорость осаждения увеличивается, что приводит к состоянию динамического равновесия, при котором число ионов, переходящих в раствор будет равно числу ионов, возвращающихся в осадок. Таким образом, получается насыщенный раствор хлорида серебра, в котором больше не наблюдается ни уменьшения осадка, ни накопления ионов. К насыщенному раствору, как равновесной системе, применим закон действующих масс. Скорость растворения показывает число ионов, уходящих с поверхности осадка за определенное время. Значит, она должна быть прямо пропорциональна числу этих ионов на единице поверхности. В процессе растворения общая поверхность осадка уменьшается, но расположение ионов на ней остается неизменным. Следовательно, можно предположить, что скорость растворения (v1), остается постоянной и равна v1= k1. Скорость осаждения (v2) зависит от числа столкновений ионов с поверхностью осадка. Следовательно, она прямо пропорциональна концентрации ионов в растворе:
v2 = k2 · [Ag+] ∙ [CI-]
В насыщенном растворе скорости растворения и осаждения равны v1= v2. Отсюда k1 = k2 · [Ag+] ∙ [CI-] или [Ag+] ∙ [CI-] = Отношение
ПРAgCI = [Ag+] ∙ [CI-]
Для малорастворимого электролита в общем виде КnAm, диссоциирующего по уравнению
КnAm↔ n Km+ + mAn-,
математическое выражение ПР имеет вид:
где Произведение растворимости является количественной характеристикой способности малорастворимого электролита растворяться и позволяет предвидеть образование (или растворение) осадков при выполнении аналитических реакций. Следует помнить, что осадок малорастворимого электролита образуется только тогда, когда произведение концентраций ионов (так называемое ионное произведение) превысит величину его произведения растворимости (при определенной температуре). ▲ Обучающие задачи Задача №1 Растворимость СаСО3 равна 0,0069 г/л. Вычислить
ПР - ? веществами растворы. Количественно Ѕ характеризуется максимальным количеством вещества, способным растворяться в растворителе при определенной t0С и давлении. Измеряется в моль/л, г/л, г/100г раствора. Найдем молярную концентрацию раствора, зная что М(СаСО3) = 100 г/моль:
СаСО3 ↔ Са2+ + СО32-
[Ca2+] = [CO32-] = Cм (СаСО3)
Ответ:
Задача №2 Вычислить растворимость иодида серебра в моль/л, если ПРАgI = =1,03 ·10-16.
Ѕ - ? АgI ↔ Аg+ + I- х моль х моль х моль ПРАgI =[Ag+] ∙ [I-] = х · х = 1,03·10-16 х · х = 1,03 · 10-16 х2 = 1,03 · 10-16; х = Ответ: ЅAgI = 1,02∙10-8 моль/л. Задача №3 Вычислить растворимость Мn(ОН)2 в моль/л, если
Мn(ОН)2 ↔ Мn2+ + 2ОН- х моль х моль 2х моль
х · (2х)2 = 1,7∙10-13 4х3 = 1,7∙10-13 х3 = 4,25·10-14 3lgх = lg 4,25 + lg 10-14 3lgx = 0,6284 – 14 3lgx = - 13,37 lgx = - 4,46 x = 10-4,46 = 10-5 · 100,54 = 3,467·10-5 моль/л Ответ: Задача №4 Образуется ли осадок при сливании равных объемов раствора AgNO3 с концентрацией 0,0001 моль/л и раствора КСI с концентрацией 0,01 моль/л? ПРAgCI = 1,56·10-10.
С (АgNO3) = 0,0001 моль/л 1) АgNО3 + КСI → AgCI ↓ + KNO3 С (КCI) = 0,01 моль/л 2) ПРAgCI = [Ag+]∙[CI-] = 1,56·10-10 ПРAgCI = 1,56·10-10 3) Найдем концентрации растворов после
↓ - ? С (АgNO3) = С (КCI) = 4) Чтобы узнать, образуется ли осадок, нужно найти ионное произведение [Ag+]∙[CI-] и сравнить его с величиной ПРAgCI: [Ag+] = С (АgNO3) = 5·10-5 моль/л [CI-] = С (КCI) = 5∙10-3 моль/л [Ag+]∙[CI-] = 5·10-5 ∙ 5∙10-3 = 25∙10-8 = 2,5∙10-7 5) Ионное произведение > ПРAgCI, следовательно, осадок образуется. Ответ:осадок образуется. Задача №5 Образуется ли осадок при смешении равных объемов 0,05н раствора Мg(NO3)2 и 0,01н раствора (NH4)2C2O4?
С (Мg(NO3)2) = 0,05н 1) Мg(NO3)2 + (NH4)2C2O4 → MgC2O4↓ + 2NH4NO3
↓ - ? 3) Обратите внимание, что в отличие от предыдущей задачи концентрации растворов выражены через нормальность (молярную концентрацию эквивалента). Поскольку концентрации ионов выражают в моль/л, следует перевести нормальную концентрацию в молярную (См. Приложение III):
Э (Мg(NO3)2)= Э ((NH4)2C2O4) = 4) После смешения равных объемов растворов концентрации их равны: С (Мg(NO3)2) = С ((NH4)2C2O4) = 5) Концентрации ионов равны: [Mg2+] = С (Мg(NO3)2) = 1,25·10-3 моль/л [C2O42-] = С ((NH4)2C2O4) = 2,5∙10-3 моль/л Ионное произведение: [Mg2+] · [C2O42-] = 1,25·10-3 · 2,5∙10-3 = 3,13·10-6 6) Ионное произведение < Ответ:осадок не образуется.
▼ Задачи для самостоятельного решения 1. Растворимость СаСО3 равна 0,013 г/л. Вычислить ПР карбоната кальция. Ответ: 1,69·10-8. 2. Растворимость Fe(OH)3 равна 2 · 10-8 г/л. Вычислить ПР гидроксида железа (III). Ответ: 3,3·10-38. 3. Вычислить растворимость Ag2S в моль/л, если его ПР равно 6,3·10-50. Ответ: 2,51·10-17 моль/л. 4.Вычислить растворимость Са3(РО4)2, если его ПР равно 1,03·10-26. Ответ: 2,51·10-6 моль/л. 5. Вычислить растворимость Мg(OH)2, если его ПР равно5,0·10-12. Ответ: 1,07·10-4 моль/л. 6. Вычислить растворимость Са(ОН)2, если его ПР равно 8,0·10-6. Ответ: 1,26·10-2 моль/л. 7. Образуется ли осадок при смешении равных объемов растворов АgNO3 и NaCI с концентрацией каждого 0,001М? (ПРAgCI = 1,78·10-10). Ответ: осадок образуется. 8. Образуется ли осадок при смешении равных объемов растворов АgNO3 и NaCI с концентрацией каждого 0,0001М? (ПРAgCI = 1,78·10-10). Ответ: осадок образуется. 9. Образуется ли осадок при смешении равных объемов растворов SrCI2 и K2SO4 с концентрацией каждого 0,001н? (ПРSrSO4=2,8∙10-7). Ответ: осадок не образуется. 10. Образуется ли осадок при смешении равных объемов 0,01М растворов СаСI2 и Na2C2O4 ( Ответ: осадок образуется. 11. Образуется ли осадок при сливании равных объемов растворов AgNO3 и K2SO4 с концентрацией каждого 0,05 моль/л ( 12. Образуется ли осадок при сливании равных объемов растворов AgNO3 и K2SO4 с концентрацией каждого 0,01 моль/л ( ? Контрольные вопросы 1. Произведение растворимости. Выведите математическое выражение ПР на примере малорастворимого электролита АgCI или BaSO4. Правило произведения растворимости. 2. Объясните влияние одноименного иона на растворимость малорастворимого электролита. В чем заключается явление солевого эффекта? В чем его причина? 3. Условия образования осадков. Факторы, влияющие на полноту осаждения. 4. В какой последовательности будут осаждаться ионы Са2+, Sr2+ и Ва2+ при действии карбонатом аммония, если концентрации их в растворе равны? Ответ поясните. 5. Объясните, почему осадок Мg(OH)2 растворяется в кислотах (HCI) и солях аммония (NH4CI). КАЧЕСТВЕННЫЙ АНАЛИЗ |
|
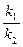 .
.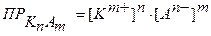 , (20)
, (20)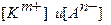 - равновесные концентрации соответственно катионов и анионов; n и m – степени, соответствующие индексам в формуле малорастворимого электролита.
- равновесные концентрации соответственно катионов и анионов; n и m – степени, соответствующие индексам в формуле малорастворимого электролита. .
. Дано: Решение:
Дано: Решение: S(CaCO3)=0,0069г/л Растворимость (Ѕ) – это способность вещества образовывать с другими
S(CaCO3)=0,0069г/л Растворимость (Ѕ) – это способность вещества образовывать с другими

 Дано: Решение:
Дано: Решение: ПРАgI = 1,03·10-16 Искомую растворимость АgI обозначим через «х»
ПРАgI = 1,03·10-16 Искомую растворимость АgI обозначим через «х»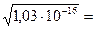 1,02∙10-8 моль/л
1,02∙10-8 моль/л .
. Дано: Решение:
Дано: Решение:
 - ? «х».
- ? «х».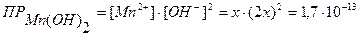
 Дано: Решение:
Дано: Решение: сливания их равных объемов:
сливания их равных объемов: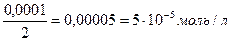
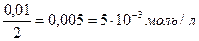
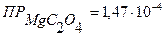 .
. Дано: Решение:
Дано: Решение: С ((NH4)2C2O4) = 0,01н 2)
С ((NH4)2C2O4) = 0,01н 2) 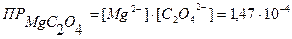
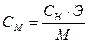
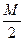 С (Мg(NO3)2) =
С (Мg(NO3)2) = 
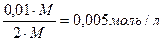


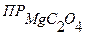 , следовательно, осадок не образуется.
, следовательно, осадок не образуется.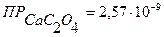 )?
)?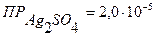 )? Ответ: осадок не образуется.
)? Ответ: осадок не образуется.