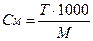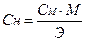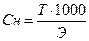|
|
III. Способы выражения концентрации растворов и формулы пересчета концентраций растворов
r - плотность раствора, М – молярная масса, Э – молярная масса эквивалента. Для выражения молярной массы эквивалента введен фактор эквивалентности fэкв – это число, обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции: Э(Х) = fэкв · М(Х).
IV. Единицы массы и объема
1 мг (миллиграмм) = 0,001 г 1 кг (килограмм) = 1000 г 1 т (тонна) = 1000 кг = 1 × 106 г 1 см3 = 1 мл = 0,001 дм3 1 дм3 = 1 л = 1000 мл = 0,001 м3
V. Множители и приставки для образования десятичных кратных и дольных единиц
VI. Уравнивание числа атомов кислорода в окислительно-восстановительных реакциях
VII. Область перехода и показатели титрования индикаторов
VIII. Характеристика воды по степени жесткости
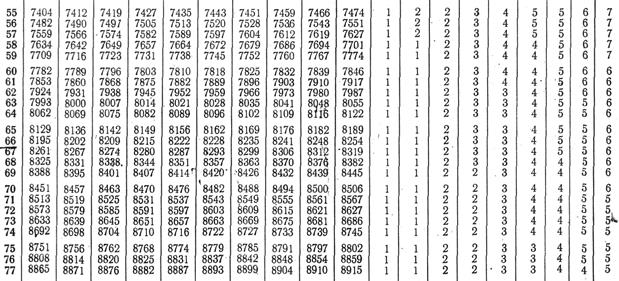
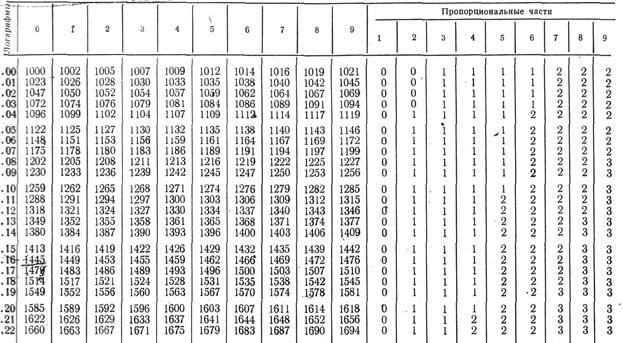
IX. Логарифмы
Продолжение приложения IX
Х. Правила пользования логарифмами и антилогарифмами
1. Логарифмы простых чисел 10, 100, 1000 … равны соответственно 1, 2, 3…, то есть состоят из такого числа положительных единиц, сколько в числе нулей. 2. Целая часть логарифма называется его характеристикой, дробная часть – мантиссой. 3. Нахождение логарифмов чисел. Допустим, требуется найти десятичный логарифм числа 2,34. Записываем характеристику логарифма, равную числу целых цифр без одной: в нашем примере характеристика равна 0 (1 целая цифра минус1). Находим мантиссу. Для этого, не обращая внимания на запятую, находим в крайнем левом ряду в таблице логарифмов (Приложение IX) первые две цифры нашего числа: 23. В верхнем ряду в таблице находим третью цифру нашего числа, то есть 4. На пересечении находим мантиссу логарифма: 3692. Таким образом, lg2,34=0,3693. 4. Нахождение числа по его логарифму. Допустим, lgх=0,485. Чтобы найти «х», не обращая внимания на характеристику, находим в таблице антилогарифмов (Приложение ХI) в крайнем левом ряду число 48 и в верхнем ряду цифру 5. На пересечении находим 3055. Чтобы получить искомую величину «х», нужно, исходя из значения характеристики, поставить запятую. Так как характеристика равна 0, следовательно, отделяем запятой одну цифру. Таким образом, х=3,055. Если lgх=1,15, в таблице антилогарифмов в крайнем левом ряду находим число 15, в верхнем ряду «0», на пересечении читаем 1413. Так как характеристика равна 1, отделяем запятой две цифры. Таким образом, х=14,13. XI. Антилогарифмы
Продолжение приложения ХI
ХII. Растворимость солей, кислот и оснований в воде
Р – растворимые; М – малорастворимые; Н – нерастворимые; - разлагаются водой или не существуют |
|