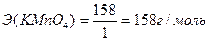|
|
Окислительно-восстановительное титрованиеДанный метод титриметрического анализа основан на окислительно-восстановительных реакциях между титрантом и анализируемым веществом. Реакции окисления-восстановления связаны с переносом электронов. Вещества, отдающее электроны, в этих реакциях является восстановителем (Red), а приобретающее электроны – окислителем (Ох):
Red1 + Ox2 = Ox1 + Red2.
Восстановленная форма одного вещества (Red1), отдавая электроны, переходит в окисленную форму (Ox1) того же вещества. Образуется сопряженная окислительно-восстановительная пара Ox1/Red1 (редокс-пара). Окисленная форма другого вещества (Ox2), принимая электроны, переходит в восстановленную форму (Red2) того же вещества. Образуется другая окислительно-восстановительная пара Ox2 /Red2. Таким образом, в окислительно-восстановительной реакции участвует не менее двух окислительно-восстановительных пар. Мерой окислительно-восстановительных свойств веществ является окислительно-восстановительный потенциал Е0. Сравнивая стандартные потенциалы ОВ-пар, участвующих в ОВР, можно заранее определить направление самопроизвольного протекания реакции. Окислительно-восстановительная реакция самопроизвольно протекает в направлении превращения сильного окислителя в слабый восстановитель, сильного восстановителя в слабый окислитель. Чем больше стандартный потенциал окислительно-восстановительной пары, тем более сильным окислителем является её окисленная форма и тем более слабым восстановителем – восстановленная форма. Чем меньше стандартный потенциал ОВ-пары, тем более сильным восстановителем является восстановленная форма, тем более слабым окислителем – окисленная форма. Поэтому в окислительно-восстановительном титровании (редоксиметрии) в качестве титрантов при определении восстановителей применяют такие окислители (Ох2), стандартные ОВ-потенциалы окислительно-восстановительных пар которых имеют как можно более высокие значения, тем самым с их помощью можно оттитровать большее число восстановителей (Red1). Например, Е0 (MnO4-, H+, Mn2+) = +1,51В, Е0 (Cr2O72-, H+, Cr3+) = +1,33В и др. При определении окислителей (Ох2) в качестве титрантов применяют восстановители (Red1), стандартный ОВ-потенциал редокс-пар которых имеет по возможности минимальное значение. Например, Е0 (I2 / 2I-) = +0,536В, Е0 (S4O62- / 2S2O32-) = +0,09В и др. Для установления точки эквивалентности в редоксиметрии используют редокс-индикаторы (окислительно-восстановительные индикаторы), представляющие собой вещества, способные обратимо окисляться и восстанавливаться, причем окисленная и восстановленная формы их имеют различную окраску. Примером такого индикатора является дифениламин. Часто в редоксиметрии применяется так называемое безиндикаторное титрование, например, в перманганатометрии роль индикатора выполняет титрант – перманганат калия. Количественные расчеты в ОВ титровании, как и в других методах титриметрического анализа, основаны на законе эквивалентов. Молярная масса эквивалента окислителя:
Молярная масса эквивалента восстановителя:
Одним из методов окислительно-восстановительного титрованияявляется перманганатометрическое титрование.Это метод анализа, в котором в качестве титранта-окислителя используют раствор перманганата калия KMnO4. Анион MnO4- проявляет окислительные свойства в кислой, нейтральной и щелочной средах, восстанавливаясь соответственно до катиона Mn2+ (бесцветные ионы), оксида марганца (IV) MnO2 (бурый осадок) и аниона MnO42- (зеленый раствор, буреющий на воздухе). Уравнения полуреакций: - кислая среда MnO4- + 8H+ + 5e- → Mn2+ + 4H2O E0 (MnO4-, H+,Mn2+) = +1,51В -нейтральная среда MnO4- + 2H2O + 3e- → MnO2↓ + 4OH- E0 (MnO4-/MnO2) = + 0,60В -щелочная среда MnO4- + e- → MnO42- E0 (MnO4-/MnO42-) = + 0,56В В перманганатометрии титрование проводят в кислой среде, так как: 1) наиболее сильными окислительными свойствами перманганат-ион MnO4- обладает в кислой среде по сравнению с нейтральной и щелочной, о чем свидетельствуют значения стандартных ОВ-потенциалов (+1,51В против +0,60В и +0,56В); 2) определению конечной точки титрования в нейтральной среде будет мешать бурый осадок MnO2; в щелочной среде образующиеся манганат-ионы MnO42-, имеющие зеленую окраску, также затрудняют фиксацию конечной точки титрования. Образующиеся же в кислой среде катионы Mn2+ бесцветны; 3) при титровании в кислой среде создается возможность четко фиксировать конечную точку титрования без применения постороннего индикатора, так как одна лишняя капля перманганата калия окрашивает бесцветный раствор в бледно-розовый цвет. Титрант: раствор перманганата калия (в кислой среде). Индикатор: перманганат калия. Определяемые вещества: ионы Fe2+, Cr3+, NO2-, перекись водорода Н2О2, этиловый спирт, в биологических исследованиях мочевая кислота, глюкоза, содержание некоторых витаминов, активность фермента каталазы, окисляемость бытовых и сточных вод, органические загрязнения в атмосфере. Одним из недостатков перманганатометрии является необходимость стандартизации раствора перманганата калия, так как его титрованный раствор нельзя приготовить по точной навеске. Кроме того, концентрация перманганата калия, переведенного в раствор, заметно уменьшается. Поэтому точную концентрацию раствора КMnO4 устанавливают не ранее чем через 5 – 7 дней после его приготовления. Для стандартизации используют щавелевую кислоту или её соли (оксалаты натрия или аммония). Стандартные вещества: Н2С2О4·2Н2О, Na2C2O4, (NH4)2C2O4∙H2O. Уравнение реакции, протекающей при стандартизации раствора KMnO4 по щавелевой кислоте: Н2С2О4 + КMnO4 + H2SO4 → CO2↑ + Mn2+ + …
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O 2
5C2O42- + 2MnO4- + 16H+ → 10CO2↑ + 2Mn2+ + 8H2O 10H+ 2K+ 3SO42- 2K+ 3SO42-
5H2C2O4 + 2KMnO4 + 3H2SO4 = 10CO2↑ + 2MnSO4 + K2SO4 + 8H2O
▲ Обучающие задачи Задача №1 Методом ионно-электронного баланса (методом полуреакций) расставить коэффициенты в уравнении ОВ реакции, протекающей по схеме
КMnO4 + KNO2 + H2SO4 → Mn2+ + NO3- + …
Найти молярные массы эквивалентов окислителя и восстановителя. Решение:
КMnO4 + KNO2 + H2SO4 → Mn2+ + NO3- + …
Алгоритм действий: 1. Составить уравнения полуреакций, учитывая, что сильные электролиты записывают в виде ионов, слабые электролиты и вещества, не являющиеся электролитами, – в виде молекул. 2. Суммировать левые и правые части уравнений полуреакций с учетом коэффициентов. 3. Дописать противоионы в левой части и перенести их в правую часть. 4. Объединить ионы в молекулы и записать молекулярное уравнение реакции с учетом коэффициентов.
NO2- + H2O – 2e- → NO3- + 2H+ 5 MnO4- + 8H+ + 5e- → Mn2+ + 4H2O 2
6 3
5K+ 2K+ 3SO42- 7K+ 3SO42-
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
Задача №2 Методом ионно-электронного баланса расставить коэффициенты в реакции между КMnO4 и этанолом в водной среде с образованием уксусной кислоты, используемой для определения окисляемости спирта. Найти молярные массы эквивалентов окислителя и восстановителя. Решение:
С2Н5ОН + КМnO4 + H2O → CH3COOH + MnO2↓ + …
С2Н5ОН + H2O + 4e- → CH3COOH + 4H+ 3 MnO4- + 2H2O + 3e- → MnO2↓ + 4OH- 4
3С2Н5ОН + 3H2O + 4MnO4- +8H2O →3CH3COOH +12H+ +4MnO2↓+ 16OH- 4K+ 4К+
3С2Н5ОН + 4KMnO4 + 11H2O → 3CH3COOH + 4MnO2↓ + 4KOH + 12H2O
3С2Н5ОН + 4KMnO4 → 3CH3COOH + 4MnO2↓ + 4KOH + H2O
Задача №3 На титрование в сернокислой среде 10 мл раствора NaNO2 израсходовано 10,5 мл 0,05н. раствора КMnO4. Вычислить массу NaNO2 в колбе емкостью 100мл.
V(NaNO2) = 10 мл С(NaNO2) ∙ V(NaNO2) = С(КMnO4) · V(КMnO4) V(КMnO4) = 10,5 мл
m (NaNO2) - ?
Схема ОВ реакции: КMnO4 + NaNO2 + H2SO4 → Mn2+ + NO3- + … Уравнение полуреакции: NO2- + H2O – 2e- → NO3- + 2H+
Ответ: m(NaNO2) = 0,1811г.
Задача №4 Навеску КMnO4 массой 0,8578 г растворили и довели объем раствора водой до 100 мл. Вычислить молярную концентрацию эквивалента данного раствора (для реакции в щелочной среде). Дано: Решение:
С (KMnO4) - ? В щелочной среде: MnO4- + e- → MnO42-
Ответ:С(KMnO4) = 0,0543н. ▼ Задачи для самостоятельного решения 1. Методом ионно-электронного баланса расставить коэффициенты в уравнении реакции между раствором K2Cr2O7 и КI в сернокислой среде, используемой для определения общего количества ароматических веществ в пищевых продуктах. Реакция протекает по схеме: K2Cr2O7+KI+H2SO4 → → Cr3+ +I2 + … Найти молярные массы эквивалентов окислителя и восстановителя. Ответ: 49 г/моль; 83 г/моль. 2. Методом ионно-электронного баланса расставить коэффициенты в уравнении реакции между раствором KMnO4 и Na2SO3. Найти молярные массы эквивалентов окислителя и восстановителя: а) в присутствии Н2SO4; б) в присутствии КОН; в) в нейтральной среде. Ответы: а) 31,6 г/моль, 63 г/моль; б) 158 г/моль, 63 г/моль; в) 52,67 г/моль, 63 г/моль. 3. Методом ионно-электронного баланса расставить коэффициенты в уравнении реакции между раствором K2Cr2O7 и FeSO4 в сернокислой среде. Найти молярные массы эквивалентов окислителя и восстановителя. Ответ: 49 г/моль, 152 г/моль. 4. Методом ионно-электронного баланса расставить коэффициенты в уравнении реакции между раствором этилового спирта и KMnO4 в сернокислой среде с образованием СН3СООН, используемой для установления присутствия алкоголя в организме. Найти молярные массы эквивалентов окислителя и восстановителя. Ответ: 31,6 г/моль, 11,5 г/моль. 5. Методом ионно-электронного баланса расставить коэффициенты в уравнении реакции между этанолом и K2Cr2O7 в сернокислой среде с образованием СН3СООН, используемой для определения содержания спирта в вине. Найти молярные массы эквивалентов окислителя и восстановителя. Ответ: 49 г/моль, 11,5 г/моль. 6. Методом ионно-электронного баланса расставить коэффициенты в уравнении реакции между раствором FeSO4 и KMnO4 в сернокислой среде, протекающей по схеме: FeSO4 + KMnO4 + Н2SO4 → Fe3+ + Mn2+ + … и используемой для определения сахара в пищевом сырье и продуктах. Найти молярные массы эквивалентов окислителя и восстановителя. Ответ: 31,6 г/моль, 152 г/моль. 7. Навеску KMnO4 массой 1,8750г растворили и довели объем раствора водой до 500 мл. Найти нормальную концентрацию раствора для реакции: а) в кислой среде, б) в щелочной среде, в) в нейтральной среде. Ответ: а) 0,1187н.; б) 0,0237н.; в) 0,0712н. 8. На титрование в сернокислой среде 10 мл KNO2 израсходовано 11,2 мл 0,0492н. раствора KMnO4. Найти массу KNO2 в колбе емкостью 100 мл. Ответ: 0,2342г. 9. На титрование в кислой среде 10 мл раствора FeSO4 израсходовано 13,7 мл 0,0465н. раствора KMnO4. Вычислить массу FeSO4 в колбе емкостью 100 мл. Ответ: 0,9682г. 10. На титрование в кислой среде 10 мл FeSO4 израсходовано 10,8 мл 0,0551н. раствора KMnO4. Найти массу FeSO4 в колбе емкостью 100 мл. Ответ: 0,9044г. 11. На титрование 10 мл раствора щавелевой кислоты затрачено 12,1 мл 0,0486н. раствора KMnO4. Найти массу щавелевой кислоты (Н2С2О4∙2Н2О) в колбе на 100 мл. Ответ: 0,3704г. 12. На титрование в кислой среде 10 мл раствора FeSO4 израсходовано 9,45 мл 0,05н. раствора K2Cr2O7. Найти массу FeSO4 в колбе на 200 мл. Ответ: 1,4379г. 13. На титрование 10 мл 0,0523н. раствора Na2C2O4 израсходовано 11,95 мл раствора KMnO4 в кислой среде. Найти нормальную концентрацию раствора KMnO4. Ответ: 0,0438н. 14. На титрование 10 мл 0,0496н. раствора Na2C2O4 израсходовано 10,8 мл раствора KMnO4 в кислой среде. Найти нормальную концентрацию раствора KMnO4. Ответ: 0,0459н.
? Контрольные вопросы 1. Какие реакции лежат в основе ОВ титрования? 2. Что такое окислительно-восстановительная пара и ОВ-потенциал? Выбор титранта при определении восстановителей и при определении окислителей на основе значений стандартного ОВ-потенциала. 3. Что такое редокс-индикаторы? 4. Перманганатометрия. Область применения. Назовите титрант, стандартное вещество, приведите уравнение реакции стандартизации (с уравнениями полуреакций и расстановкой коэффициентов методом ионно-электронного баланса). 5. Напишите уравнения полуреакций восстановления перманганат-иона MnO4- в кислой, нейтральной и щелочной средах. Рассчитайте молярные массы эквивалента KMnO4 в каждом случае. В какой среде предпочтительнее осуществлять перманганатометрическое титрование и почему? 6. Уравнение реакции стандартизации KMnO4 по щавелевой кислоте. Расчет величин навесок KMnO4 и Н2С2О4∙2Н2О для приготовления 100 мл их 0,05н. растворов. 7. Что является индикатором в перманганатометрии? Почему первые порции раствора KMnO4 при титровании приливают медленно (см. ЛР №5 – пункт В)? 8. Почему раствор KMnO4 нельзя приготовить по точной навеске? 9. Почему концентрация KMnO4 в растворе уменьшается после его приготовления? 10. Какие процессы происходят при хранении раствора KMnO4 на свету (уравнение реакции)? ПРИЛОЖЕНИЕ
I. Константы диссоциации слабых электролитов (при 250С)
II. Произведения растворимости некоторых малорастворимых соединений (25 0С)
Продолжение приложения II |
|

 (39)
(39)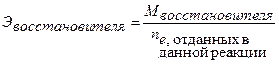 (40)
(40) C2O42- – 2e- → 2CO2 5
C2O42- – 2e- → 2CO2 5






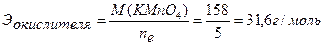




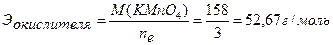

 Дано: Решение:
Дано: Решение: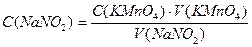
 С (КMnO4) = 0,05н.
С (КMnO4) = 0,05н. 
 Vколбы = 100 мл
Vколбы = 100 мл 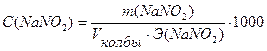
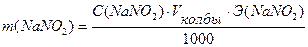
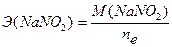
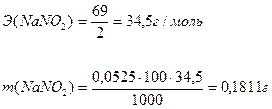
 m(KMnO4) = 0,8578г
m(KMnO4) = 0,8578г 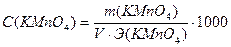
 Vр-ра = 100 мл
Vр-ра = 100 мл