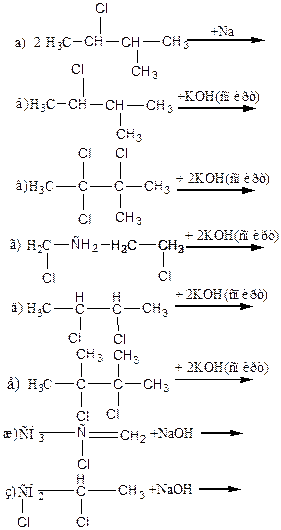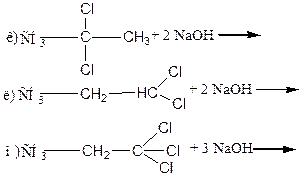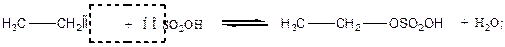|
|
Лабораторная работа № 3. Ароматические углеводородыОПЫТ №1. Получение бензола из бензойнокислого натрия. В сухую пробирку помещают немного заранее приготовленной смеси из бензойнокислого натрия и натронной извести (1:1). Пробирку закрепляют в штативе горизонтально и закрывают пробкой с газоотводной трубкой, конец которой опускают в другую пробирку с водой, охлаждаемую льдом. Реакционную пробирку нагревают в пламени горелки. Чтобы бензол переходил в приемник, вначале нагревают верхнюю часть пробирки, а затем уже реакционную смесь. Через некоторое время в приемнике на поверхности воды появляется маслянистое пятнышко бензола. После того как реакционная пробирка остынет, ее открывают. Ощущается характерный запах бензола. Химизм процесса:
Наблюдения и выводы:
ОПЫТ №2. Свойства бензола. а) Растворимость бензола в различных растворителях. В три пробирки помещают по одной капле бензола. В одну пробирку добавляют 3 капли воды, в другую — 3 капли спирта, в третью — 3 капли эфира. Содержимое пробирок тщательно взбалтывают. Следовательно, бензол в воде практически нерастворим и хорошо растворяется в органических растворителях. Выводы: б) Действие бромной воды на бензол. В пробирку помещают 3 капли бромной воды и 2 капли бензола. Содержимое пробирки энергично взбалтывают и дают отстояться. Наблюдения и выводы:
в) Действие перманганата калия. В пробирку помещают 3 капли воды, каплю раствора перманганата калия и каплю раствора серной кислоты. К полученному раствору добавляют каплю бензола и встряхивают содержимое пробирки. Наблюдения и выводы:
ОПЫТ №3. Окисление гомологов бензола. В пробирку помещают 3 капли воды, каплю раствора перманганата калия и 1 каплю раствора серной кислоты. Затем добавляют каплю толуола и энергично встряхивают в течение 1-2 мин. Химизм процесса:
Наблюдения и выводы:
Заполнить сводную таблицу по теме углеводороды
Тема 8. Галогенпроизводные углеводородов
Галогенопроизводные можно рассматривать как продукты замещения водорода углеводородов на атомы галогенов. В зависимости от природы углеводорода, от которого они происходят, галогенопроизводные могут быть насыщенными, ненасыщенными, ароматическими. В зависимости от природы галогена их подразделяют на фтор-, бром-, хлор- и иодпроизводные. В зависимости от числа атомов галогена различают моно-, ди-, три- и вообще полигалогенпроизводные. Галогенпроизводные редко встречаются в природе, их получают синтетическим путем. Чаще всего для их синтеза используют реакции замещения водорода в предельных углеводородах на галоген, присоединение галогенов или галогеноводородов к ненасыщенным углеводородам. Их также можно получить из органических соединений других классов, например, из спиртов, альдегидов и кетонов. Галогенопроизводные, в свою очередь, служат исходными веществами для синтеза многих органических соединений. Физические и химические свойства галогеналкилов зависят от химической природы входящего галогена и строения радикала. Большинство галогенопроизводных углеводородов – весьма реакционноспособные соединения, широко применяемы в различных синтезах. Наибольшее значение имеют реакции замещения (SN) и отщепления (элиминирования, Е). Примерами взаимодействия с металлами является реакция Вюрца, Вюрца-Фиттига и реакция с магнием.
Задания для самостоятельной работы. Задание 1. Способы получения галогенпроизводных. 1. Получить моногалогенпризводные из указанных реагентов и указать ип реакции: а) из 2-метилбутана
б) из пропена получить 3-хлорпропен и 2-хлорпропан
в) из циклопропана
г) из циклогексана
д)из пропанола
е) из пропина
ж) из бензола
з)из толуола полчить хлортолуол и хлористый бензил
2. Получить дигалогенпроизводные из: а) из бутана
б) из 1-бутена
в) из 1-бутина
г) из циклопропана
д) из циклогексана
е) из фенилацетилена
ж) из винилбензола (стирола)
з) из изопрена (2 продукта)
и) из бензола
Задание 2. Свойства галогенпроизводных. Написать структурные формулы и названия полученных продуктов приведенных ниже реакций. Указать тип химических реакций.
Лабораторная работа №4. ОПЫТ №1. Открытие хлора в составе органических соединений (проба Бельштейна). Реактивы и материалы: хлороформ (или дихлорэтан), медная проволока. Галогены в составе органических соединений проще всего открываются по Бельштейну – прокаливанием органического вещества с оксидом меди в пламени горелки. Медную проволоку длиной 10см с петлей на конце прокаливают над пламенем горелки до исчезновения посторонней окраски пламени (признак отсутствия загрязнения медной проволоки). Остывшую петлю, покрывшуюся черным налетом оксида меди, опускают в пробирку с 1-2 каплями хлороформа (или дихлорэтана) и вновь вносят в пламя горелки. Немедленно появляется ярко-зеленая окраска пламени. При прокаливании кислород оксида меди окисляет углерод и водород органического вещества в диоксид углерода и воду, медь же образует с галогеном летучие соединения, которые и окрашивают пламя горелки в зеленый цвет. Появление зеленого окрашивания указывает на присутствие в органическом соединении галогена. Химизм процесса: 2СНСl3 + 5СuО → СuСl2 + 4СuСl + 2СО2 + Н2О Подобную окраску пламени дают помимо хлористых и другие галогеносодержащие органические соединения.
ОПЫТ №2 Получение хлористого этила. Реактивы и материалы: этиловый спирт, конц. Н2SО4, NаСl(кристал.), газоотводная трубка. В пробирку помещают 2-3мл заранее приготовленной смеси этилового спирта с концентрированной серной кислотой. Прибавляют 1-2г хлорида натрия. Пробирку закрывают пробкой с небольшой газоотводной трубкой, укрепляют наклонно в штативе и осторожно нагревают над пламенем горелки. Если поднести через некоторое время к отверстию газоотводной трубки зажженную лучину, то наблюдается горение образовавшегося хлористого этила с характерным колечком зеленого цвета по краю газоотводной трубки. Реакция образования хлористого этила протекает по следующей схеме:
2NаСl + Н2SО4 → 2НСl + Nа2SО4; СН3-СН2-ОSО2ОН + НСl → СН3СН2Сl + Н2SО4.
|
|