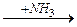|
|
Лабораторная работа № 7. Альдегиды и кетоныОПЫТ №1. Получение уксусного альдегида окислением этилового спирта. В пробирку к 3мл хромовой смеси прибавляют 1мл этилового спирта. Пробирку закрывают пробкой с газоотводной трубкой и осторожно нагревают. Фиксируют изменения окраски и появление запаха «антоновских яблок». Химизм процесса: Наблюдения и выводы:
ОПЫТ №2. Получение и обнаружение ацетона. Ацетон получают сухой перегонкой ацетата кальция по схеме:
В сухую пробирку помещают 5г безводного ацетата кальция, пробирку закрывают пробкой с газоотводной трубкой и нагревают. Для обнаружения ацетона в растворе можно использовать его способность образовывать йодоформ. К 2мл полученного раствора прибавляют равное количество раствора йода в иодиде калия, а затем по каплям прибавляют раствор гидроксида калия до исчезновения бурой окраски. При наличии ацетона образуется желтый осадок йодоформа с характерным запахом. Химизм процесса:
Наблюдения и выводы:
ОПЫТ №3. Окисление альдегидов. а) Окисление аммиачным раствором оксида серебра (реакция «серебряного зеркала»). В чистую пробирку вносят 2 капли раствора нитрата серебра и прибавляют 1 каплю раствора аммиака. Затем прибавляют 1 каплю формальдегида и медленно нагревают на водяной бане при 60-700. При осторожном нагревании содержимое пробирки буреет и на ее стенках может выделится серебро в виде блестящего зеркального налета – комплексный ион металла восстанавливается до металлического серебра, а альдегид окисляется до кислоты, которая образует аммониевую соль. Химизм процесса: Н-СН=О + 2Аg(NН3)2ОН → Н-СООNН4 + 2Аg + Н2О. Эта реакция является качественной на все альдегиды. Наблюдения и выводы:
б) Окисление гидроксидом меди. В пробирку наливают 3 капли формалина (или уксусного альдегида), 5 капель гидроксида натрия и прибавляют по каплям раствор сульфата меди до появления мути. Нагревают верхнюю часть содержимого пробирки. Наблюдают появление осадка оксида меди(I) желтого цвета, переходящего в красный. Химизм процесса:
Наблюдения и выводы:
в) Окисление реактивом Феллинга. В пробирку наливают 5 капель свежеприготовленного реактива Фелинга и добавляют 2 капли формалина или уксусного альдегида. Смесь нагревают. При этом раствор окрашивается сначала в зеленый, затем в желтый цвет и, наконец, выпадает оксид меди(I) красного цвета:
Наблюдения и выводы:
Тема 12. Карбоновые кислоты. Задания для самостоятельной работы Задание 1. Общая характеристика. 1. Дайте определение карбоновых кислот. Классификация карбоновых кислот по количеству карбоксильных групп и по типу строения радикала:
2. Заполнить таблицу для первых шести представителей одноосновных карбоновых кислот:
3. Написать пять представителей гомологического ряда двухосновных насыщенных карбоновых кислот, назвать их и дать название их солей. Задание 2. Способы получения и свойства карбоновых кислот. 1. Напишите схемы реакций получения пропионовой кислоты: а) Окислением соответствующего альдегида:
б) Окислением кетона:
в) Из тригалогенпроизводного:
г) Из моногалогенпроизводного через образование нитрила:
д) Используя реактив Гриньяра:
2. Написать уравнение реакций окисления следующих соединений: 2-метил-1-пропанол, 2-бутанон, 3-метилбутаналь, 2-метил-3-гексен, 2-метил-1,4-бутандиол. Назвать продукты.
3. Написать схемы химических превращений: CH2=CH-CH3+CO+H2
4. Указать к каким классам соединений относятся продукты реакций. Написать уравнений реакций: а) CH3COCl + CH3CH2COONa →
б) CH3COCl + CH3CH2ONa →
в) CH3CH2COOH + NaOH →
г) CH3CH2 CH2COOH + PCl5 →
5. Исходя из этилена, получить щавелевую и янтарную кислоты, а затем написать продукты, которые образуются при нагревании полученных кислот.
|
|
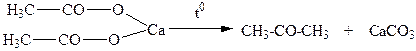
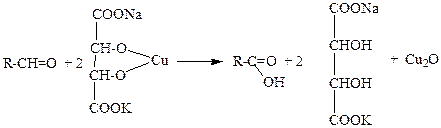
 A
A  Б
Б  В
В  Г
Г