|
|
Лабораторная работа № 6.. ФенолыРеакции, характеризующие химические свойства фенолов можно разделить на 2 типа: а) реакции, протекающие за счет фенольного гидроксила; б) реакции, протекающие за счет бензольного ядра. К первой группе относятся реакции образования фенолятов, алкилирования и ацилирования. Ко второй группе – реакции электрофильного замещения атомов водорода бензольного ядра. Это реакции нитрования, сульфирования и галогенирования. Кроме того, фенолы способны к реакциям поликонденсации и окисления.
ОПЫТ №1. Растворимость фенола в воде и его кислотные свойства. В пробирку помещают 1г кристаллического фенола и приливают 2мл воды. При встряхивании фенол частично растворяется. При осторожном нагревании фенол полностью растворяется и смесь превращается в однородную жидкость, так как с повышением температуры растворимость фенола увеличивается и выше 680С фенол смешивается с водой во всех отношениях. Полученный водный раствор фенола испытывают синей лакмусовой бумагой. Наблюдают изменение окраски, что указывает на кислый характер фенола. Наблюдения и выводы:
ОПЫТ №2. Получение фенолята натрия. Содержимое пробирки из предыдущего опыта взбалтывают до образования эмульсии и прибавляют по каплям 10% раствор гидроксида натрия. При этом фенол легко растворяется, образуя гомогенный раствор фенолята натрия. Если к раствору фенолята натрия прибавить минеральную кислоту, например, 10% НСl, то происходит выделение свободного фенола в виде мельчайших капелек, о чем свидетельствует помутнение жидкости. Химизм процесса:
Наблюдения и выводы:
ОПЫТ №3. Цветные реакции на фенольную группу. а) Качественная реакция на фенол с хлоридом железа(III). В пробирку наливают 5 капель раствора фенола и прибавляют 3 капли 2% раствора хлорида железа – появляется фиолетовое окрашивание вследствие образования фенолятов трехвалентного железа. Это качественная реакция на фенолы, так как все фенолы дают с FеСl3 различные окрашенные комплексы. б) Цветные реакции фенолов с хлорным железом. Реакция с хлорным железом является характерной реакцией на фенолы вообще. С помощью этой реакции можно отличать различные фенолы по характерной окраске, которую они дают с хлорным железом. Заготовьте три пробирки и в каждую поместите по 3 капли 1% растворов различных фенолов: в первую – пирокатехин, во вторую – резорцин, в третью – гидрохинон. В каждую пробирку прибавьте по 1 капле 0,1н раствора FеСl3. В первой пробирке появляется зеленое окрашивание, во второй – фиолетовое, в третьей – зеленое, очень быстро переходящее в желтое (окисление гидрохинона в хинон). Химизм процесса и выводы:
ОПЫТ №4. Взаимодействие фенола с бромом. В пробирку наливают 3 капли раствора фенола и при постоянном встряхивании прибавляют бромную воду до тех пор, пока жидкость в пробирке не примет светло-желтую окраску.
Наблюдения и выводы:
ОПЫТ №5. Получение фенол-формальдегидной смолы. Поместите в пробирку 4капли жидкого фенола, добавьте к нему 4 капли 40% формалина и убедитесь в том, что вместо мутной эмульсии образуется прозрачный раствор. Добавьте к полученному раствору 2 капли 2н NН4ОН и поставьте в кипящую водяную баню. Через 20мин жидкость в пробирке расслаивается: на дне образуется фенол-формальдегидная смола – резол, а над ней водный слой. После остывания пробирки, когда смола несколько загустеет, слейте водный слой и с помощью жгутика, свернутого из фильтровальной бумаги, снимите со стенок пробирки капли воды. К оставшейся в пробирке смоле прилейте этиловый спирт и нагрейте до растворения смолы. Полученный раствор (спиртовый лак) вылейте на предметное стекло. По мере испарения спирта на стекле постепенно образуется клейкая масса. Схематически реакцию поликонденсации фенола с формальдегидом можно представить так: молекулы фенола связываются углеродными мостиками за счет метиленовых групп формальдегида:
В первой фазе реакции образуются цепеобразные молекулы резолов (бакелит А). Эти смолы растворимы в органических растворителях, например, в этиловом спирте, образуют так называемые бакелитовые лаки или клеи (клей БФ). Выводы:
Тема 11. Карбонильные соединения. Альдегиды и кетоны Задания для самостоятельной работы Задание 1. Общая характеристика. 1. Дайте определение альдегидов и кетонов. Приведите их общие структурные формулы.
2. Напишите шесть представителей гомологического ряда альдегидов и кетонов, дайте им названия по систематической и тривиальной номенклатурам:
3. Напишите структурные формулы изомерных альдегидов и кетонов, имеющих формулу C5H10O.
Задание 2. Способы получения и свойства альдегидов и кетонов. 1. Укажите возможные способы синтеза альдегидов: а) Реакция Кучерова; б) Окисление первичных спиртов; в) Дегидрирование вторичных спиртов; г) Окисление вторичных спиртов. Ответы: 1) а, б 2) в, г 3) а, в 4) б, г 5) б, в Приведите уравнения реакций.
2. Укажите возможные способы синтеза кетонов: а) Реакция Кучерова; б) Дегидрогенизация первичных спиртов; в) Окисление вторичных спиртов; г) Окисление первичных спиртов; д) Сухая перегонка кальциевых солей карбоновых кислот. Ответы 1)а, б, д 2) а, в, д 3) а, в, г 4) а, б, г 5) а, г, д Приведите уравнения реакций.
3. Получите 3-пентанон: а) окислением соотвтествующего спирта
б) гидролизом дигалогенпроизводного
в) гидратацией алкина 4. Написать реакцию окисления пропилового спирта и с полученным соединением написать реакции:
а) С водородом
б) С бисульфитом натрия
в) «Серебряного зеркала»
г) С пятихлористым фосфором
д) С цианистоводородной кислотой
е) С этанолом
ж) С реактивом Гриньяра (CH3-Mg-Cl) 5. Проведите реакцию альдольной конденсации, а затем кротоновой конденсации: - метаналя с этаналем
- пропионового альдегида
- ацетона с ацетоном
6. Осуществите превращения: а) этан → дихлорэтан → уксусный альдегид → уксусная кислота
б) пропан
в) СН3-СН=СН2 + СО + Н2 → А
г) толуол
|
|
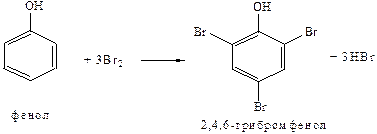
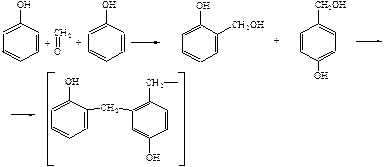
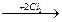 А
А  Б
Б 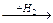 В
В 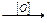 Г
Г 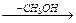 Д
Д Б
Б 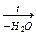 В
В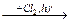 А
А  Б
Б 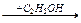 Г
Г