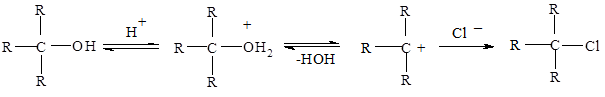|
|
Опыт №10. Проба на ароматическую структуруК 1 мл хлороформа, высушенного над СаCl2, прибавляют 2-3 капли бензола, тщательно перемешивают и пробирку слегка наклоняют, чтобы смочить стенки. Добавляют 0,5-0,6 г AlCl3 таким образом, чтобы часть порошка попала на стенки пробирки. Обращают внимание на окраску порошка на стенке и на цвет раствора. Опыт можно повторить с другими ароматическими углеводородами – дифенилом, нафталином. В реакции с бензолом возникает красно-оранжевая окраска, дифенилом – синяя, нафталином – зеленая. Чтобы отличить ароматические углеводороды от углеводородов жирного ряда, используют цветную реакцию углеводородов с хлороформом в присутствии хлорида аллюминия. Эта реакция сопровождается образованием окрашенных продуктов. Так, при взаимодействии бензола с хлороформом в присутствии хлорида аллюминия, кроме основного продукта реакции бесцветного трифенилметана, образуется также окрашенная комплексная соль трифенилхлорметана. AlCl3 3С6Н6 + СНCl3 → (C6Н5)3СН + 3НСl
AlCl3 5С6Н6 + 2СНCl3 → (C6Н5)3СCl + (C6Н5)2СН2 + 5HCl трифенилхлорметан (C6Н5)3СCl + AlCl3 → [(C6Н5)3С)]+AlCl4
Контрольные вопросы по теме «Углеводороды»
Галогенпроизводные углеводородов Опыт №1. Получение йодоформа В пробирку наливают около 10 капель этилового спирта и добавляют несколько кристалликов растертого йода и 2 мл воды. К полученной смеси при взбалтывании приливают раствор гидроксида натрия до растворения йода и исчезновения его окраски. Смесь нагревают до 60-700С. Из жидкости начинает выделяться светло-желтый осадок йодоформа. Химизм процесса: I2 + 2NaOH → NaOI + NaI + H2O NaOI → NaI + [O] CH3-CH2-OH + [O] → CH3-COH + H2O CH3-COH + 3I2 → CI3-COH + 3HI CI3-COH + NaOH → CHI3 + HCOONa Напишите суммарное уравнение реакции образования йодоформа. Йодоформ образует кристаллы желтого цвета с Тпл.= 1190С, обладает сильным навязчивым запахом.
Опыт № 2. Подвижность галогена в галогенпроизводных различного типа В пробирки помещают по 0,5 мл галогенпроизводного, добавляют 2-3 мл дистиллированной воды, встряхивают. После отстаивания смеси водный слой сливают. Промытые галогенпроизводные делят на две порции. К первой порции приливают 1-2 мл 10%-го водного раствора гидроксида натрия и нагревают (при встряхивании) до кипячения. Затем смесь охлаждают, подкисляют разбавленной азотной кислотой и добавляют несколько капель раствора нитрата серебра. В пробирках с какими веществами протекает реакция с образованием галогенида серебра? В пробирки со вторыми порциями галогенпроизводных добавляют 1-2 мл спиртового раствора нитрата серебра и нагревают до кипячения. Отмечают, в каких пробирках происходит выделение осадка галогенида серебра Атомы галогенов, связанные с атомом углерода бензольного кольца, характеризуются малой подвижностью. Такой атом галогена не отщепляется ни щелочью (водной или спиртовой), ни спиртовым раствором нитрата серебра. Такая малая реакционная способность галогена сближает галогенпроизводные этого типа (например, хлорбензол) с соединениями жирного ряда, содержащими галоген у атома углерода, связанного с другим атомом углерода двойной связью, например, с хлористым винилом СН2=СНСl. Атом галогена у α-углеродного атома боковой цепи обладает большой подвижностью (большей, чем у галогеналкилов). В пробирках с хлористым бензилом немедленно выпадает белый осадок хлорида серебра. Химизм процесса: t С6Н5-СН2Сl + H2O → С6Н5-СН2ОН + НCl хлористый бензил бензиловый спирт НCl + AgNO3 → AgCl↓ + HNO3 C6H5 -CH2Cl + Ag-O-NO2 → C6H5 -CH2-O- NO2 + AgCl↓ бензиловый эфир азотной кислоты Контрольные вопросы по теме «Галогенпроизводные углеводородов»
Оксисоединения: спирты, фенолы Опыт № 1. Проба Лукаса В три сухие пробирки приливают по 0,5 мл спиртов: пропилового (первичного спирта), изопропилового (вторичного спирта) и третичного бутилового. Затем в каждую пробирку добавляют по 1,5 мл реактива Лукаса. Перемешивают содержимое пробирок и оставляют стоять на 1-3 мин. Какие изменения происходят в пробирках с первичным, вторичным и третичным спиртами? Какие свойства спиртов (основные или кислотные) проявляются в этой реакции? Для того чтобы различить первичные, вторичные и третичные спирты, используется различная подвижность гидроксогруппы в реакции спиртов с хлоридом цинка в концентрированной соляной кислоте: ZnCl2 R-OH + HCl → R-Cl + H2O Третичные спирты реагируют мгновенно с выделением теплоты, давая нерастворимые галогеналкилы. Вторичные спирты реагируют не мгновенно, а в течение 5 мин. без выделения теплоты. Первичные спирты не реагируют даже при длительном стоянии при комнатной температуре. Этот порядок реакционной способности отражает порядок устойчивости карбокатионов (третичный > вторичный > первичный) и легкость превращения спирта в алкилхлорид через соответствующий карбокатион. ZnCl2 СН3-СН2-СН2-ОН + HCl → реакция не идет ZnCl2 + Cl- СН3-СН(ОН)-СН3 + НСl → СН3-СН- СН3 → СН3-СН(Сl)-СН3 вторичный катион ZnCl2 + Cl- СН3-(СН3)СН(ОН)-СН3 + НСl → СН3-СН(СН3 )-СН3 → СН3-(СН3 )СН(Сl)-СН3 третичный катион Какую роль играет безводный хлорид цинка в реактиве Лукаса? Хлорид цинка представляет собой кислоту Льюиса, он реагирует со спиртом как с основанием Льюиса:
+ - R-O + ZnCl2 → R-O ─ ZnCl2 │ │ H H Такая координация делает гидроксигруппу лучшей уходящей группой, такой спирт легко атакуется ионом хлора. Вероятно, первичный спирт реагирует очень медленно по механизму SN2, вторичный спирт – по механизму SN1. Третичные спирты реагируют с соляной кислотой без хлорида цинка, что, несомненно, обусловлено большей устойчивостью (легкостью образования) третичного катиона. Они реагируют также по механизму SN1:
Реакционная способность спиртов по отношению к реактиву Лукаса: бензиловый > аллиловый > третичный > вторичный > первичный.
|
|