|
|
Опыт № 1. Образование и разложение соли анилинаК 5-6 каплям анилина добавляют 2-3 мл воды и смесь сильно встряхивают. В полученную эмульсию опускают красную лакмусовую бумагу. Окраска индикатора не меняется. Эмульсию анилина делят на две части. К одной части прибавляют по каплям при встряхивании концентрированную соляную кислоту. Постепенно эмульсия превращается в однородную жидкость. При прибавлении к ней раствора гидроксида натрия жидкость мутнеет. К другой части эмульсии анилина прибавляют по каплям при встряхивании серную кислоту. Выпадает белый осадок. При добавлении раствора гидроксида натрия осадок растворяется и жидкость мутнеет. Анилин, как и все амины, является основанием. Однако непосредственно связанное с аминогруппой ароматическое ядро резко ослабляет основные свойства ароматических аминов. Анилин гораздо более слабое основание, чем, например, аммиак. Водный раствор анилина не окрашивает красный лакмус в синий цвет. Анилин образует соли только с сильными минеральными кислотами:
Большинство солей анилина хорошо растворимы в воде, хуже растворим сульфат. Соли анилина в водном растворе сильно гитдролизованы, эти растворы имеют резко кислую реакцию.
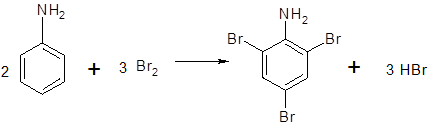
Опыт № 2. Бромирование анилина К 5 мл воды приливают 2-3 капли анилина и смесь сильно встряхивают. К полученной эмульсии по каплям прибавляют бромную воду. Смесь обесцвечивается, и выпадает белый осадок триброманилина. Введение в ароматическое кольцо аминогруппы резко повышает подвижность атомов водорода при атомах углерода бензольного кольца, поэтому анилин очень легко бромируется даже в разбавленном водном растворе с образхованием малорастворимого в воде 2,4,6-триброманилина:
В результате бромирования слабые основные свойства анилина еще больше ослабевают, и триброманилин почти не растворим в разбавленных кислотах.
Опыт № 3. Окисление анилина К 1 мл анилиновой воды добавляют 2-3 каплираствора бихромата калия и 0,5 мл раствора разбавленной серной кислоты. Жидкость окрашивается в интенсивный темно-зеленый цвет, переходящий в синий, а затем в черный. Окисление анилина протекает очень легко, и в зависимости от условий и характера окислителя образуются различный соединения: азобензол, азооксибензол, нитробензол, бензохинон и т.д. В условиях описанного опыта анилин при окислении дает различные слодные окрашенные соединения, содержащие хиноидную группу:
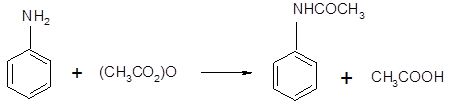
Опыт № 4. Получение ацетанилида В пробирке сильно взбалтывают смесь 1 мл анилина и 3 мл воды. К полученной эмульсии приливают 1 мл уксусного ангидрида. Пробирку закрывают пробкой и сильно встряхивают. Выделяются кристаллы ацетанилида, и смесь застывает в густую массу. Химизм процесса:
Контрольные вопросы по теме «Ароматические амины»
Рекомендуемая литература
|
|
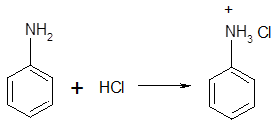
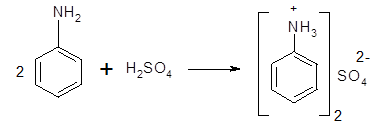
 Продукт окисления анилина бихроматом калия – черный анилин – очень стоек к кислотам ищелочам. Его часто применяют для крашения волокна, а также в лабораториях для окрашивания рабочих столов.
Продукт окисления анилина бихроматом калия – черный анилин – очень стоек к кислотам ищелочам. Его часто применяют для крашения волокна, а также в лабораториях для окрашивания рабочих столов.