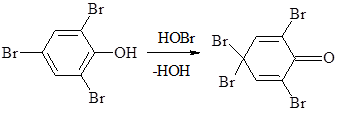|
|
Опыт № 6. Реакция фенолов с хлоридом железа (III)В каждую пробирку наливают по 1 мл раствора соответствующего фенола и прибавляют 1-2 капли раствора хлорида железа (III). Растворы фенола и резорцина дают при этом интенсивное фиолетовое окрашивание, раствор пирогаллола – буровато-красное. Раствор гидрохинона сначала зеленеет, затем буреет, а при стоянии из него выпадают красивые темно-зеленые кристаллы хингидрона. Окрашенные растворы, содержащие фенол, резорцин и пирогаллол делят каждый на две части; к одной части добавляют равный объем спирта, к другой – разбавленной соляной кислоты. Что наблюдаете? Из смеси, содержащей гидрохинон, отливают немного раствора, отстоявшегося над осадком, и добавляют к нему несколько капель ферроцианида калия К3[Fe(CN)6]. Образуется темно-синий осадок турнбулевой сини Fe3[Fe(CN)6]2. Многие фенолы и более сложные соединения, содержащие в молекуле фенольный гидроксил, дают с хлоридом железа (III) интенсивное окрашивание того или иного цвета, характерное для данного фенола. Окрашивание является результатом образования сильно диссоциированных комплексных фенолятов железа (III), образующихся по уравнению:
6 ArOH + FeCl3 → [(ArO)6Fe]3- + 6H+ + 3Cl-
При введении кислоты, спирта, избытка хлорида железа(III) уменьшается степень диссоциации фенолята (а, следовательно, снижается концентрация окрашенных анионов) и окраска уничтожается. Одновременно хлорид железа (III) действует на фенолы и как окислитель. Гидрохинон окисляется им до хинона, из которого затем образуется хингидрон:
(бесцветный) (желтый) (зеленый)
Реагируя как окислитель, соль трехвалентного железа переходит в соль двухвалентного железа, что легко обнаруживается действием ферроцианида калия:
3Fe2+ + [Fe(CN)6]3- → Fe3[Fe(CN)6]2
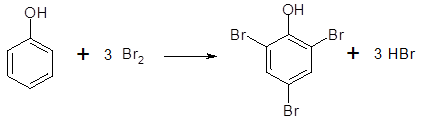
Опыт № 7. Действие брома на фенол в водном растворе К 1 мл водного раствора фенола добавляют бромную воду по каплям. Образующаяся сначала муть при встряхивании исчезает. При дальнейшем прибавлении бромной воды (3-4 мл) выделяется обильный белый осадок трибромфенола с характерным аптечным запахом. Продолжают добавлять бромную воду при встряхивании до превращения белого осадка в светло-желтый. Бромирование фенола в водном растворе идет вначале быстро, и фенол количественно превращается в малорастворимый неокрашенный 2,4,6-трибромфенол:
Но бромная вода является не только бромирующим агентом, но и окислителем вследствие происходящей реакции:
Br2 + H2O → HOBr + HBr
Поэтому при действии избытка бромной воды трибромфенол окисляется до тетрабромфенола, представляющего собой 2,4,4,6 – тетрабромциклогексадиенон:
Этот продукт окрашен в желтый цвет и плохо растворим в холодной воде.
Опыт № 8. Окисление фенола К 0,5 мл раствора фенола добавляют равный объем раствора карбоната натрия и затем приливают по каплям при встряхивании раствор перманганата калия. Происходит обесцвечивание раствора и выделение оксида марганца (IV) при комнатной температуре. Окисление фенола протекает одновременно по различным направлениям и приводит к образованию сложной смеси веществ. Более легкая окисляемость фенола по сравнению с бензолом обусловлена влиянием гидроксильной группы, резко повышающей подвижность атомов водорода при атомах углерода бензольного кольца, особенно в положениях 2,4,6.
Контрольные вопросы по теме «Оксисоединения: спирты, фенолы» |
|
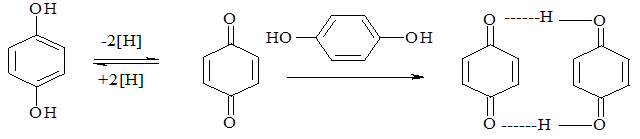 гидрохинон п-хинон хингидрон
гидрохинон п-хинон хингидрон