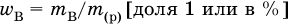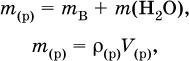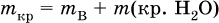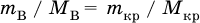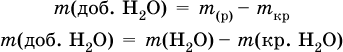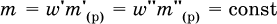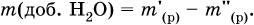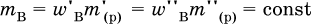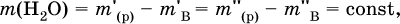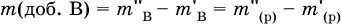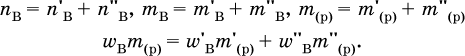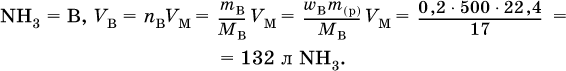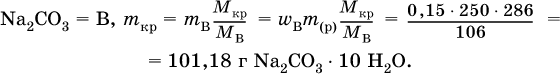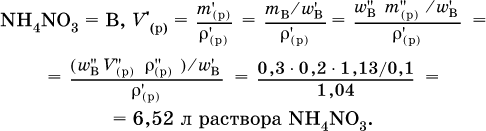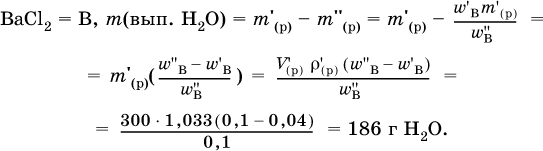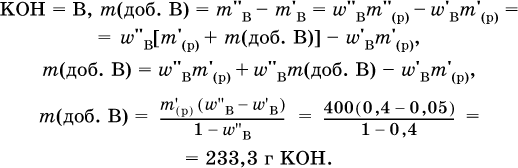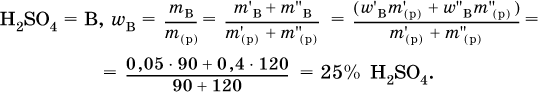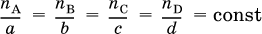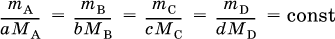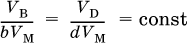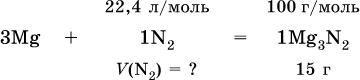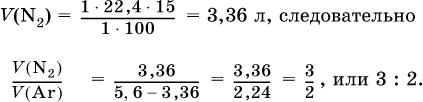|
|
Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворов
Массовая доля растворенного вещества В (ωв) – это отношение массы вещества В (тв) к массе раствора (m(р)):
При решении ωв выражается всегда в долях единицы (например, ωв = 0,01), в ответе – часто в процентах (ωв=1 %). Величина, численно равная ωв (в %), характеризует раствор в целом, например, при ωв = 1 % раствор будет однопроцентным (1 %‑ный раствор вещества В). Соотношения для массы раствора:
где ρ(р) – плотность и V(p) – объем раствора. Для воды условно считается, что ее масса и объем численно равны, т. е. плотность принимается равной 1 г/мл или 1000 г/л. Если для приготовления раствора берется кристаллогидрат некоторой соли (а не сама безводная соль), то используются соотношения: а) масса кристаллогидрата В хН2O
где m(кр. Н2O) – масса воды, которая содержится в данной массе кристаллогидрата; б) масса безводной соли В в кристаллогидрате
так как nв = nкр; б) масса добавляемой воды
где т(Н2O) – суммарная масса воды в приготовленном растворе. В лабораторной практике часто приходится готовить разбавленный раствор вещества (величины с индексом ') из концентрированного раствора того же вещества (величины с индексом ") путем разбавления водой. Масса растворенного вещества при разбавлении не изменяется:
Масса добавляемой воды определяется соотношением:
Для приготовления концентрированного раствора вещества В из разбавленного раствора применяют два способа. а) Выпаривание некоторой порции воды из начального раствора. При этом масса растворенного вещества не меняется.
а масса воды, которую удаляют из раствора, определяется соотношением:
б) Добавление некоторой порции вещества В в начальный раствор. При этом масса воды не изменяется:
а масса добавленного вещества определяется соотношением
Для приготовления раствора с промежуточным составом (величины без индексов) проводят смешивание концентрированного и разбавленного растворов вещества В. При этом все величины связаны соотношениями:
Примеры решения задач
1. Вычислите объем (в литрах, н.у.) аммиака, который полностью поглощается водой с образованием 500 г 20 %‑ного раствора.
2. Какую массу (в граммах) кристаллогидрата Na2CO3 10Н2O следует использовать для приготовления 250 г 15 %‑ного раствора безводной соли?
3. До какого объема (в литрах) надо разбавить водой 250 мл 30 %‑ного раствора нитрата аммония (плотность раствора 1,13 г/мл), чтобы приготовить 10 %‑ный раствор (плотность 1,04 г/мл)?
4. Установите массу (в граммах) выпаренной воды из 300 мл 4%‑ного раствора хлорида бария (плотность раствора 1033 г/л), если приготовлен 10 %‑ный раствор.
5. Вычислите массу (в граммах) порции гидроксида калия, которую добавили в 400 г 5%‑ного раствора этого вещества и довели массовую долю до 40 %.
6. Определите массовую долю (в %) серной кислоты в конечном растворе, приготовленным смешиванием 90 г 5%‑ного и 120 г 40 %‑ного растворов этого вещества.
Задания для самостоятельного решения части В
1. Установите массовую долю (в %) хлорида калия в растворе, приготовленным из 0,65 моль соли и 300 мл воды. 2. Приготовлено 300 г 5%‑ного раствора иода в этаноле. Рассчитайте массу (в граммах) использованного спирта. 3. Какой объем (в литрах, н. у.) метаналя необходимо растворить в 500 мл воды, чтобы приготовить 30 %‑ный формалин. 4. Рассчитайте массовую долю (в %) сульфата цинка (II), если раствор приготовлен из 0,75 моль кристаллогидрата ZnSO4 7Н2Oи 600 г воды. 5. Найдите массу (в граммах) кристаллогидрата CuSO4 5Н2O, которую необходимо взять для приготовления 160 г 10 %‑ного раствора безводной соли. 6. Бромоводород объемом 5,4 л (н. у.) затрачен на приготовление 8 %‑ного раствора (плотность равна 1056,8 г/л). Вычислите объем (в литрах) этого раствора. 7. Определите массу (в граммах) добавленной воды, необходимой для приготовления 10 %‑ного раствора из 1 моль дигидрата гидроксида калия. 8. Установите массу (в граммах) 4 % – ного раствора нитрата калия, приготовленного путем разбавления водой из 20 г 15 %‑ного раствора. 9. Рассчитайте, до какого объема (в литрах) надо разбавить водой 700 г 50,5 %‑ного раствора ацетата калия, чтобы приготовить 7,7 %‑ный раствор с плотностью 1038 г/л. 10. Какой объем (в литрах) воды необходим для разбавления 200 мл 96 %‑ного этанола (плотность 0,8 г/мл) до 10 %‑ного спирта? 11. К 100 г 35 %‑ного водного раствора метанола добавили 50 г того же вещества. Найдите массовую долю (в %) спирта в конечном растворе. 12. К 250 мл 8% – ного раствора нитрата серебра (I) добавили еще соли и приготовили 16 %‑ный раствор. Установите добавленное количество соли (моль). 13. Какой объем (в литрах, н. у.) аммиака надо растворить в 1 л 10 %‑ного раствора (плотность 0,96 г/мл) того же вещества для приготовления 15 %‑ного раствора? 14. Определите массовую долю (в %) нитрата натрия в конечном растворе, приготовленным смешиванием 90 г 5%‑ного и 120 г 40 %‑ного растворов. 15. Какую массу в граммах 96 %‑ный серной кислоты надо смешать с 200 г 5%‑ный кислоты, чтобы приготовить 20 %‑ный раствор? 16. Смешали 250 мл 30 %‑ного водного раствора метанола (плотность раствора 0,954 г/мл) и 300 г 40 %‑ного раствора того же спирта. Какой станет массовая доля (в %) вещества в конечном растворе? 17. Заполнили колбу вначале хлороводородом (н. у.), затем водой. Какова массовая доля (в %) вещества в приготовленном растворе? 18. Гидроортофосфат кальция образует 0,02 %‑ный насыщенный раствор в комнатных условиях. Найдите минимальный объем (в литрах) воды, требующийся для растворения 100 г соли. 19. Приготовлен раствор из 219 г кристаллогидрата СаCl2 6Н2O и 1 л воды. Рассчитайте массовую долю (в %) безводной соли в этом растворе. 20. Определите количество гидроксида калия (моль), содержащееся в 3 л 25 %‑ного раствора (плотность 1,24 г/мл). 21. Найдите объем (мл) воды, в котором надо растворить 70 г Fe(NO3)3 9Н2O для приготовления 12 %‑ного раствора. 22. Каким количеством воды (моль) надо разбавить 500 мл 20 %‑ный азотной кислоты (плотность 1,12 г/мл), чтобы приготовить 8 %‑ный раствор? 23. Разбавлением водой приготовлен 1 кг 3,5 %‑ный уксусной кислоты из 70 %‑ной (плотность 1,069 г/мл). Найдите объем (мл) исходного раствора кислоты. 24. Приготовили раствор 10 г сахарозы в 200 г воды. Затем раствор упарили вдвое (по объему). Определите массовую долю (в %) углевода в конечном растворе. 25. К 1 л 25 %‑ного раствора едкого натра (плотность раствора 1,28 г/мл) добавляют порцию той же щелочи и готовят 35 %‑ный раствор. Рассчитайте массу (в граммах) этой порции. 26. Смешали 300 мл 10 %‑ный хлороводородной кислоты (плотность 1,05 г/мл) и 100 г 5%‑ной кислоты. Определите массовую долю (в %) растворенного вещества в конечном растворе. 27. Водный 5 %‑ный раствор нитрата стронция массой 320 г смешали с 45 г 38 %‑ного раствора того же вещества. Рассчитайте конечную массовую долю (в %) растворенного вещества.
Объемное отношение газов
Для химической реакции aA + bB = cC + dDвыполняется соотношение
где nА и nВ – количества вступивших в реакцию исходных веществ, пС и nD – количества образовавшихся продуктов, а, b, с и d – стехиометрические коэффициенты. От количеств веществ легко перейти к их массам:
Для газообразных веществ чаще задают или определяют их объемы. Если реагент В и продукт D – газы, то проводят переход от количеств этих веществ к их объемам:
При известных (по условию) количестве, массе или объеме (для газа) одного из веществ, участвующих в реакции, можно рассчитать значения всех величин для остальных веществ. В случае смеси газов А и В, один из которых участвует в реакции, можно найти взятое соотношение их объемов VA : VB, а при заданном соотношении – объем их смеси (или наоборот).
Пример решения задачи
При высокой температуре магний реагирует с азотом, взятым в виде смеси с аргоном, общим объемом 5,6 л (н.у.), и образует 15 г нитрида. Рассчитайте объемное отношение газов V(N2): V(Ar) в исходной смеси.
Задания для самостоятельного решения части А
1. Прореагировало 6 л оксида азота (II) с 5 л кислорода (объемы измерены при равных условиях), следовательно, в конечной смеси объемное отношение продукта к одному из реагентов равно 1) 3: 1 2) 2: 1 3) 1: 2 4) 1: 3
2. В замкнутом сосуде сожгли 24 г графита в 67,2 л (н. у.) кислорода и получили объемное отношение кислород: продукт равным 1) 2: 1 2) 1: 1 3) 1: 2 4) 2: 3
3. Пропустили через озонатор 7,5 моль кислорода, который частично превратился в озон. Последний полностью затрачен на «сжигание» (при нормальных условиях) 0,5 моль сероводорода (превращается в SO2); следовательно, объемное отношение O3: O2 на выходе из озонатора составляло 1) 1: 12 2) 1: 19 3) 2: 27 4) 2: 33
4. Бромид калия массой 142,8 г прореагировал количественно в растворе с хлором, взятым в виде смеси с воздухом в объемном отношении 1 (хлор): 2 (воздух). Общий объем (в литрах) исходной смеси газов был 1) 22,4 2) 40,32 3) 13,44 4) 26,88
5. Для полного сгорания 17,92 л (н.у.) смеси СН4 + Н2 потребовался 1 моль кислорода. В исходной смеси объемное отношение СН4: Н2 равно: 1) 2: 1 2) 1: 1 3) 1: 2 4) 3: 2
6. Газ А, полученный при прокаливании 0,04 моль КClO3 на катализаторе, смешали (при н. у.) в сосуде с газом Б, выделившимся при обработке 6 г кальция водой, и получили смесь с объемным отношением А: Б, равным 1) 1: 5 2) 2: 5 3) 3: 4 4) 5: 7
7. После сжигания нитробензола в избытке кислорода получена смесь продуктов (азот, углекислый газ, вода), в которой содержится 4 л (н. у.) азота, а объемное отношение N2: O2 равно 4: 1. В этих условиях исходный объем (в литрах, н. у.) кислорода составлял 1) 11,2 2) 22,4 3) 25,5 4) 51,0
8. Проведено термическое разложение 1 моль хлорида аммония в стальном баллоне, уже содержавшем 11,2 л (н. у.) аммиака. Конечное объемное отношение NH3: НCl равно 1) 5: 2 2) 3: 2 3) 5: 1 4) 3: 1
9. Смесь кислорода и хлора с объемным отношением 9: 1 использована для выделения 0,5 моль простого вещества из раствора KI, следовательно, общий объем (в литрах, н. у.) затраченной смеси газов равен 1) 5,6 2) 56 3) 11,2 4) 112
10. Через озонатор пропустили кислород, полученный при прокаливании 1 моль КClO3 на катализаторе, при этом 5 % кислорода превратилось в озон и на выходе из озонатора объемное отношение O2: O3 составило 1) 23: 1 2) 23: 2 3) 29: 1 4) 29: 2
|
|