|
|
Электролитпен коагуляциялау кинетикасы 13 глава
2.2. Катиондық БАЗ
Катиондық БАЗсуда диссоцияциялана отырып, оң зарядталған беттік-активтік иондар түзеді. Мұндай БАЗ ерітінділерінен бетке катиондар адсорбциялнады, осының нәтижесінде ол оң зарядталады. Көптеген жағдайда ол практикалық қызығушылық көрсетеді. Осындай БАЗ – мен тұрақтанған, оң зарядталған дисперстік фаза бөлшектері тұрақталған аниондық БАЗ-мен теріс зарядталған өсімдік талшықтарымен сіңірілген астаулардан таңдамалы жұтылады. Катиондық БАЗ- ға октадециламмоний хлориді мысал бола алады: C18H37NH3CL Бұларға төртіншілікті орын басқан аммоний негіздері жатады,мысалы цетилтриметиламмоний хлориді:
C16H33 (CH3)3 NCL Мұндай коллоидтық БАЗ – ға басқа азот атомының орнын басқан пиридин қосылыстары мысал бола алады, мысалға, цетилпиридинийхлориді:
Бұл заттар суда сәйкесінше СІ- аниондарына және катиондарға ыдырайды.
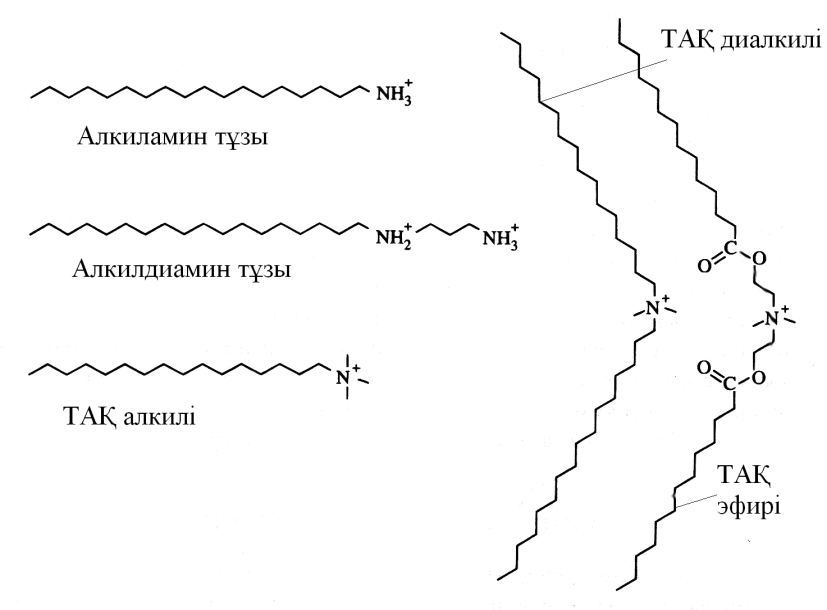
Аниондық және катиондық БАЗ-дың сулы ерітіндіде бір уақытта болуы әдетте мүмкін емес, себебі мұндай ерітіндіде үлкен катионнан және анионнан үлкен молекулалық массалы әлсіз диссоцияцияланатын, іс жүзінде суда ерімейтін тұз түзіледі. Көптеген катиондық БАЗ-дың оң зарядты құрайтын азот атомы болады, яғни олар аминдерге немесе төртіншілікті аммоний қосылыстарына жатады. Аминдер тек протондық күйде БАЗ-дың қасиеттерін көрсетеді, сондықтан оларды жоғары РН-та қолдануға болмайды. Керісінше, төртіншілікті аммоний қосылыстар (ТАҚ) РН-тың өзгеруіне сезімтал емес. Аминдер көп зарядталған аниондардың әсеріне өте сезімтал болып келеді. Бұрынырақ айтылғандай, этоксилилренген аминдер иондық емес және катиондық БАЗ-тар қасиеттерін көрсетеді және оксиэтиленнің тізбегі ұзын болған сайын, сондай қосылыстардың иондық емес БАЗ-дың қасиеті көп болады. Катиондық БАЗ-дың кейбіреулері 3-суретте келтірілген. Күрделі эфирлі тобы бар төртіншілікті аммоний қосылыстары БАЗ- дың экологиялық қауіпсіз жаңа класы ретінде қарастырылады. Өйткені олар матаны жұмсарту үдерісінде диалкилді туындыларды ығыстырады.
3 - сурет. Кейбір катиондық БАЗ-дың құрылымдары Эфирлі емес төртіншілікті аммонийлы БАЗ синтезі нитрилді байланыстың түзілуімен жүреді. Май қышқылдары жоғары температурада, сәйкесінше нитрилді түзе отырып, аммиакпен әрекеттеседі.Бұл реакция аралық амидтің түзілуі сатысымен жүреді. Сонымен қатар, нитрил катализатор қатысында (кобальт немесе никель) біріншілікті аминге гидрленеді :
Екіншілікті аминдерді тікелей нитрилден алады, кейде біріншілікті аминді екі сатымен алады. Бірінші процесте көріп отырғанымыздай, аралық иминнің түзілуімен жүреді, ал аммиак екіншілікті аминнің түзілуін жеңілдететін реакциялық қоспадан ылғи шығарылып тұрады:
Біріншілікті аминдер цианэтилдеу көмегімен ұзынтізбектелген 1.3 диаминге айналады:
Біріншілікті немесе екіншілікті ұзынтізбекті аминдерді метилдеп үшіншілікті аминдерге айналдыруға болады. Мысалы, формальдегид реакциясымен тотықсыздандыру жағдайында:
R (CH2)2NH + HCHO +H2 → (R – CH2)2NCH3
Алкилдеуші агент ретінде біріншілікті және екіншілікті аминдерді үшіншілікті амин түріне айналдыру үшін этилендиоксидін қолдануға болады. Төртіншілікті аммоний қосылыстарын алкилдеуші агент реакциясына сәйкес келетін үшіншілікті аминдерден алады. Мысалы, хлорлы немесе бромды метилден немесе диметилсульфаттан. Реагентті таңдауды БАЗ-дың қарсы иондары анықтайды:
Төртіншілікті аммоний БАЗ – ын әдетте күрделі эфирлі топтары болатын (күрделі – эфирлі ТАҚ), май қышқылын этерификациясынан (немесе май қышқылының туындысынан), амил спиртімен, одан соң жоғарыда көрсетілгендей N – алкилдеу арқылы алады. Мысалы ретінде, амин спирті триэтанолмен және метилдеу агенті ретінде диметилсульфатты алынған реакцияны көрсетуге болады.
Құрамында азоты бар қосылыстар катиондық БАЗ-дың негізгілерін құрайды. Алaйда, сондай-ақ фосфонды, сульфонды және сольфонсонды БАЗ-дар да болады. БАЗ-дың алғашқы 2 түрін триалкилфосфинді немесе диалкилсульфидті алкилхлоридпен өндеу арқылы алады. Фосфиндық БАЗ-дың синтезі төменде көрсетілген:
Сульфоксондық БАЗ-ды сульфон тұздары сутек пероксидімен тотықтыру арқылы алады. Өнеркәсіпте азотты емес катиондық БАЗ-ды қолдану тиімсіз, өйткені ең арзан азоты бар БАЗ-ға қарағанда бұлардың артықшылықтары шамалы ғана. Айтарлықтай, бір ғана ұзыналкилді тізбегі және үшметилді тобы бар фосфонды БАЗ-тар биоцид ретінде қолданылады. Кейбір беттер – металдар, минералдар, пластинкалар, талшықтар, клеткалы жарғақтар және т.б – теріс зарядталған. Катиондық БАЗ-ды басты пайдалану олардың теріс зардяталған бетте адсорбциялану қабілеттілігіне негізделген. Олардың кейбір мысалдары 1-кестеде көрсетілген.
1-кесте: Бетте адсорбциялануына байланысты катиондық БАЗ-ды қолдану.
Катиондық БАЗ-дың негізгі сипаттамалары ретінде мыналарды айтуға болады: Катиондық БАЗ-тар көп таралған үшіншілік БАЗ-дың класы болып табылады. Олар, әдетте, аниондың БАЗ-ға сәйкес емес (кейбір ғана жағдайлар болмаса). Басқа БАЗ-дың кластарына қарағанда, катиондық БАЗ-тар гидролизге тұрақты, сулы ортада өте улы. Катиондық БАЗ-тар іс жүзінде әртүрлі беттерде жақсы адсорбцияланады және оларды негізінен беттерде in situ модифицирлеу мүмкіндігіне олардың негізгі пайдалануы негізделген.
2.3. Иондық емес БАЗ (ИЕБАЗ) Иондық емес БАЗ (ИЕБАЗ).Мұндай БАЗ-дың дифильдік молекулалары әдетте осы заттардың ерігіштігін болдыратын бірнеше полярлы, бірақ иондық емес топтары бар ұзын көмірсутектік тізбектен тұрады. Ондай топтарға әдетте гидроксильдік немесе эфирлік топтар жатады. Иондық емес БАЗ-дың мысалына жоғары молекулалық спирттің (немесе басқа қышқыл, фенол сияқты органикалық қосылыстың) бір молекуласымен этилен оксидінің бірнеше молекуласының әрекеттесуінен алынатын қосылыстар жатады:
ИЕБАЗ-дың молекуласын сұлбалық түрде былайша көрсетуге болады:
Оксиэтилендік тізбек эфирдегі оттек атомының сумен әрекеттесуінің салдарынан біраз гидрофильділік көрсетеді. Ерітіндіде оралмалар түзетін және қажетті ұзындыққа ие, сумен гидратты байланысқан оксиэтилендік тізбек суды энтропиялық эффекті арқылы байланыстырады. Сондықтан молекулалық салмағы мен молекуланың гидрофобтық бөлігінің құрылысына тәуелді оксиэтилен тобының белгілі-бір санынан бастап қосылыстың өнімдері суда ерігіштік қабілет алады. Оксиэтилденген БАЗ-дың негізгі артықшылығы, оның синтезі кезінде гидрофильдігін гидрофобтық тізбектегі көміртек атомдар санының өзгерісі арқылы ғана емес, сонымен қатар оксиэтилен топтары арқылы реттеуге мүмкіндік туатындығында. Осыған орай нақты қолданыс саласына есептелген, алдын-ала таңдалған қасиеттері бар заттар алуға болады. Бұл заттардың келесі ерекшелігі болады, олар тұздар түзбейді және соған байланысты кермек суда жақсы ериді. Сонымен қатар, ионды емес БАЗ-дар, иондық БАЗ-дармен бірге қолданылуы мүмкін. Иондық емес БАЗ-дардың сулы ерітінділердегі десорбциясы гидрофобтық беттерді гидрофильді беттерге айналдырады. Сонымен ионогендік емес БАЗ құрамында полярлы топша ретінде иә полиэфирлі, иә полигидроксиді фрагменттер болады. Көптеген БАЗ құрамында этиленоксидті полимеризациясы арқылы алынған оксиэтиленді топша болады. Кеңінен таралған БАЗ құрамында оксиэтиленді тармақтар полярлы топша 5-10 дейін болады, бірақ кейбір БАЗ, мысалы диспергаторлар құрамында ұзын оксиэтиленді тізбектер бар. Этоксилирлеуді активті сутек атомы болатын кез-келген затпен жүргізуге болады. Әдетте оксиэтиленді неионогендік БАЗ-ды алу үшін бастапқы шикізат ретінде алифатты спирттерді, алкилфенолдарды, май қышқылдарын, алифатты аминдерді қолданады. Күрделі эфирлерді, мысалы глицеридті майларды этоксилирлеуді бір реакторда күрделі эфирлі байланыстың сілтілік гидролизі жүріп, әрі қарай түзілген спирт пен қышқылдың этоксирленуі олардың конденсациялануымен қатар жүретін процеспен жүргізуге болады. Полигидроксильді БАЗ-ға мысал ретінде сахароза мен сорбиттердің күрделі эфирлерін алуға болады, алкилглюкозидтер, полиглицеридтер. БАЗ-ды көпатомды спирттер негізінде этоксилирлеуге болады. Ең көп таралған мысалдар- май қышқылдары мен сорбиттің эфирлері (сорбитаны, спаны), сәйкесінше этоксилирленген өнімдер (твин). Сорбитанның бес мүшелі сақиналы структурасы өндіріс процесі кезінде сорбиттің дегидратациясы нәтижесінде түзіледі. БАЗ сорбитан негізінде тамақ өндірісінде, дәрі-дәрмек өндірісінде қолдануға болады. Ацетиленді гликольдер-құрамында ацетиленді байланыс бар және көршілес көміртек атомдарында гидроксиль топтары болатын БАЗ. Мұндай заттар әсіресе беттерді жабатын лактар өндірісінде маңызды орын алады. 4-суретте ең кең таралған ионогендік емес БАЗ-ң молекулаларының құрылымы көрсетілген. Май қышқылдарының этоксилаттары құрамында қосалқы өнімдер көп мөлшерде болатын күрделі қоспалар береді. Неионогендік емес БАЗ-ң маңызды типі этоксилирленген алифатты спирттер болып табылады. Олар сұйық және ұнтақ жуғыш заттар құрамында қолданылады және өндірісте кеңінен қолданылады. Сондай-ақ «судағы май» типті майғындарды тұрақтандырғыш ретінде қолданылады; этоксилирленген спирттерді рН-тың кең диапазонында гидролизге тұрақты деп қарастыруға болады: рН=3÷11. Олар ауада баяу тотығып, альдегиттер мен гидропероксидтер түзеді; бұл өнімдер теріге алғашқы БАЗ-ға қарағанда кері әсер етеді. Бұл кітапта этоксилирленген майлы спирттер СmEn деп белгіленген, m-спирттегі алкилді тізбегінің көміртек саны, n-БАЗ-дағы оксиэтиленді тармақ саны.
4-сурет. Кейбір типтік иондық емес БАЗ- дың құрылымдары.
Иондық емес БАЗ туралы мынадай негізгі мәліметтерді айтуға болады: - Иондық емес БАЗ таралуы бойынша екінші орындағы БАЗ класы. - Олар БАЗ-дың басқа кластарымен бір ортада бола алады. - ИЕБАЗ кермек суға сезімтал емес. - Олардың физика-химиялық қасиеттеріне электролиттер аз әсер етеді (иондық БАЗ-ға қарағанда). - Этоксилирленген қосылыстардың физика-химиялық қасиеттері температураға тәуелді. Иондық БАЗ-ға керісінше, ионогенді емес БАЗ температура жоғарылаған сайын судағы ерігіштігі төмендейді (жоғалады) және гидрофобтық қасиеті жоғарылайды. Полиоксиэтиленді тізбектері бар ИЕБАЗ-дың суда ерігіштігі температураға кері пропорционал болады. Температура жоғарылағанда жүйе екі фазаға бөлінеді. Жүйенің екі фазаға бөлінуі жүретін температура ерітінді бұлыңғыр бола бастағандықтан, бұлыңғырлану температурасы деп аталады. Бұл температура гидрофобтық бөліктің ұзындығы мен БАЗ молекуласы құрамындағы оксиэтиленді топшалар санына тәуелді, әрі оны жоғары дәлдікпен анықтауға болады. Полиоксиэтилендік БАЗ өндірісінде бұлыңғырлану температурасын этоксилирлену дәрежесін бақылап отыру үшін қолданады. Жүйенің бұлыңғырлануы БАЗ-ң концентрациясына байланысты өзгеретіндіктен, стандартты тест- әдіс бойынша бұлыңғырлану нүктесін ИЕБАЗ-ң 1%-дық ерітіндісін бұлыңғырлану температурасынан жоғары температурада қыздырып, сосын үлгіні баяу етіп салқындату арқылы мөлдірлену температурасын тіркеп (анықтап) алады. Ұзын полиоксиэтиленді тізбектері бар БАЗ бұлыңғырлану температурасы 1000С-тан жоғары. Мұндай заттар ұшін бұлыңғырлану температурасын электролиттер ерітіндісінде анықтайды, себебі көптеген тұздар бұлыңғырлану температурасын төмендетеді. Этоксилирленген триглицеридтер, мысалы үпілмәлік майының этоксилаттары рынокта нақты (жоғары, тұрақты) позицияда тұрады, оларды көбінесе жартылай табиғи БАЗ деп атайды. Кейінгі жылдары метилэфирінен этоксилирлеу үдерісін арнайы катализатор қатысында (магний-алюминий гидроксикарбонаты) жүргізу арқылы алатын майлы қышқылдардың этоксилирленген метилэфиріне сұраныс өсті. Метил эфирлердің этоксилаттары этоксилирленген спирттерге қарағанда суда жақсы ериді. Суда жақсы еріп, жоғары беттік активтік қасиетке ие БАЗ әртүрлі композицияларда өте қажет.
«Тұйық» БАЗ н- спирттердің этоксилаттарымен салыстырғанда сілті ерітінділеріне, тотықтырғыштарға тұрақты болып келеді. Олардың сондай-ақ көбіктүзгіштік қабілеті төмен болады.
2.4 Цвиттер-иондық БАЗ
Цвиттер-иондық БАЗ-дың молекулаларында екі қарама-қарсы зарядталған топ болады. Әдебиеттерде оларды жиі амфотерлік деп атайды. Бірақ ол қате, өйткені «цвиттер-иондық» және «амфотерлік» терминдері синоним емес. Амфотерлік БАЗ ерітіндінің рН-на байланысты катиондық, цвиттер-иондық және аниондық БАЗ бола алатын заттар. Оған мысал амин қышқылдары. Цвиттер-иондық БАЗ рН-тың кең диапазонында зарядтардың біреуін ғана сақтайды. Оң заряд әрқашан аммоний тобымен қамтамасыз етеді, ал теріс зарядталған топтар әр түрлі болуы мүмкін, теріс зарядтар көбінесе карбоксилат ионмен қамтамасыз етіледі. Мұндай БАЗ кейде амфотерлікке де жатады, бірақ жоғарыда қарастырылғандай бұл терминдер (амфотерлік және цвиттер иондық) әр түрлі мағына береді. Амфотерлі БАЗ-дың зарядтары рH-қа тәуелді өзгереді, яғни қышқылдан сілтіге дейін рH-тың өзгеруінен БАЗ-дың катиондықтан цвиттер-иондыққа, одан аниондық БАЗ-ға дейін БАЗ-дың типі (түрі) өзгереді. Қышқылдық топтардың да, негіздік топтардың да тұрақты зарядты болмайды. Мұндай БАЗ-дар бегілі бір рH интервалында цвиттер иондық БАЗ болады. Амфотерлік БАЗ -дың рH-ның өзгеруі зарядтарды өзертеді, әрине оның көбік түзуші және жуғыш қабілеті, жуғыш әсері сияқты қасиеттеріне әсер етеді, яғни БАЗ-дың басты қасиеттері рH-қа тәуелді болады. Изоэлектрлік нүктеде осындай БАЗ-дың физика-химиялық қасиеті иондық емес БАЗ-дың қасиетіне ұқсас болып келеді. Изоэлектрлік нүктенің төменгі және жоғарғы жағында катиондық немесе аниондық сипаты бар. БАЗ-ға сәйкес болады. Сульфатты немесе сульфонатты топтар бар БАЗ-тар молекулалардың теріс зарядын қамтамасыз етеді, моноалкилді және алкилсульфонды қышқылдарының рКа-сының мәні өте төмен болғандықтан, олар рН-тың өте төменгі мәндерінде цвиттер-иондық болып қалады. БАЗ-дың цвиттер-иондық түрлері қарапайым аминқышқылдардың (мысалы, глицин (NH4CH2COOH), бетаин ((CH2)2NCH2COOH), аминопропион қышқылы (NH2CH2CH2COOH) N – алкилтуындылары жатады. Мұндай БАЗ-ды аминқышқылдардан алмайды, ұзынтізбекті аминдердің натрий хлорацетатының немесе акрил қышқылының туындыларының реакцияларымен алады, сонда көміртектінің бір немесе екі атомының сәйкесінше азотпен және карбоксилат тобымен құрылымын түзеді. Мысал ретінде, төменде алкилдиметиламиннен және натрий монохлорацетатынан алынған БАЗ-ды бетаин туындыларын алудың реакциясының сұлбасы көрсетілген:
Амидбетаин туындыларын алу, амидаминнің алынуына ұқсас :
Цвиттер-иондық БАЗ-дың әдетте имидазолиндер деп аталатын басқа түрін май қышқылы мен аминоэтилэтанолымен реакциясымен синтездеп, содан соң хлорацетатпен өндеу арқылы алады. БАЗ-дың бұл түрінің наменклатурасы соңғы өнімде имидазольдік соңына өте күрделі, бірақ кейіннен бесмүшелі сақина синтезтік екінші сатысында үзілетіні белгілі болды. Мұндай реакциялардың тізбектері мынадай:
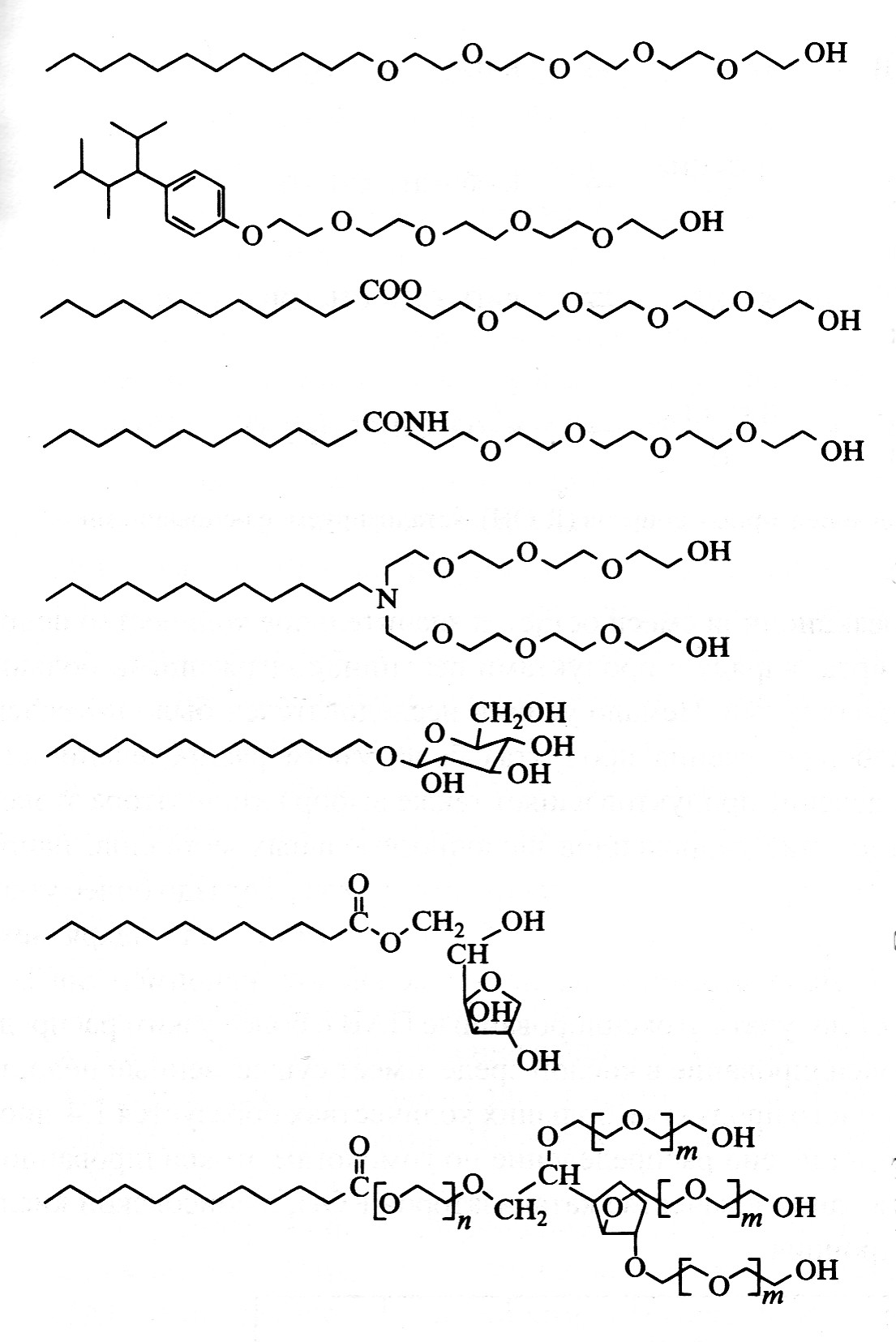
Цвиттер-иондық БАЗ өте жақсы дерматологиялық қасиетімен сипатталады, көзге тітіркену әсерін бермейтіндіктен косметикалық заттарда және шампундарда колданады. Мұндай БАЗ-ң молекуласының жиынтық заряды нолге тең болғандықтан, олар иондық емес БАЗ сияқты, электролиті көп композицияларда да қасиеттерін жоғалтпайды. Дәстүрлі түрде цвиттер – иондық БАЗ таза сілтілік заттарда қолданылады. 5- суретте цвиттер-иондық БАЗ-дың түрлеріне мысал келтірілген, ал 1.7-кестеде БАЗ-дың осы класының ақпараттары жазылған. Бұрын ескертілгендей, аминоксиді БАЗ немесе дұрысы үшіншілікті аминдердің N-оксидтері кей-кезде цвиттер-иондық, кейде иондық емес, ал кейде катиондық БАЗ-ға жатады.
5-сурет. Кейбір типтік цвиттер-иондық БАЗ.
Формальді түрде олар азоттың және оттектің атомдарында бөлінген зарядтары болады және кейде бейэлектролит сияқты қасиет көрсетеді, бірақ төменгі рН-та немесе аниондық БАЗ қатысында олар протонды қабылдап, катион қышқылын түзеді: 1:1 қатынастағы валенттік тұз, аниондық БАЗ және протондалған аминоксид арасында түзіледі, мұндай тұздардың активтілігі жоғары болады. Аминдердің оксидтерін сәйкесті үшіншілікті аминдері сутек пероксидімен тотықтыру арқылы алады. Цвиттер-иондық БАЗ туралы мынадай маңызды мағлұматтарды айтуға болады: Бұл БАЗ-дың ең аз класы (цвиттер-иондық БАЗ-р қымбат тұратын болғандықтан аз қолданады). Олар БАЗ-дың басқа түрлерімен бірге қолданылады. Кермек суға сезімтал емес. Қышқыл және сілтілік орталарда тұрақты, мысалы бетаиндер өте сілтілі ортада беттік активтіліктерін сақтайды. Көп жағдайда денеге және көзге тітіркену әсерін бермейді, сондықтан жеке гигиеналық және шампундардың құрамында болады.
3. Коллоидтық БАЗ-дың негізгі ерекше қасиеттері. Коллоидтық БАЗ-дың басты ерекшелігі – олардың тұрақты (лиофильдік) гетерогендік дисперстік жүйелер (ассоциациалық немесе мицеллалық коллоидтар) түзуі. Коллоидтық БАЗ басқа ерекше қасиеттері: олардың беттік активтілігінің жоғары болуы; өздігінен мицелла түзу қабілеттігі, ол БАЗ-дың концентрациясы мицелла түзілудің кризистік концентрациясы (МТКК) деп аталатын белгілі бір концентрацияда жүзеге асады. БАЗ ерітінділерінің солюбилизацияға – заттың ерігіштігінің олардың мицелланың ішіне «енуіне» байланысты күрт өсуіне – қабілеттілігі; әртүрлі дисперстік жүйелерді стабилизациялау (тұрақтандыру) қабілеттігі. Енді осыларды жеке-жеке қарастырайық.
3.1. Коллоидтық БАЗ-дың беттік активтілігі Коллоидтық БАЗ-дың беттік активтілігі жоғары болады, ол көмірсутектік радикалдың ұзындығына байланысты. Радикалдың ұзындығы бір метилен – СН2 тобына артуы оның беттік активтілігінің шамамен 3,2 есе өсуіне (Дюкло-Траубе ережесі) әкеп соғады. Бұл заңдылық БАЗ-дың шын және сұйық ерітінділеріне қолданылады. Оның радикалы неғұрлым ұзын болған сайын соғұрлым ол сулы ерітіндіден ерігіштігінің азаюынан итеріледі, ендеше Генри константасы БАЗ үшін олардың беттік активтілігіне пропорционал болғандықтан арта түседі. Ендеше адсорбция жұмысының өзгеруі
мұндағы: Генри константасы мен адсорбция жұмысы мынадай қарым-қатынаста болады:
мұндағы: А – БАЗ адсорбциясының шамасы. С – БАЗ-дың ерітінді көлеміндегі тепе-теңдік концентрациясы. (2)-теңдік Генри константасы, ендеше беттік активтіліктің БАЗ-дың молекуласындағы СН2 – тобының артуына байланысты еселік санымен артатынын көрсетеді. Бірдей температурадағы БАЗ-дың гомологтық қатарындағы екі көрші мүшесінің беттік активтілігінің қатынасы мынаған тең:
(3)-теңдік Дюкло-Траубе ережесін анықтайды. Ол тұрақты шама, 20 0С температурада сулы ерітінділер үшін ≈ 3,2-ге тең. 20 0С-ден басқа температурада оның мәні басқа болады. Температура артқан сайын оның мәні кеми береді. Органикалық ортада Дюкло-Траубе ережесі керісінше орындалады, яғни БАЗ-дың молекуласындағы көмірсутектік радиусының ұзындығы артқан сайын беттік активтілік төмендейді. Көмірсутектік радикалдардың ұзындығы өте артқан да олардың молекулаларының арасындағы әрекеттесу болады, сондықтан олардың беттік активтілігі Дюкло-Траубе ережесіне қарағанда баяу артады. Дегенмен көмірсутектік радикал ұзындығы артқан сайын БАЗ-дың беттік активтілігі артады. |
|
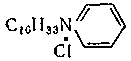
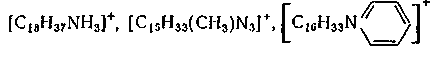
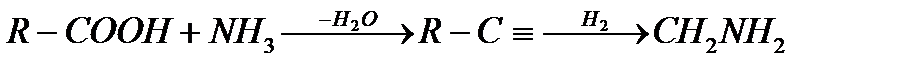
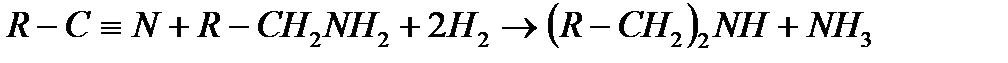
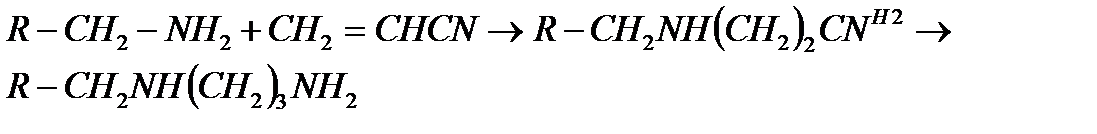
 және
және 
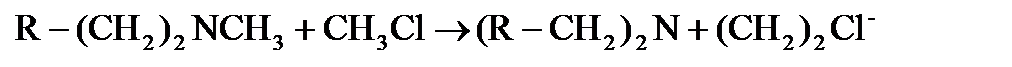

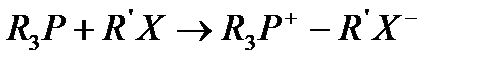
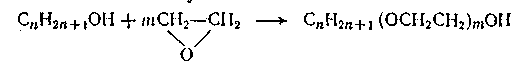




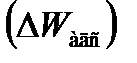 немесе теріс таңбамен алынған Гиббс адсорбциясының энергиясының өзгеруін былай жазуға болады:
немесе теріс таңбамен алынған Гиббс адсорбциясының энергиясының өзгеруін былай жазуға болады: (1)
(1) - бір СН2-ге есептелген БАЗ молекуласының адсорбция жұмысы;
- бір СН2-ге есептелген БАЗ молекуласының адсорбция жұмысы; 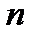 - БАЗ-дағы СН2тобының саны;
- БАЗ-дағы СН2тобының саны;  - Авогадро саны.
- Авогадро саны. (2)
(2) (3)
(3)